基于转录组测序的木薯性别决定相关基因挖掘
2020-11-02韦丽君俞奔驰宋恩亮郑华卢赛清付海天
韦丽君 俞奔驰 宋恩亮 郑华 卢赛清 付海天

摘要:【目的】明確木薯不同性型花的转录组差异,为深入研究木薯多开雌花和两性花及协调木薯性别比例提供理论参考。【方法】以木薯雄蕾、雌蕾和两性蕾为供试材料,采用Illumina HiSeqTM 4000测序平台对其进行转录组测序,通过生物信息学对转录本进行比较分析,预测和筛选出木薯性别决定相关基因。【结果】通过转录组分析获得高质量序列(Clean reads)64189053个,高质量碱基19.29 Gb。3种花蕾的GC含量均在43.00%左右、Q30均在95.00%左右。木薯雄蕾、雌蕾和两性蕾的Clean reads总数分别为42642272、42172402和43563432条,其中,参考基因组和单端的比对率均在77.00%左右、多位置比对率均小于0.80%,正、负链比对率均在39.00%左右;约有90.00%的序列定位于外显子,仅有5.00%的序列定位于内含子或基因间区。在雄蕾—雌蕾(前者是对照,后者是处理,下同)、雄蕾—两性蕾和雌蕾—两性蕾3个对比组中分别筛选到3629、2499和2492个差异表达基因(DEGs),注释到GO功能数据库中的DEGs分别为2544、1749和1807个,其中,雄蕾—雌蕾对比组的上调表达基因和下调表达基因数量均最多。以富集于生物学过程(主要为代谢过程和细胞过程)的DEGs最多,其次是分子功能(主要为结合和催化)和细胞组分(主要为细胞和细胞部分);无论是注释到GO功能数据库的DEGs,还是注释到生物学过程、细胞部分和分子功能等主要次级分类中的DEGs,均以雄蕾—雌蕾对比组最多。3个对比组中均以参与激素信号传导的DEGs最多;且又以富集于一般功能预测的DEGs最多,其次是富集于转录的DEGs,富集于复制、重组和修复及信号传导机制的DEGs也较多,但雄蕾—雌蕾对比组大部分GOG功能类别的DEGs明显多于雄蕾—两性蕾和雌蕾—两性蕾对比组,而雄蕾—两性蕾与雌蕾—两性蕾对比组间差异不明显。3个对比组的DEGs富集于50条KEGG信号通路,其中以富集于植物激素信号传导的DEGs最多,共筛选获得88个与激素信号转导相关的DEGs,其中log2FC>3的基因有26个,且大多数为生长素相关的基因。木薯雄蕾、雌蕾和两性蕾间差异表达的转录因子基因有196个,log2FC>3的转录因子基因有87个,主要为ERF、bHLH、WRKY和MYB四大类转录因子基因。【结论】木薯不同性型花存在较多的DEGs,其中与生长素及ERF、bHLH、WRKY和MYB转录因子相关的基因均与木薯性别决定密切相关,可能是木薯性别分化的关键调控基因。
关键词: 木薯;性别决定;基因挖掘;差异表达基因(DEGs);激素信号传导;转录组测序
中图分类号: S533.035.3 文献标志码: A 文章编号:2095-1191(2020)08-1785-12
Gene mining for sex determination in cassava(Manihot esculenta Crantz) based on transcriptome sequencing
WEI Li-jun, YU Ben-chi*, SONG En-liang, ZHENG Hua, LU Sai-qing, FU Hai-tian
(Guangxi Subtropical Crops Research Institute, Nanning 530001, China)
Abstract:【Objective】Transcriptome difference of cassava flowers with different sex-types were studied to provide theoretical basis for cassava developing more female flowers and bisexual flowers, and further for controlling the proportion of cassava flowers sex. 【Method】The transcriptome of male buds,female buds and bisexual buds from cassava were sequenced with Illumina HiSeqTM 4000 platform. Comparative analysis of transcription through bioinformatics was performed to predict and screen for the genes involved in cassava sex determination. 【Result】The results showed that a total of 64189053 clean reads and 19.20 Gb clean bases were obtained,the GC content of the three buds were about 43.00% and the Q30 were about 95.00%. For male buds, female buds and bisexual buds, total clean reads were 42642272, 42172402 and 43563432, respectively. The proportion of reference genome, unique mapped reads, multiple mapped reads, reads Map to “+”, and reads Map to “-” were 77.00%, 77.00%, less than 0.80%, 39.00% and 39.00%, respectively. About 90.00% of the reads were identified in exon, and about 5.00% were identified in intron or gene interval. Differential expression analysis showed that 3629,2499 and 2492 differentially expressed genes(DEGs) were successively found in male buds-female buds(M-F), male buds-bisexual buds(M-B) and female buds-bisexual buds(F-B)(the former one was control, the latter was treatment), in which, 2544, 1749 and 1807 DEGs were annotated to GO function database, respectively. The down-regulated and up-regulated genes were the most in the M-F group among the three comparisons. The DEGs were mainly involved in biological processes(mainly metabolic process and cell process), and secondly involved in molecular functions (mainly binding and catalysis) and cellular component(cell and cell part). The quantities of DEGs annotated to GO database, or annotated to the biological process, cellular component or molecular function in the M-F were higher than those in the other comparisons. For all comparisons, the quantities of DEGs involved in hormone sig-naling transduction were always the most among all KEGG pathway. The main functions involved in DEGs were generally functional prediction,followed by transcription, replication, recombination and repair, and signaling transduction mechanisms, in which, the quantities for M-F exceeded those for the M-B and the F-B. And the DEGs were not significantly different between the latter two treatments. In all treatments, a signal transduction mechanisms. DEGs were enriched in 50 KEGG signaling pathways,including the largest number of plant hormone signal transduction. Through further screening, a total of 88 hormone-related genes were obtained, including 26 genes with log2FC>3, and the most involved in auxin. A total of 196 transcription factors were obtained,including 87 genes with log2FC>3,and mainly involved in ERF, WRKY, bHLH and MYB. 【Conclusion】There are many differentially expressed genes in different sex-types flowers in cassava. Auxin, ERF,WRKY,bHLH and MYB transcription factor related genes are closely related to sex determination of ca-ssava, they may be the key regulatory factors of cassava sex determination.
1. 4 数据分析
原始测序数据(Raw data)以FASTQ格式保存,经匹配及过滤低质量碱基后得到高质量序列(Clean reads),再与参考基因组比对得到比对序列(Mapped reads)。从NCBI数据库搜索下载参考基因组。然后通过比对效率(Mapped ratio)和Clean reads在参考基因组上的分布情况判定比对结果是否合格,合格的Clean reads可用于后续的生物信息学分析。
1. 5 差异表达基因(DEGs)筛选
应用Cufflinks中的Cuffquant和Cuffnorm组件,结合Mapped reads在基因组上的位置信息定量转录本及基因表达水平。采用FPKM(Fragments per kilobase per million mapped reads)表示转录本或基因表达水平,并以Benjamini-Hochberg校正p值(p-value)。以表达差异倍数(Fold change,FC)结合错误发生率(False discovery rate,FDR)筛选DEGs,即以FC≥2且FDR≤0.01为标准,利用EBseq进行差异表达基因分析(Leng et al.,2013),筛选出log2FC>3的差异表达显著基因。
1. 6 统计分析
采用Excel 2010统计试验数据,绘制DEGs数量柱形图及其COG分类图;利用topGO绘制DEGs的GO功能富集图;并以KOBAS绘制DEGs显著富集的KEGG信号通路富集图。
2 结果与分析
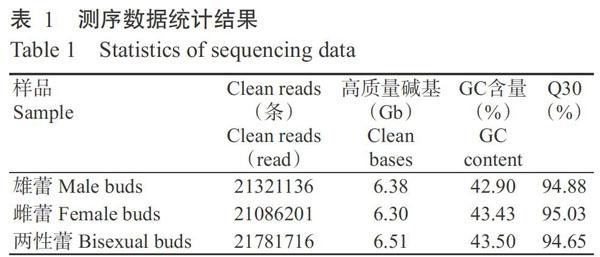
2. 1 木薯花蕾测序数据及质量分析结果
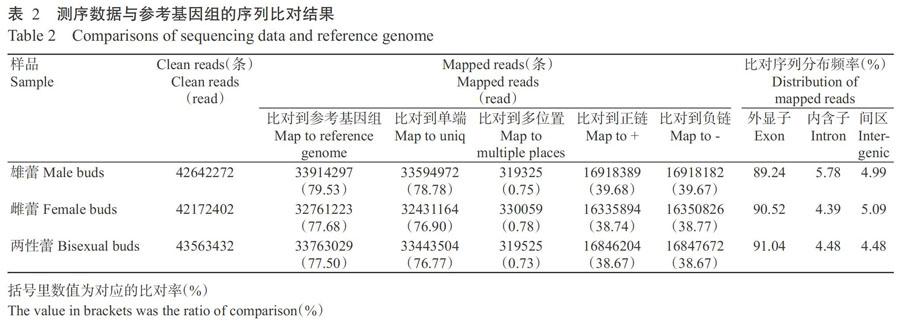
Raw data经过滤去杂后,共得到64189053条Clean reads,高质量碱基19.29 Gb,每个样品的高质量碱基均在6.30 Gb以上。3种花蕾的GC含量均在43.00%左右、Q30均在95.00%左右(表1),表明测序质量良好。将测序数据与参考基因组序列进行比对,结果如表2所示。木薯雄蕾、雌蕾和两性蕾对比到参考基因组上的Clean reads分别为42642272、42172402和43563432条,其中,参考基因组和单端的比对率均在77.00%左右、多位置比对率均小于0.80%,正、负链比对率均在39.00%左右,表明试验污染少、测序数据质量较好。从比对序列分布情况看,约有90.00%序列定位于外显子,仅有5.00%左右的序列定位于内含子和基因间区。序列比对到内含子和基因间区分别是由于mRNA前体、发生可变剪切的内含子保留或基因组注释不完善所致。
2. 2 木薯不同花蕾间的DEGs分析结果
根据DEGs筛选标准,在雄蕾—雌蕾(前者是对照,后者是处理,下同)、雄蕾—两性蕾和雌蕾—两性蕾3个对比组中筛选到的DEGs分别为3629、2499和2492个(图1),其中上调表达基因分别为2290、1718和1340个,下调表达基因分别为1339、781和1152个,即雄蕾—雌蕾对比组中上调表达和下调表达的基因数量均最多。雄蕾—两性蕾对比组上调表达和下调表达的基因数量差异最大,上调表达基因数量是下调表达基因数量的2.20倍,其次为雄蕾—雌蕾对比组,上调表达基因数量是下调表达基因数量的1.71倍,表明雄蕾—两性蕾和雄蕾—雌蕾对比组的DEGs以上调表达为主、下调表达为辅。
2. 2. 1 DEGs的GO功能富集分析结果 雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组注释到GO功能数据库中的DEGs分别为2544、1749和1807个。对DEGs的GO功能进行富集分析,结果(图2)顯示,3个对比组均以富集于生物学过程的DEGs最多,其次为分子功能,以富集于细胞组分的DEGs最少。在生物学过程方面,雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组均以富集于代谢过程的DEGs最多,分别为1577、1087和1148个,其次为细胞过程,分别为1348、932和946个,富集于单细胞过程的DEGs数量也较多,分别为1302、935和946个。在细胞组分方面,雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组均以富集于细胞和细胞部分的DEGs较多,其中,富集于细胞的DEGs分别为994、716和699个,富集于细胞部分的DEGs分别为999、720和703个;富集于细胞器的DEGs也较多,分别为672、485和471个。在分子功能方面,雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组均以富集于催化活性和结合的DEGs较多,其中富集于催化活性的DEGs分别为1373、954和1002个,富集于结合的DEGs分别为1369、946和940个。可见,在GO功能富集分析中,无论是注释到GO功能数据库的DEGs,还是注释到生物学过程、细胞部分和分子功能等主要次级分类中的DEGs,均以雄蕾—雌蕾对比组最多。
2. 2. 2 DEGs的KEGG信号通路富集分析结果
KEGG信号通路富集分析结果显示,3个对比组的DEGs均注释到KEGG数据库的50条信号通路上,且这50条信号通路可划分为细胞过程、环境信息处理、遗传信息处理、代谢和有机系统五大类。其中,雄蕾—雌蕾对比组的DEGs主要参与在植物激素信号传导、苯丙素的生物合成、内质网中的蛋白质加工、淀粉和蔗糖代谢、嘌呤代谢及嘧啶代谢等通路(图3);雄蕾—两性蕾对比组的DEGs主要参与植物激素信号传导、淀粉和蔗糖代谢、氨基酸的生物合成、苯丙素的生物合成及嘌呤代谢等通路(图4);雌蕾—两性蕾对比组的DEGs主要参与植物激素信号传导、苯丙素的生物合成、内质网中的蛋白质加工、淀粉和蔗糖代谢及苯丙氨酸代谢等通路(图5)。可见,3个对比组均以参与激素信号传导的DEGs最多,表明植物激素在木薯花性分化中发挥非常重要的作用。
2. 2. 3 DEGs的COG功能注释分析结果 COG功能注释分析结果(图6)显示,3个对比组的DEGs在COG功能类别中的分布频率趋势基本一致。雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组均以富集于一般功能预测的DEGs最多,分别为455、285和293个,其次是富集于转录的DEGs,分别为306、181和190个,富集于复制、重组和修复的DEGs也较多,分别为289、183和183个;雄蕾—雌蕾、雄蕾—两性蕾和雌蕾—两性蕾3个对比组富集于信号传导机制的DEGs分别为269、173和165个。可见,雄蕾—雌蕾对比组大部分COG功能类别的DEGs明显多于雄蕾—两性蕾和雌蕾—两性蕾对比组,而雄蕾—两性蕾和雌蕾—两性蕾对比组间差异不明显。
2. 3 木薯性别决定关键基因筛选结果
2. 3. 1 不同花性型激素相关且差异表达显著基因分析结果 植物激素是性别分化的重要调控因子。对参与木薯雄蕾、雌蕾和两性蕾激素信号转导通路的DEGs进行筛选,结果获得88个与激素信号转导相关的DEGs,其中差异表达显著基因(log2FC>3)有26个,包括编码生长素运输载体蛋白(AUX1)的LAX5基因(gene19403和gene7567),生长素/吲哚-3-乙酸(AUX/IAA)的AUX22(gene18980)和ARF9(gene2348)基因;编码吲哚-乙酸—酰氨基合成酶(CH3)的F24B18.13(gene5960)和OSJNBa0009C 07.16(gene23116)基因;编码生长素上调miRNA(SAUR)的gene1397、gene19365、gene19962、gene 21742、gene23646、gene3612、gene13617、gene5215和gene9869基因;编码B型反应调节因子(B-ARR)的ARR18(gene24542)基因;编码GID1蛋白的T200O 10.110(gene9091)基因;编码蔗糖非依赖蛋白激酶2(SnRK2)的OOSJNBa0017N12.8(gene21379)基因;编码生长素响应因子(ABF)的At2g36270(gene 13760)基因;编码EIN3互作蛋白(EBF1/2)的F13B15.15(gene10983和gene24462)基因;编码ERF1/2的K14B15.15(gene6396)基因;编码D3型细胞周期蛋白(CYCD3)的F28A23.80(gene12887)、CYCD3-2(gene22828)和F28A23.80(gene29777)基因;编码茉莉酸氨基酸合成酶(JAR1)的OSJNBa0009C07.16(gene8657)基因。在雄蕾—雌蕾对比组中,除gene5960、gene1397、gene19365、gene19962、gene21742、gene23646、gene3612、gene9091、gene 21379、gene10983、gene24462、gene6396和gene8657基因显著下调表达外,其余基因均为显著上调表达;在雄蕾—两性蕾对比组中,差异表达显著基因有gene19403、gene7567、gene18980、gene2348、gene 12887、gene22828和gene29777,均呈上调表达;在雌蕾—两性蕾对比组中,差异表达显著基因仅有gene5960、gene1397和gene24462,也均为上调表达。
2. 3. 2 不同花性型差异表达显著转录因子基因分析结果 木薯雄蕾、雌蕾和两性蕾间差异表达的转录因子基因有196个,其中ERF、bHLH、WRKY和MYB 四大类转录因子基因所占比例较高,分别为15.31%、17.86%、15.82%和11.22%,其中,log2FC>3的差异表达显著转录因子基因共87个。
与ERF转录因子相关的差异表达显著基因有16个。其中,在雄蕾—雌蕾对比组中上调表达基因为T13E15.15(gene8938)、MQL5_9(gene830)、T13J8.60(gene8664)、ERF017(gene5340和gene5224)、ERF034 (gene811)和ERF109(gene17566),下調表达基因为K14B15.15(gene6396)、ERF011(gene29765和gene 10121)、ERF112(gene4369)、ERF113(gene17021和gene14536)、ERF114(gene23610和gene11659)和T29J13.210(gene2504);在雄蕾—两性蕾和雌蕾—两性蕾对比组中差异表达显著基因各有2个,分别为gene5224和gene17566、gene17021和gene23610,且均呈上调表达。
与WRKY转录因子相关的差异表达显著基因有12个。其中,在雄蕾—雌蕾对比组中上调表达基因为WRKY21(gene9231)和WRKY50(gene5294),下调表达基因共8个,分别为WRKY3(gene972)、WRKY47(gene8490)、WRKY71(gene3445)、WRKY72(gene26615)、WRKY75(gene11601、gene20201和gene 29166)和WRKY6(木薯新基因);在雄蕾—两性蕾对比组中,差异表达显著基因仅有WRKY21(gene9231),为上调表达;在雌蕾—两性蕾对比组中,上调表达基因共7个,分别为gene972、gene 26615、gene20201、gene11601、WRKY27(gene2799)、WRKY72(gene1819)和WRKY75(gene21757),下调表达基因仅有WRKY13(gene30823)。
与bHLH转录因子相关的差异表达显著基因有16个。其中,在雄蕾—雌蕾比对组中,下调表达基因有3个,分别为T24P15.19(gene13983)、K15N18.2(木薯新基因)和T9N14.4(gene21370),上调表达基因共11个,分别为T28I19.130(gene22708)、MZA15.1(gene27699)、F21F14.120(gene8565)、F2C19.2(gene 27655)、K9D7.15(gene6435)、K21L13.16(gene21284、gene22690和gene29901)和T9N14.4(gene16785、gene 14755和gene26683);在雌蕾—两性蕾对比组中,差异表达显著基因为gene21370、F4F7.28(gene1075)和BHLH84(gene10165),均呈上调表达;在雄蕾—两性蕾对比组中,上调表达基因为gene27699、gene 8565、gene29901、gene22690、gene26683和gene14755,下调表达基因仅有K15N18.2(木薯新基因)。
与MYB转录因子相关的差异表达显著基因有11个。其中,在雄蕾—雌蕾对比组中,上调表达基因为F5E6.18(gene24177)、dl4925c(gene28472和gene 3091)和F21E10.4(gene11478),下调表达基因为MYB23(gene3024)、K8K14.2(gene338、gene9413、gene21632和gene16518)和F21E10.4(gene18714和gene8156);在雄蕾—两性蕾对比组中,差异表达显著基因仅有gene16518,为上调表达;在雌蕾—两性蕾对比组中,差异表达显著基因有gene24177、gene28472和gene11478,也均为上调表达。
与GATA、NAC和AP2/ARF等转录因子相关的差异表达显著基因有32个。其中,在雄蕾—雌蕾比对组中,上调表达基因有23个,分别为AIL1(gene8193和gene18671)、T28I19.30(gene10192、gene29853和gene21252)、VRN1(gene26272)、T24C20.40(gene 11390)、GATA18(gene1303)、F2G19.8(gene29751)、gene3936、ETC1(gene28492)、At1g69490(gene23213)、MFO20.5(gene10053)、T2E6.2(gene29522)、GTE12(gene15183)、gene23167、At1g32640(gene527)、RF2b(gene17041)、MFH8.15(gene11593、gene23355)、TCP15(gene1803)、TCP5(gene11227)和T10P11.13(gene14873),下調表达基因有6个,分别为At1g69490(gene9425)、ONAC010(gene16597和gene14996)、NFYB5(gene9042)、gene31152和T1008.90(gene 16230);在雌蕾—两性蕾对比组中,上调表达基因有gene16597、gene31152、At1g74500(gene23918)和T1008.90(gene16230),下调表达基因仅有T8M 16.100(gene29946);在雄蕾—两性蕾对比组中,差异表达显著基因有gene18671、gene21252、gene29751、gene3936、gene23355、gene1803和TAF8(木薯新基因),均呈上调表达。
3 讨论
近年来,转录组差异分析技术已广泛应用于动植物有关基因的发掘研究。周大颜等(2019)利用RNA-seq技术构建3种白鲫杂交子代转录组文库并进行测序分析,获得参与抗氧化、免疫和生长发育相关的通路和基因序列等,可用于白鲫的选择性育种和分子标记开发等研究。韦丽君等(2020)应用Illumina HiSeqTM 4000测序平台对木薯花芽与叶芽进行转录组测序,结果获得开花相关基因47个,在一定程度上解析了木薯花芽分化的分子机制。在转录组分析研究中,转录组测序数据组装质量评估是功能注释、分类和差异基因筛选的前提(张加强等,2018)。本研究单个样品的高质量碱基数均在6.30 Gb以上,碱基质量值Q30均在95.00%左右,表明碱基识别可靠,准确度高。比对率是转录组数据利用率的最直接体现,在本研究获得的木薯花蕾测序数据中,参考基因组和单端的比对率均较高(在77.00%左右),说明所选参考基因组组装能满足后续信息分析的需求。本研究从木薯雌蕾、雄蕾和两性蕾中得到Clean reads分别为21321136、21086201和21781716条,高质量碱基为6.38、6.30和6.51 Gb,表明这些数据质量和完整性可满足后期分析需要。但与木薯花芽和叶芽的转录组学分析结果(韦丽君等,2020)相比,本研究中的Clean reads和高质量碱基数目较少,可能是不同发育时期的样本差异所致,因为花芽分化是植物从营养生长转为生殖生长的标志,此时芽的外部形态和内在生理生化等均发生明显变化,对应的转录组数据也相对多而复杂。
当前,有关植物性别分化的分子机理研究主要涉及DEGs及有关基因的筛选。闫明科等(2015)对猕猴桃雌花和雄花的miRNA进行测序,结果发现170个miRNA家族成员在雌花和雄花间显著差异表达。闫春冬(2018)研究发现,强雌和强雄材料间的DEGs有可能参与性别分化,进而影响雌花或雄花的转化。本研究结果显示,雄蕾—雌蕾对比组的DEGs数量较雄蕾—两性蕾和雌蕾—两性蕾对比组多,说明雌花和雄花是性状完全不同的两种花,且两性花同时具有雌、雄两种器官,与任一种单性花均存在相似之处。闫明科等(2015)研究显示,猕猴桃雌花和雄花间差异表达显著基因主要富集于细胞组分的细胞和细胞部分、分子功能的结合和催化及生物学过程的代谢过程和细胞过程,与本研究的GO功能富集分析结果一致,说明在不同植物的性别分化过程中,分子间结合和催化反应推进细胞部件重塑新细胞的同时,代谢反应和胞间通讯也非常活跃。此外,植物内源激素参与调控花器官分化过程(Chen et al.,2017;Tao et al.,2018)。盛云燕等(2012)研究证实,甜瓜的性别分化与赤霉素、脱落酸、半胱氨酸、蛋氨酸、油菜素内酯及玉米素等多种激素合成、信号传导等代谢途径相关。本研究中的KEGG信号通路富集分析和COG功能注释分析结果均显示,3个对比组均以参与激素信号传导的DEG最多,说明激素信号传导广泛参与木薯性别决定的调控,在木薯花性分化过程中发挥关键作用。
生长素早期响应因子如Aux/IAA家族、ABF家族和SAUR等在生长素的信号传导中发挥重要作用。本研究获得88个与激素相关的DEGs,涉及生长素早期影响因子的基因约占44.32%,其中log2FC>3的差异表达显著基因有15个(共26个),表明生长素早期因子在木薯的性别分化过程中扮演着重要角色。杜改改等(2017)对柿雌花和雄花进行转录组测序分析,共筛选出10个与激素相关的典型基因,其中编码AUX/IAA响应蛋白的IAA3和IAA32基因在雌花中上调表达。本研究中,表达差异显著的生长素影响因子基因LAX5(gene19403和gene7567)、AUX22(gene18980)和ARF9(gene2348)在雌花和两性花中上调表达,且在雌花中的表达量高于两性花,编码SAUR的基因gene1397、gene19365、gene19962、gene 21742、gene23646、gene 3612、gene13617、gene5215、gene9869和编码CH3的基因F24B18.13(gene5960)在雄花中均上调表达,推测木薯中的LAX5、AUX22和ARF9具有促雌或抑雄的调控功能,编码SAUR和CH3的基因功能则恰好相反。CYCD3在从细胞增殖转向分化的最后阶段中发挥关键作用(Dewitte et al.,2007),其基因表达上调与花序分生组织的增多密切相关(Pan et al.,2014 )。本研究中与CYCD3相关的基因F28A23.80(gene12887)、CYCD3-2(gene 22828)、F28A23.80(gene29777和gene31176)在雌花和两性花中显著上调表达,但在雌花中的表达量高于两性花,推测木薯中编码CYCD3的基因与雌花和两性花的性别决定密切相关。
B类ARRs是细胞分裂素响应的正调节因子(Mason et al.,2005),A类ARRs作为细胞分裂素的负调控因子可抑制B类ARRs的活性(To and Kieber.,2008);在脱落酸信号通路中,SnRK2信号在蕨类植物的性别决定中发挥重要作用,调节生殖周期中雄性与雌雄同体间的性别比例(McAdam et al.,2016)。肖枫(2019)对膏桐雌花与雄花的转录组差异分析结果显示,A-ARR(gene13354)在雌花中显著上调表达,SnRK2(gene20150)、ABF(gene13255和gene14512)和B-ARR(gene20147)在雄花中显著上调表达。本研究中,编码ABF的基因At2g36270(gene 13760)和编码B-ARR的基因ARR18(gene24542)在木薯雌花中上调表达,编码SnRK2的基因OOSJNBa0017N12.8(gene21379)在雄花中上调表达,说明木薯和膏桐中编码这些蛋白的基因均参与性别决定调控,但作用机制可能存在差异。此外,本研究中编码GID1的基因T20O10.110(gene9091)、编码EBF1/2的基因F13B15.15(gene10983和gene24462)、編码ERF1/2的基因K14B15.15(gene6396)和编码JAR1的基因OSJNBa0009C07.16(gene8657)在木薯雄花中均显著上调表达,说明这些基因与木薯雄花的性别决定密切相关。
转录因子又称反式作用因子,其作为一类重要的调控基因,主要通过结合基因启动子区域中的顺式作用元件而发挥调控作用,是近年来基因挖掘与功能分析领域的研究热点(贾翠玲和侯和胜,2010)。至今,越来越多的研究证实转录因子在植物花发育,尤其在花药和花粉的发育中发挥重要的调控作用。如AP2/ERF与花发育相关(Jofuku et al.,1994;Serra et al.,2013);AtMYB103可通过调节植物绒毡层的发育来调控花粉发育(Higginson et al.,2003);bHLH转录因子激活并调控开花基因表达(Shogo et al.,2012)。本研究结果表明,在木薯雄蕾、雌蕾和两性蕾中差异表达的转录因子基因有196个,其中ERF、bHLH、WRKY和MYB四大类转录因子基因所占比例较大,log2FC>3的转录因子基因数量也较多,推测这此转录因子参与木薯的性别决定,其相关基因对木薯的性别决定起重要调控作用。Nakata等(2013a,2013b)在拟南芥中鉴定出参与茉莉酸信号传导的3个bHLH转录因子(JAM1、JAM2和JAM3),并分别对其基因进行过表达,结果发现转基因植株均表现出雄蕊育性降低,暗示这3个bHLH转录因子在拟南芥雄蕊发育中起负调控作用。在本研究中,相对于木薯雄蕾,雌蕾和两性蕾中的大部分ERF、bHLH和MYB转录因子均表现上调,尤其是bHLH和MYB类转录因子,上调表达基因数量远多于下调表达基因数量;而WRKY转录因子恰好相反;在雄蕾—雌蕾对比组中,下调表达的转录因子基因数量远多于上调表达的转录因子基因数量。由此推测,木薯中的绝大部分ERF、bHLH和MYB转录因子具有促雌或抑雄功能,而WRKY类转录因子恰好相反,大部分具有抑雌或促雄功能。
4 结论
木薯不同花性型存在较多的DEGs,其中与生长素及ERF、bHLH、WRKY和MYB转录因子相关的基因均与性别决定密切相关,可能是木薯性别分化的关键调控基因。
参考文献:
杜改改,孙鹏,索玉静,韩卫娟,刁松锋,傅建敏,李芳东. 2017. 基于柿雌雄花芽转录组测序的SSR和SNP多态性分析[J]. 中国农业大学学报,22(10):45-55. [Du G G,Sun P,Suo Y J,Han W J,Diao S F,Fu J M,Li F D. 2017. SSR and SNP polymorphism analysis based on persimmon (Diospyros kaki) transcriptome[J]. Journal of China Agricultural University,22(10):45-55.]
贾翠玲,侯和胜. 2010. 植物WRKY转录因子的结构特点及其在植物防卫反应中的作用[J]. 天津农业科学,16(2):21-26. [Jia C L,Hou H S. 2010. Structure of plant WRKY transcription factors and their roles in plant defense responses[J]. Tianjin Agricultural Scriences,16(2):21-26.]
贾慧敏. 2016. 杨梅全基因组测序和雌雄性别控制遗传分析[D]. 杭州:浙江大学. [Jia H M. 2016. The draft genome of Chinese bayberry(M. rubra) and genetic analysis of sex determination between male and female plants[D]. Hangzhou:Zhejiang University.]
焦晓博,罗尧幸,赵伟,刘榕晨,李雪雪,纪薇. 2018. 葡萄MYB基因家族及其对花器官性别分化调控的分析[J]. 山西农业大学学报(自然科学版),38(5):23-32. [Jiao X B,Luo Y X,Zhao W,Liu R C,Li X X,Ji W. 2018. Analysis of grape MYB gene family and its regulation on sex differentiation of flower organs[J]. Journal of Shanxi Agri-cultural University(Natural Science Edition),38(5):23-32.]
刘孟,乜兰春,王珊珊,胡淑明. 2016. 芦笋三种花蕾性别分化相关差异蛋白表达分析[J]. 中国农业科学,49(21):192-4202. [Liu M,Nie L C,Wang S S,Hu S M. 2016. Expression analysis of aifferential proteins in three kinds of flower buds with sex differentiation of asparagus[J]. Scien-tia Agricultura Sinica,49(21):4192-4202.]
毛颖基. 2017. 油桐花发育及其性别决定机制研究[D]. 合肥:中国科学技术大学. [Mao Y J. 2017. The floral development and sex determination mechanism of vernicia fordii[D]. Hefei:University of Science and Technology of China.]
彭向永. 2017. 雌、雄蒿柳花芽分化机制及性别决定基因挖掘[D]. 北京:中国林业科学研究院. [Peng X Y. 2017. Mechanism of floral bud differentiation and discovery of sex determination genes in male and female Salix viminalis[D]. Beijing:Chinese Academy of Forestry.]
秦力. 2016. 芦笋雌雄花发育转录组分析及性别决定相关miRNA靶基因的鉴定[D]. 杭州:浙江大学. [Qin L. 2016. Comparative transcriptome analysis of male and female flowers and identification of gender-related miRNA targets in Asparagus officinalis L[D]. Hangzhou:Zhejiang University.]
盛云燕,劉识,李文滨,栾非时. 2012. 与甜瓜性别分化相关植物激素生物合成途径分析[J]. 农业生物技术学报,20(7):791-798. [Sheng Y Y,Liu S,Li W B,Luan F S. 2012. Hormone pathway analysis related to sex determination in melon(Cucumismelo L.)[J]. Journal of Agricultural Biotechnology,20(7):791-798.]
韦丽君,俞奔驰,吕平,檀小辉,雷开文,马崇熙,卢赛清,唐玉娟. 2020. 木薯叶芽和花芽的转录组差异分析[J]. 分子植物育种,18(7):2108-2117. [Wei L J,Yu B C,Lü P,Tan X H,Lei K W,Ma C X,Lu S Q,Tang Y J. 2020. Transcriptome difference analysis of cassava(Mahihot esculehta) leaf bud and flower bud[J]. Molecular Plant Breeding,18(7):2108-2117.
肖枫. 2019. 皱叶膏桐成花相关基因的克隆及分析[D]. 贵阳:贵州大学. [Xiao F. 2019. Cloning and analysis of genes related to flowering of Jatropha nigroviensrugosus[D]. Guiyang:GuiZhou University.]
薛丽君. 2015. 苎麻性别分化相关基因的克隆、表达及遗传转化研究[D]. 长沙:湖南农业大学. [Xue L J. 2015. Clo-ning,expression and genetic transformation of genes rela-ted to sex differention in ramie[D]. Changsha:Hunan Agricultural University.]
闫春冬. 2018. 南瓜性别分化转录组及差异表达基因分析[D]. 哈尔滨:东北农业大学. [Yan C D. 2018. Sex di-fferentiation transcriptome and differentially expressed genes analysis in pumpkin[D]. Harbin:Northeast Agricultural University.]
闫明科,徐强,刘春燕,张琼,姚小洪. 2015. 基于microRNA深度测序的猕猴桃性别分化初探[J]. 园艺学报,42(7):1260-1272. [Yan M K,Xu Q,Liu C Y,Zhang Q,Yao X H. 2015. Preliminary investigation on sex differentiation of Actinidia chinensis by high-throughput microRNAs sequencing[J]. Acta Horticulturae Sinica,42(7):1260-1272.]
俞奔驰,韦丽君,李军,田益农,卢赛清. 2017. 木薯两性花及其种子的形态特征[J]. 植物学报,52(2):175-178. [Yu B C,Wei L J,Li J,Tian Y N,Lu S Q. 2017. Morphological characteristics of bisexual flowers and seeds in cassava[J]. Bulletin of Botany,52(2):175-178.]
俞奔馳,罗燕春,李军,黄强,盘欢,郑华,文峰,付海天,陈显双,马崇熙,田益农. 2014. 一种木薯开花调控技术.中国[P]. CN103733859A. [Yu B C,Luo Y C,Li J,Huang Q,Pan H,Zheng H,Wen F,Fu H T,Chen X S,Ma C X,Tian Y N. 2014. Flowering induction technology of cassava. China[P]. CN103733859A.]
周大颜,张志新,黄彩林,招志杰,莫飞龙. 2019. 3种白鲫杂交子代的转录组学分析[J]. 南方农业学报,50(6):1328-1338. [Zhou D Y,Zhang Z X,Huang C L,Zhao Z J,Mo F L. 2019. Transcriptomic analysis of three Carassius auratus cuvieri hybrids[J]. Journal of Southern Agriculture,50(6):1328-1338.]
张加强,史小华,刘慧春,马广莹,邹清成,朱开元,周江华,毛军铭. 2018. 基于转录组学的不同色系蝴蝶兰花色苷差异积累分析[J]. 分子植物育种,16(14):4530-4542. [Zhang J Q,Shi X H,Liu H C,Ma G Y,Zou Q C,Zhu K Y,Zhou J H,Mao J M. 2018. Study on the differential accumulation of anthocyanin in different-colored phalaenopsis based on transcriptomics[J]. Molecular Plant Bree-ding,16(14):4530-4542.]
Chen L N,Zhang J,Li H X,Niu J,Xue H,Liu B B,Wang Q,Luo X,Zhang F H,Zhao D G,Cao S Y. 2017. Transcriptomic analysis reveals candidate genes for female sterility in pomegranate flowers[J]. Front Plant science,8:1430. doi:10.3389/fpls.2017.01430. eCollection 2017.
Dewitte W,Scofield S,Alcasabas A A,Maughan S C,Menges M,Braun N,Collins C,Nieuwland J,Prinsen E,Sundaresan V,Murray J A H. 2007. Arabidopsis CYCD3 D-type cyclins link cell proliferation and endocycles and are rate-limiting for cytokinin responses[J]. Proceedings of the National Academy of Sciences of the United States of America,104(36):14537-14542.
Heikrjam M,Sharma K,Prasad M,Agrawal-Euphytica V. 2015. Review on different mechanisms of sex determination and sex-linked molecular markers in dioecious crops;a current update[J]. Euphytica,201(2):161-194.
Higginson T,Li S F,Parish R W. 2003. AtMYB103 regulates tapetum and trichome development in arabidapsis thaliana[J]. Plant Journal for Cell & Molecular Biology,35(2):177-192.
Jofuku K D,Den Boer B G,van Montagu M,Okamuro J K. 1994. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J]. The Plant Cell,6(9):1211-1225.
Leng N,Dawson J A,Thomson J A,Ruotti V,Rissman A I,Smits B M G,Haag J D,Gould M N,Stewart R M,Kendziorski C. 2013. EBSeq:An empirical bayes hierarchical model for inference in RNA-seq experiments[J]. Bioinformatics,29(8):1035-1043.
Mason M G,Mathews D E,Argyros D A,Maxwell B B,Kieber J J,Alonso J M,Schaller G E. 2005. Multiple type-B response regulators mediate cytokinin signal transduction in Arabidopsis[J]. The Plant Cell,17(11):3007-3018.
McAdam S A,Brodribb T J,Banks J A,Hedrich R,Atallah N M,Cai C,Geiger D. 2016. Abscisic acid-controlled sex before transpiration in vascular plants[J]. Proceedings of the National Academy of Sciences of the United States of America,113(45):12862-12867.
Nakata M,Mitsuda N,Herde M,Koo A J K,Moreno J E,Suzuki K,Howe G A,Ohme-Takagi M. 2013a. A bHLH-type transcription factor,ABA-INDUCIBLE BHLH-TYPE TRANSCRIPTION FACTOR/JA-ASSOCIATED MYC2-LIKE1,acts as a repressor to negatively regulate jasmonate signaling in Arabidopsis[J]. The Plant Cell,25(5):1641-1656.
Nakata M,Ohme-Takagi M. 2013b. Two bHLH-type transcription factors,JA-ASSOCIATED MYC2-LIKE2 and JAM3,are transcriptional repressors and affect male fertility[J]. Plant Signaling & Behavior,8(12):e26473.
Pan B Z,Chen M S,Jun N,Xu Z. 2014. Transcriptome of the inflorescence meristems of the biofuel plant Jatropha curcas treated with cytokinin[J]. BMC Genomics,15:974. doi:10.1186/1471-2164-15-974.
Serra T S,Figueiredo D D,Cordeiro A M,Almeida D M,Louren?o T,Abreu I A,Sebastián A,Fernandes L,Contreras-Moreira B,Oliveira M M,Saibo N J. 2013. OsRMC,a negative regulator of salt stress response in rice,is regulated by two AP2/ERF transcription factors[J]. Plant Molecular Biology,82(4-5):439-455.
Shogo I,Song Y H,Josephson-Day A R,Miller R J,Breton G,Olmstead R G,Imaizumi T. 2012. Flowering bHLH transcriptional activators control expression of the photoperiodic flowering regulator constans in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,109(9):3582-3587.
To J P,Kieber J J. 2008. Cytokinin signaling:Two-components and more[J]. Trends in Plant Science,13(2):85-92.
Tao Q Y,Niu H H,Wang Z Y,Zhang W H,Wang H,Wang S H,Zhang X,Li Z. 2018. Ethylene responsive factor ERF110 mediates ethylene-regulated transcription of a sex determination-related orthologous gene in two Cucumis species[J]. Journal of Experimental Botany,69(12):2953-2965.
(責任编辑 陈 燕)
收稿日期:2020-02-25
基金项目:广西自然科学基金项目(2017GXNSFBA198172);广西科技计划项目(桂科AB1850037);国家现代农业产业技术体系建设专项(CARS-11)
作者简介:*为通讯作者,俞奔驰(1973-),高级农艺师,主要从事木薯育种研究工作,E-mail:yubenchi@126.com。韦丽君(1979-),博士,高级农艺师,主要从事木薯分子生物学及育种研究工作,E-mail:215377275@qq.com
优 秀 青 年 学 者 论 坛
韦丽君(1979-),博士,高级农艺师,主要从事木薯分子生物学及育种研究工作。主持有广西重点研发计划项目“基于开花调控的木薯两性花育种新技术的应用与示范”、广西自然科学基金项目“基于EST数据的木薯成花预测与分析”和广西亚热带作物研究所专项“凉蔗基因组SNP标记的开发与应用研究”等科研项目;作为主要成员参与省部级项目“木薯特异种质资源的引进与利用研究”“木薯花药离体培养技术研究”及“秋水仙素诱导木薯多倍体的研究”等20余项。获授权国家发明专利4项、实用新型专利3项,参与选育(认定)作物新品种4个;在《植物学报》《植物生理学报》《南方农业学报》《西北植物学报》等期刊上合著发表学术论文48篇,其中第一作者或通讯作者18篇。
