BtCry1Ac 原毒素对杨扇舟蛾幼虫的毒力测定及 幼虫对Bt 毒素的细胞响应
2020-10-30高宝嘉
刘 洁,高宝嘉
(河北农业大学 林学院,河北 保定 071000)
杨扇舟蛾(Clostera anachoreta) 属 鳞 翅 目(Lepidoptera),是林木十二大害虫之一,最新调查结果表明,杨扇舟蛾的幼虫为害可使杨树生长降低30%以上,严重危害林业和园林业的发展,近些年随着全球气候变暖,杨扇舟蛾的年世代有增加的趋势,由于其繁殖速度较快、产卵数量较多,在河北、山东、安徽,山西等地给整个杨树产业造成巨大的危害[1-3]。
BtCry1Ac 毒蛋白为苏云金芽孢杆菌产生的伴孢晶体,主要作用昆虫的中肠,科学家以烟草天蛾(Manduca sexta)作为模式昆虫探索并提出了Bt在中肠的成孔模型[4-6]。对于一些抗性昆虫,研究发现Cry1Ac 通过中肠进入其他组织,但未到达幼虫的皮肤,且Cry1Ac 在脂肪体中降解最快,其次是血淋巴、周营养膜及其内容物,在中肠中代谢缓慢[7]。昆虫取食Bt 毒素后,中肠组织会发生一系列的病理变化,具体包括柱状细胞微绒毛的肿胀、断裂,细胞核拉长、核仁凝聚,线粒体变形,内质网囊泡化并断裂等[8-10],最终导致肠道破裂,随着取食时间的延长,病变由轻度向重度发展,表现为中肠肠壁肿厚,柱状细胞变形被拉长,杯状细胞数量减少等[11],且发现Cry1Ac 对中场组织的破坏速度要快于Cry2Ab和Vip3Aa 等其他Bt 毒素蛋白[12-14]。最新研究还发现,受到Cry 胁迫后秀丽隐杆线虫(Caenorhabditis elegans)转录因子HLH-30 能介导细胞自噬,以细胞的自主方式使秀丽隐杆线虫的中肠上皮细胞进行防御反应[15],使其对Bt 产生一定的耐受性。
本实验室前期研究已发现BtCry1Ac 毒蛋白对杨扇舟蛾幼虫具有毒杀活性,亚致死浓度Bt 的致死率随杨扇舟蛾幼虫世代的增加而显著降低[16],表明杨扇舟蛾对Bt 产生了一定的耐受性。因此,本研究选取亚致死浓度BtCry1Ac 原毒素,通过透射电镜观察杨扇舟蛾幼虫取食毒素后的细胞结构的变化和响应,以期为进一步了解Cry1Ac 毒素的作用机制及更好地利用Bt 制剂防治杨扇舟蛾提供理论依据。
1 材料及方法
1.1 材料
供试BtCry1Ac 原毒素由北京美延农业科技有限公司提供,原浓度为3.43 mg/mL,溶解于0.05 mol/L Na2CO3溶液中。供试昆虫杨扇舟蛾的卵及初孵幼虫于2016 年5 月在唐山国营林场非转基因2 年生杨树林采集,并于河北农业大学林学院森保实验室室内饲养2 代后用于该试验,用741 杨树叶片饲喂。供试杨树叶片:一年生非转基因741 杨,种植于河北农业大学林学院标本园。所用试剂均为国内分析纯。
1.2 方法
1.2.1 BtCry1Ac 原毒素对杨扇舟蛾幼虫的毒力测定用0.05 μmol/L 的碳酸钠溶液稀释BtCry1Ac 原毒素,浓度依次为17.15、8.5、1.715、0.857 5、0.171 5、 0.085 75 mg/L,以0.05 mol/L Na2CO3作为对照,共7 个处理。采用浸叶法将杨树叶片浸于不同浓度的BtCry1Ac 溶液10 s 后,取出晾干,按需分别置于玻璃瓶中,每处理20 头3 龄初孵幼虫,3 组重复,250 目纱网封口,温度设定为(26±1)℃,湿度控制在60%~75%,自然光周期。每天换新处理杨树叶,各处理胁迫6 d 后统计幼虫死亡情况,计算校正死亡率,校正死亡率=(处理组死亡率-对照组死亡率)/(100-对照组死亡率)×100%,并计算Bt 原毒素的LC50。以针头触碰虫体,无任何反应者视为死亡,反之则为存活幼虫
1.2.2 杨扇舟蛾中肠组织样品处理与电镜观察 将杨扇舟蛾4 龄幼虫饲喂含亚致死浓度BtCry1Ac(LC50)的杨树叶片,在取食2 h(1B2H)、8 h(1B8H)、72 h(1B72H)时分别对试虫进行解剖分离中肠组织,以未取食Bt 的4 龄幼虫作为对照(1K0H),截取1 ~1.5 mm 中肠快速浸入2.5%戊二醛(GA)+ 0.1 mol/L PB 缓冲液(pH7.4),4 ℃过夜,预固定。
用0.1 mol/L PB 缓冲液洗涤2 次,每次10 min, 然 后ddH2O 洗 涤2 次,每 次10 min;将2% 锇 酸+3%铁氰化钾等体积混合,加入中肠组织,4 ℃,2 h;ddH2O 洗涤3 次,每次10 min。固定好的样品进行乙醇梯度脱水3 次,每次10 min。渗透:100%丙酮 处理10 min×2;丙酮/环氧树脂=3/1,处理1 ~3 h ; 丙酮/ 环氧树脂=1/1,处理3 ~5 h;丙酮/ 环氧树脂=1/3,处理12 h 或过夜;100%环氧树脂,每 12 h 更换新鲜树脂,至少换2 次;100%环氧树脂(+1.5% 加速剂)12 h 或过夜。最后用100%环氧树脂(+1.5% 加速剂)包埋样品,用Leica UC7 超薄切片机切片,2% 醋酸双氧铀UA+0.5% 柠檬酸铅后染色,用120 kV 透射电子显微镜(FEI Tecnai Spirit)进行成像观察。
1.3 数据分析
所有数据利用Excel 2007、DPS 及CraphPad Prism 8.0.1 软件进行统计分析和绘图,采用Ducan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 BtCry1Ac 原毒素对杨扇舟蛾幼虫的毒力测定
试验选取生长发育一致的杨扇舟蛾3 龄幼虫进行毒力测试,6 d 后统计幼虫的死亡率结果如表1。经CraphPad Prism 8.0.1 计算,线性回归方程为: Y = 0.051X + 0.126 4,R2= 0.945 6;LC50= 0.733 μg/mL。 在试验中以0.75 μg/mL 作为Bt 毒素对杨扇舟蛾幼虫的LC50。

表1 不同浓度BtCry1Ac 胁迫6 d 后的杨扇舟蛾 幼虫死亡率Table 1 The mortality of Clostera anachoreta larvae with different concentrations of BtCry1Ac in 6 days
2.2 取食BtCry1Ac 原毒素后杨扇舟蛾幼虫中肠细胞的变化
2.2.1 杨扇舟蛾幼虫中肠细胞的结构的变化 杨扇舟蛾幼虫取食亚致死浓度Bt 毒素后,其中肠组织发生一系列病理变化。如图1 所示,取食正常叶片的对照组(1K0H)中,柱状细胞顶端的微绒毛数量较多且排列整齐紧密,粗细和长短均一;内质网排列整齐呈长线状;线粒体内背脊清晰且形状为规则的椭圆或圆形;细胞核的核膜清晰完整,其中染色质分布均匀。幼虫取食Bt 毒素2 h 后,其中肠微绒毛出现断裂脱落情况 ;内质网肿胀断裂,且排列不规则 ;线粒体内虽然背脊清晰,但已发生严重变形;细胞核核膜清晰但形状不规则,染色质发生固缩。取食Bt 毒素8 h 和72 h 的幼虫中肠结构发生严重病变,微绒毛数量减少失去原有形态,且发生肿胀断裂并脱离细胞膜,在膜上散落分布;内质网已经严重变形断裂且发生分离;线粒体内背脊变得模糊,且严重变形甚至空泡化;细胞核在受到Bt 胁迫8 h后,核膜较清晰,但核内染色质发生固缩,但在72 h 时细胞核形状拉长,且无明显的核膜并且染色质发生固缩。

图1 杨扇舟蛾幼虫对BtCry1Ac 初始响应的中肠细胞结构Fig. 1 The midgut cells of C. anachoreta larva in the initial response to BtCry1Ac
2.2.2 杨扇舟蛾幼虫中肠组织整体结构的变化 由图2 可知,杨扇舟蛾幼虫中肠组织未受到Bt 胁迫时,各类中肠细胞排列整齐,柱状细胞微绒毛粗细均匀,长度统一;杯状细胞为规则的椭圆形或者长椭圆形,腔内细胞质突起排列有序。幼虫取食Bt 毒素2 h 后,视野中细胞数量增多中肠组织增厚变形,柱状细胞微绒毛出现断裂;视野中杯状细胞数量减少,腔内出现游离的微绒毛,胞腔变小。当幼虫取食Bt 毒素8 h 时,细胞数量依然较对照组多且厚,细胞上皮发生褶皱,柱状细胞微绒毛在此图中不清晰,见图1,微绒毛肿胀断裂,并脱离膜;杯状细胞数量与对照一致,但细胞腔变小,内部微绒毛脱落。当幼虫取食Bt 毒素72 h 时,中肠组织在视野中几乎看不到完整的一段细胞,且细胞间发生褶皱,柱状细胞和杯状细胞腔内的微绒毛都发生了脱落,杯状细胞的细胞腔变形,细胞质浑浊。
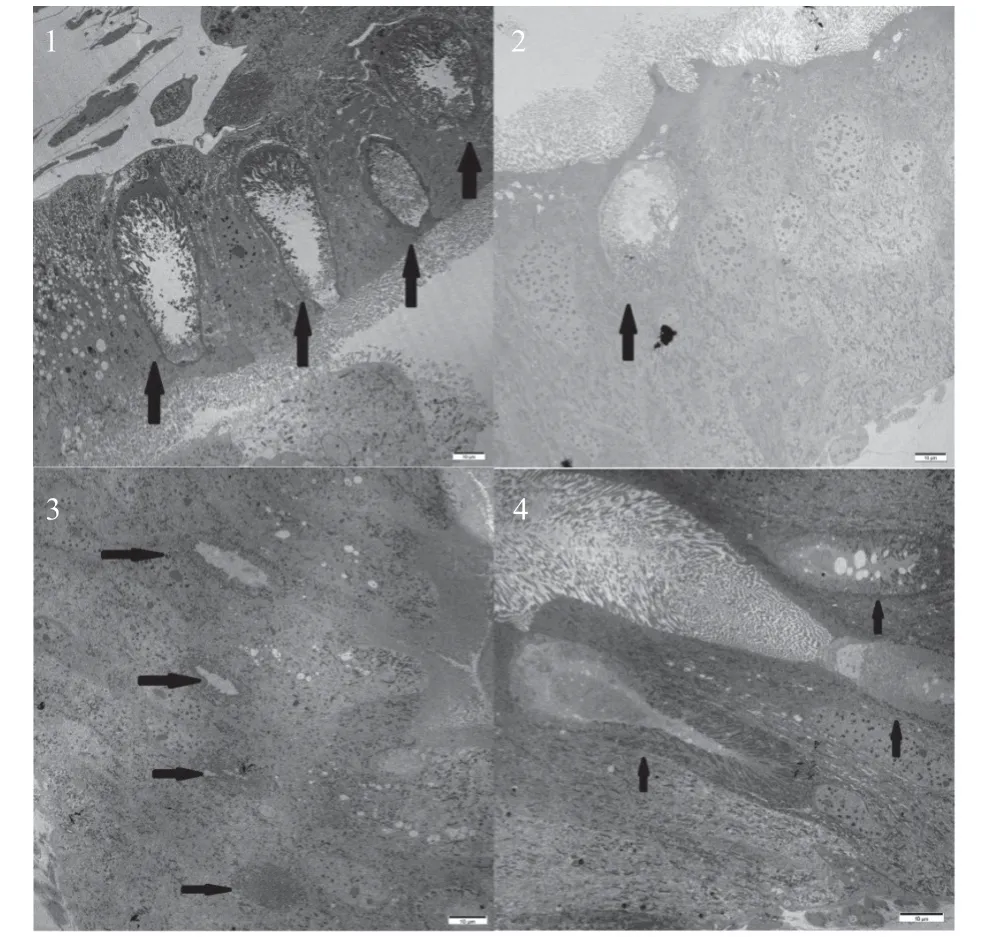
图2 杨扇舟蛾幼虫对BtCry1Ac 初始响应的 中肠组织整体结构Fig.2 The overall structure of midgut tissue of C. anachoreta larva in the initial response to BtCry1Ac
2.3 杨扇舟蛾幼虫对BtCry1Ac 原毒素的细胞响应
观察取食Bt 毒素的杨扇舟蛾幼虫中肠细胞发现,其细胞内频繁出现类似自噬体和吞噬体等的结构。幼虫取食Bt 毒素2 h 后,通过电镜检测,观察到了自噬或吞噬作用出现,图3 中,(a)到(f)为自噬体或吞噬了细胞器的吞噬体,双层膜结构内含细胞器,(g)(h)则为单层膜的自噬溶酶体。
取食Bt 毒素8 h 后,幼虫中肠同样出现了与2 h 相同的细胞结构,图4 中,(a)(b)(c)为单层膜的自噬溶酶体,(d)到(g)为自噬体或吞噬体,里面清晰可见被包裹的细胞器和细胞质,(g)则是正在与溶酶体结合的自噬小体。
当杨扇舟蛾幼虫取食Bt 毒素72 h 后,仍可在其中肠细胞内观察到自噬体和吞噬体等结构。说明在Bt胁迫初期,杨扇舟蛾中肠细胞内被激活了自噬作用,以维持体内的正常的生命活动。图5 中,(a)到(d) 均为具有双层膜结构的自噬小体或吞噬体,内含多种细胞器。(e)(f)(g)则认为是正在与溶酶体进行结合的自噬体结构。(h)为单层膜的自噬溶酶体,其内部胞浆成分已降解。

图3 杨扇舟蛾幼虫1B2H 的中肠细胞结构Fig.3 The cell structure of the midgut of C. anachoreta larva(1B2H)

图4 杨扇舟蛾幼虫1B8H 的中肠细胞结构Fig.4 The cell structure of the midgut of C. anachoreta larva(1B8H)

图5 杨扇舟蛾幼虫1B72H 的中肠细胞结构Fig.5 The cell structure of the midgut of C. anachoreta larva(1B72H)
3 结论与讨论
本试验结果表明,BtCry1Ac 原毒素对杨扇舟蛾3 龄幼虫的LC50为0.733 μg/mL,且亚致死浓度的Bt 毒素胁迫初期(2 h)便引起4 龄幼虫中肠组织的病理变化,如,线粒体出现变形,内质网肿胀,染色质固缩等现象,随着胁迫时间的延长,Bt对中肠组织的破坏程度加重。对二点委夜蛾幼虫的研究发现,取食Cry1Ac 毒素蛋白12 h 后幼虫中肠细胞出现病变,对细胞线粒体、内质网、细胞核的破坏程度较大[11],这也表明杨扇舟蛾对BtCry1Ac毒素较敏感。在对玉米根虫(Diabrotica virgifera virgifera)的研究中也发现,Bt 毒素(Cry34/35Ab1、Cry3Aa1、Cry6Aa1)均能使其产生明显的中毒症状,即中肠细胞的肿胀和脱落、中肠圆形肌肉收缩、干细胞激活和中肠腔阻塞等现象[17];Cry2Ab 还会使棉铃虫(Helicoverpa armigera)中肠细胞内不同大小的溶酶体的空泡化,转基因Bt 番茄使中肠细胞的柱状细胞和杯状细胞的细胞核均发生严重的空泡化和变性,核膜破裂成电子密集的环状球体[18-19]。
本研究还发现亚致死浓度的Bt 原毒素可以激活杨扇舟蛾幼虫中肠细胞内的自噬反应,这与Cry 胁迫后秀丽隐杆线虫中肠内发生的自噬反应研究结果类似,但由于杨扇舟蛾为非参考基因组物种,关于介导细胞自噬的转录因子还需进一步研究。
