琯溪蜜柚炭疽病拮抗放线菌的筛选和鉴定
2020-10-29赖宝春吴振强戴瑞卿林明辉李丰林德锋王家瑞
赖宝春 吴振强 戴瑞卿 林明辉 李丰 林德锋 王家瑞

摘 要:为筛选出对琯溪蜜柚炭疽病有防治效果的生防菌,以琯溪蜜柚炭疽病菌(Colletotrichum gloeosporioides)为靶标菌,采用平板对峙法进行初筛,用生长速率法和人工接种法对抑菌效果较好的菌株FX28进行抑菌谱及防治效果测定;通过形态学、生理生化特征,结合16S rDNA序列分析等方法研究其分类地位。结果表明:从25份土样中共分离到放线菌105株,对琯溪蜜柚炭疽病菌有较好拮抗作用的放线菌有16株,其中菌株FX28抑菌活性最高,其抑菌带宽度为15.3 mm,抑制率达86.4%,抑菌谱广,对琯溪蜜柚炭疽病菌、琯溪蜜柚黑点病菌、琯溪蜜柚黑斑病菌等14种供试植物病原菌均有抑制作用;其作用机制表现为菌丝分枝增多、变粗、顶端膨大等,对琯溪蜜柚炭疽病的预防效果和治疗效果分别为83.8%和71.1%。根据形态、生理生化特性及16S rDNA序列分析,初步确定菌株FX28为深红紫链霉菌(Streptomyces violaceorubidus)。
关键词:琯溪蜜柚炭疽病;深红紫链霉菌;分类鉴定;生防作用
中图分类号:S436.66 文献标识码:A
Abstract: This study was conducted to screen resources for the biological control of Colletotrichum gloeosporioides which cause anthracnose disease for Guanxi honey pomelo cultivar. An antagonistic actinomycete of C. gloeosporioides was isolated from the soil samples by the plate-confrontation method and growth speed rate method, and the inoculated fruit was treated with the fermented broth. The taxonomic identification of the strain FX28 was carried out using morphological, physiological and biochemistry characteristics and 16S rDNA sequence. From the 25 soil samples, 16 of 105 antagonistic actinomycete isolates showed againstantifungal activity against C. gloeosporioides. FX28 showed an inhibition zone with a diameter 15.3 mm and strongest inhibition rate 86.4%. FX28 had broad-spectrum inhibition activity to all the 14 plant pathogenic fungi such as C. gloeosporioides, Diaporthe citri, Phyllosticta citriasian. FX28 could break down hyphae, turn hyphal thickened, fractured and enlarged. The protection and curation effects of the fermented broth against C. gloeosporioides were up to 83.8% and 71.1%, respectively. Based on the morphological, physiological-biochemical characteristics and molecular analysis, FX28 was identified as Streptomyces violaceorubidus.
Keywords: honey pomelo anthracnose disease; Streptomyces violaceorubidus; taxonomic identification; biocontrol effect
DOI: 10.3969/j.issn.1000-2561.2020.09.022
琯溪蜜柚炭疽病的病原為胶孢炭疽菌(Coll-etotrichum gloeosporioides),该菌在琯溪蜜柚整个生育期及果实采后均可为害[1]。目前,生产上防治该病主要依靠化学农药,从蜜柚抽发春梢开始至冬季清园结束,果农每隔20 d左右施用一次化学农药,大量使用化学农药不仅对生态环境和人畜健康造成危害,也导致果实农药残留和病原菌的抗药性逐年增加。因此,研究安全环保的病害防控方法对琯溪蜜柚的可持续生产具有重要意义。放线菌能产生抗生素及次生代谢产物,极具植物病害防控潜力,在植物病害防治中已得到有效的应用[2]。国内外已有柑橘炭疽病生防方面的相关报道,Lee等[3]研究发现,从八角茴香和荆芥中提取的精油能够抑制炭疽病菌的生长;汪茜等[4]研究了枯草芽孢杆菌1505菌株对柑橘采后炭疽病的防治效果,采用刺伤接种的防效为48.8%,自然发病的防效为46.3%;刘冰等[5-6]筛选到一株放线菌ML27菌株对柑橘炭疽病菌的抑制率为72.15%;汪文强等[7]利用烟管菌发酵液对柑橘炭疽病菌的抑菌率达71.1%;袁红旭等[8]从柑橘果实中分离到14株内生细菌可降低柑橘果实炭疽病的发病率;纪兆林等[9]分离到的地衣芽孢杆菌和多粘类芽孢杆菌对柑桔炭疽病菌菌丝有明显的抑制作用,可延缓柑桔采后炭疽病的发生;黄艳等[10]利用壳寡糖诱导柑橘果实中活性氧的变化来降低炭疽病的发病率。但是在柑橘属农产品上,尚未发现能抑制炭疽病菌达12 h以上的生物杀菌剂[11]。目前有关琯溪蜜柚炭疽病生物防治的研究报道较少。因此,本研究以琯溪蜜柚炭疽病菌作为靶标菌,从福建省漳州市不同地区的土壤中分离筛选生防效果较好的拮抗放线菌菌株,旨在为该病的生物防治提供更多的微生物资源。
1 材料与方法
1.1 材料
供试病原菌:琯溪蜜柚炭疽病菌(Coll-etotrichum gloeosporioides)、琯溪蜜柚黑点病菌(Diaporthe citri)、琯溪蜜柚黑斑病菌(Phyllo-sticta citriasiana)、香蕉枯萎病菌4号小种(Fusa?rium oxysporum f. sp. cubense, race 4)、辣椒枯萎病菌(F. oxysporum Schl. f. sp. vasinfectum)、水稻恶苗病菌(F. moniliforme)、玉米穗腐病菌(F. porliferatum)、辣椒疫霉病菌(Phytophthora capsici)、黄瓜枯萎病菌(F. oxysporum f. sp. cu-curmerinum)、番茄枯萎病菌(F. oxysporum f. sp. lycopersici),由本研究室分离、鉴定、致病性测定及保存;番茄叶霉病菌(Fulvia fulva)、多肉黑斑病菌(Alternaria alternata)、榕树炭疽病菌(C. gloeosporioides)、兰花茎腐病菌(F. oxysporum),由福建省农业科学院植物保护研究所馈赠。供试土样采自福建省漳州市龙文区、芗城区、南靖县、平和县、云霄县、诏安县等地,共25份。
供试药剂:70%丙森锌可湿性粉剂,由拜耳作物科学(中国)有限公司生产,为果农防治琯溪蜜柚炭疽病常用药剂。
1.2 方法
1.2.1 放线菌的分离、纯化 采用稀释涂布分离法[12]分离放线菌。将土样置于通风干燥处自然风干,称取5 g土壤倒入放有灭菌玻璃珠的50 mL无菌水中,置于振荡培养箱(BS-1振荡培养箱,金坛市鸿科仪器厂)振荡30 min后,吸取1 mL混悬液,用无菌水梯度稀释,分别吸取104、105、106稀释液0.1 mL均匀涂布在高氏一号琼脂平板上,后置于28 ℃生化培养箱(上海培因实验仪器有限公司)中培养,挑取培养性状不同的单菌落转入高氏一号培养基上纯化培养,纯化3次后,置于4 ℃冰箱中保存,备用。
1.2.2 拮抗放线菌的筛选 发酵液制备[2]:将100 mL高氏一号液体培养基加入250 mL三角瓶中,121 ℃高压灭菌30 min,待冷却后接入4 mm的菌饼(从1.2.1中纯化保存的放线菌)5块,于28 ℃、150 r/min振荡培养7 d,在无菌条件下将发酵液吸到灭菌离心管中,8 000 r/min离心30 min,吸取上清液,置于20 ℃冰箱中备用。
拮抗菌的筛选:采用平板对峙法[13]对1.2.1中所分离到的放线菌进行抑菌活性筛选,靶标菌为琯溪蜜柚炭疽病菌。
抑菌谱测定:采用菌丝生长速率法[12]测定1.2.1节筛选获得的强活性菌株对供试病原真菌的抑菌能力。
孢子萌发抑制试验:将稀释10倍的菌株FX28(1.2.1筛选获得的强活性菌株)发酵滤液和病菌孢子悬浮液滴入凹玻片中,置于28 ℃恒温培养箱保湿培养,设空白发酵液与无菌水的混合液作为对照。分别于12 h和24 h观察病菌孢子的萌发情况[14]。
1.2.3 防治效果测定 取新鲜琯溪蜜柚幼果,用75%酒精表面消毒,无菌水冲洗3次,采用刺伤接种的方法,取菌株FX28发酵上清液5 mL均匀涂抹于幼果傷口及其周围果面,涂抹后放入塑料盒置于28 ℃恒温箱中。24 h后在伤口处接种20 ?L炭疽病菌孢子液(105个孢子/mL),接种后放入塑料盒(相对湿度约90%)置于28 ℃恒温箱,测定菌株FX28的预防效果;将炭疽病菌孢子液20 ?L接种于幼果伤口及其周围,24 h后在伤口处及其周围涂抹5 mL发酵上清液,测定菌株FX28的治疗效果。设70%丙森锌300倍液为药剂对照,设无菌水为空白对照,每处理15个果实,重复3次。接种后每天观察1次,计算病情指数和防治效果。果实发病程度分级标准参照汪茜等[5]的方法。
1.2.4 FX28菌株的鉴定 形态特征观察:采用插片法,待菌丝长上盖玻片后,取菌丝生长适中的盖玻片置于光学显微镜下,观察FX28菌株气生菌丝、基内菌丝、孢子丝和孢子的形态特征[15]。
培养特征和生理生化特征分析:参照关统伟等《放线菌系统分类技术》[16]和中国科学院微生物研究所放线菌分类组编著的《链霉菌鉴定手册》[15]。观察菌株培养特征的8种培养基见表4。
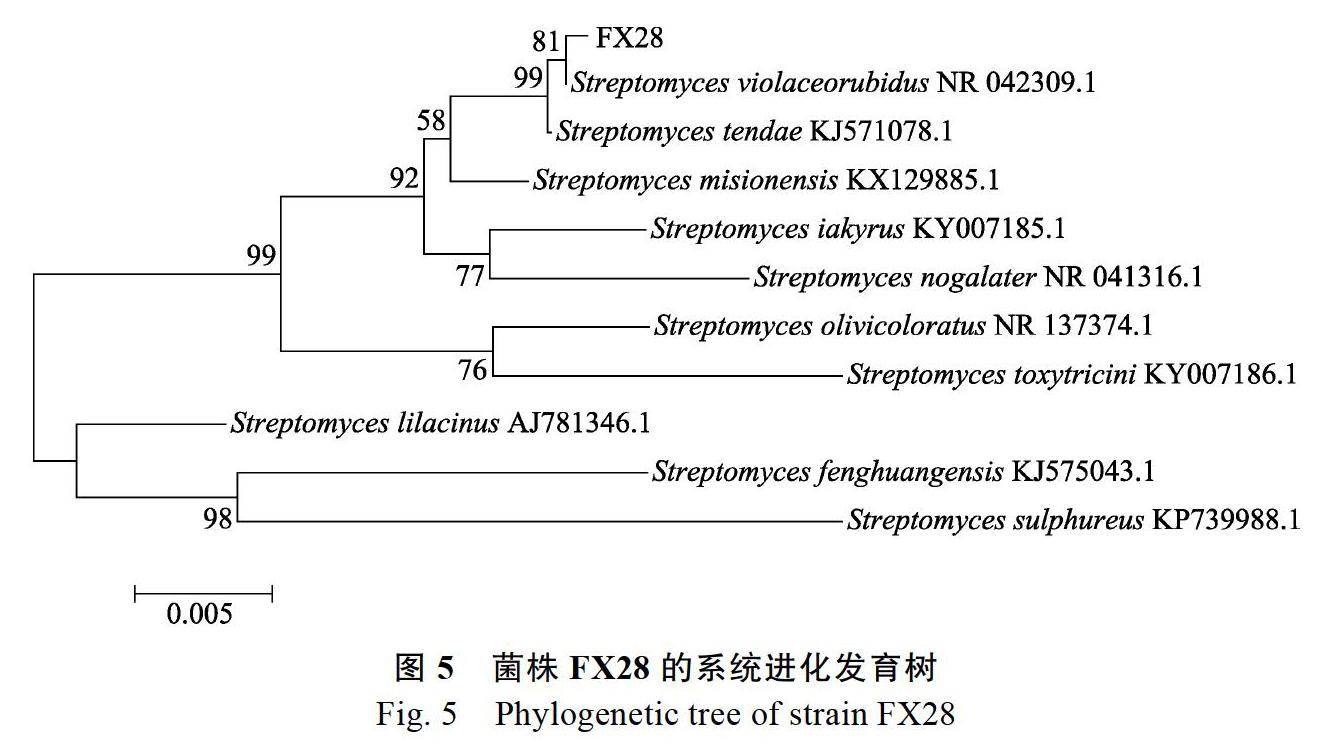
分子生物学鉴定[13, 17]:采用细菌基因组提取试剂盒提取菌体总DNA,以Ezup柱式抽提试剂盒[生工生物工程(上海)股份有限公司]和细菌通用引物27F: 5-AGAGTTTGATCMTGGCT CAG-3和1492R: 5-TACGGYTACCTTGTTACG ACTT-3,由生工生物工程(上海)股份有限公司合成。25 μL PCR反应体系:Taq PCR Master Mix 12.5 μL,模板DNA 2 μL(100 ng/μL),10 μmol/L引物各1 μL,加ddH2O至总体积达25 μL,阴性对照用ddH2O代替模板DNA。PCR反应条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃修复延伸10 min,于4 ℃下保存。在含有GelRed染料的1%琼脂糖凝胶中回收扩增产物条带,经连接、转化和鉴定后,阳性克隆由生工生物工程(上海)股份有限公司测序。将测定的基因序列登录NCBI(www.ncbi.nlm.nih.gov)进行BLAST比对,并从GenBank数据库获得相关分离物的16S rDNA序列,然后用邻位加入法(Neighbor-joining)构建系统发育进化树。
1.3 数据处理
采用Excel软件整理实验数据,采用DPS软件进行方差分析。
2 结果与分析
2.1 拮抗放线菌初筛
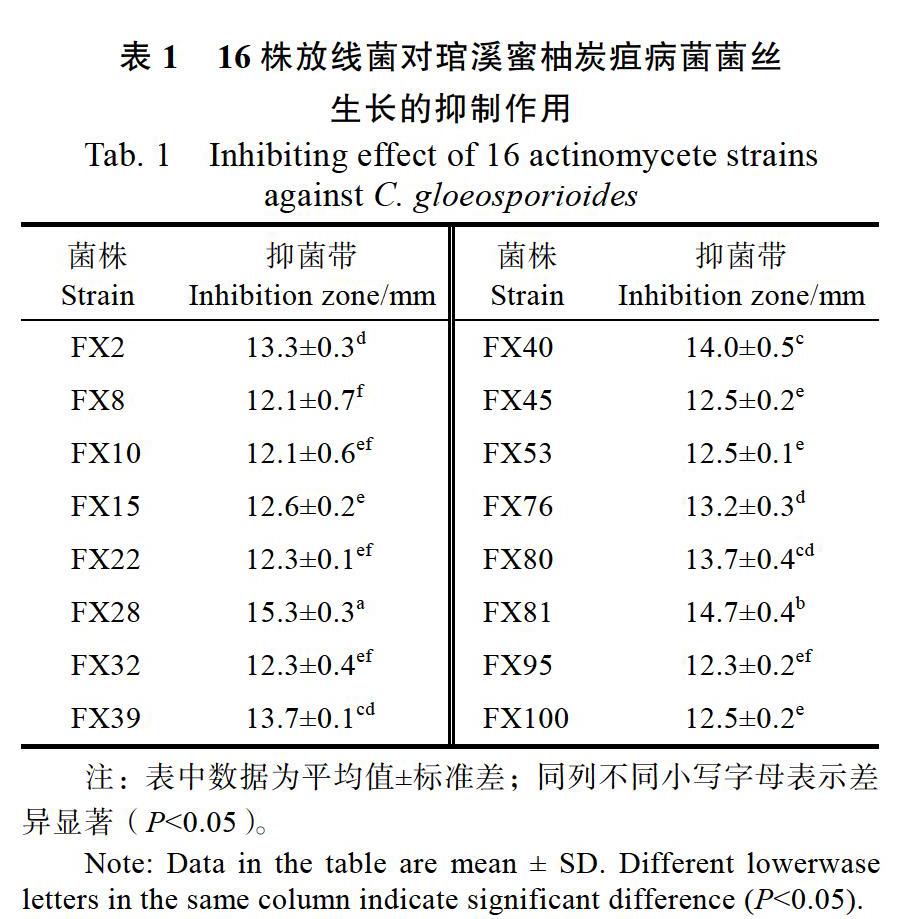
从25份土壤样品中共分离、纯化到105株培养性状不同的放线菌。拮抗活性试验结果表明,有16株放线菌对琯溪蜜柚炭疽病菌的抑菌带宽度大于12.0 mm,其中,7株放线菌的抑菌带宽度大于13.0 mm,以菌株FX28的抑菌效果最好,抑菌带宽度达15.3 mm(表1,图1),因此将其作为后续试验菌株。
2.2 活性菌株FX28的抑菌谱
抑菌谱测定结果表明,菌株FX28对14种供试病原真菌均有不同程度的抑制作用,其中对琯溪蜜柚炭疽病菌、辣椒枯萎病菌和番茄叶霉病菌作用最强,抑制率达85.8%以上;对榕树炭疽病菌、黄瓜枯萎病菌、番茄枯萎病菌的抑制率分别为74.9%、75.0%、75.0%;对水稻恶苗病菌、玉米穗腐病菌、辣椒疫霉病菌的抑制作用相对较弱,抑制率在23.7%~30.8%之间;且菌株FX28对不同病原菌的抑制作用存在显著差异(表2)。
2.3 菌株FX28对琯溪蜜柚炭疽病菌的抑菌效果
2.3.1 菌株FX28对琯溪蜜柚炭疽病菌菌丝的作用机制 在光学显微镜下检查被抑制菌丝的变化情况,结果显示受抑制的琯溪蜜柚炭疽病菌菌丝变粗、分枝增多、顶端膨大、扭曲、易断裂,且菌丝内原生质凝聚,细胞内含物紊乱(图2B)。对照的菌丝细长,光滑而均匀(图2A)。
2.3.2 菌株FX28对琯溪蜜柚炭疽病菌孢子萌发的抑制作用 孢子萌发抑制结果表明,培养12 h后,对照的炭疽病菌孢子萌发率为91.7%,菌株FX28发酵液处理的孢子萌发率为0,抑制率为100%;24 h后,对照炭疽病菌孢子全部萌发,菌株FX28发酵液处理的孢子少量萌发,萌发率为3.0%,抑制率为97.0%(图3)。
2.4 菌株FX28对琯溪蜜柚炭疽病的防治效果
预防作用测定结果表明,对照大部分果实腐烂,烂果率为91.1%,病情指数为50.1;菌株FX28发酵液处理的果实烂果率为20.0%,病情指数为8.2,其预防效果为83.8%;70%丙森锌处理的预防效果为85.7%,略高于菌株FX28发酵液处理。治疗作用测定结果表明,菌株FX28发酵液处理的果实烂果率为28.9%,病情指数为14.1,其治疗效果为71.1%,略低于70%丙森锌处理,处理间无显著差异(表3)。但随着时间延长,对照果实的腐烂面积逐渐扩大,而感病果实经菌株FX28发酵液和70%丙森锌处理后,果实腐烂面积没有继续扩大。
2.5 菌株FX28的分类鉴定
2.5.1 菌株FX28的形态及培养特征 FX28菌株在高氏一号培养基上生长旺盛,菌落多褶皱,不易挑起,直径为1.5~1.8 cm。镜检发现气生菌丝和孢子丝均高度分枝;孢子链较长,孢子丝松敞或紧密螺旋形,时常不规则,丛生或轮生(图4A),孢子丝成熟后形成串珠状的孢子链,孢子丝断裂后形成椭球形孢子,表面稍有褶皱,孢子大小0.60~0.75 ?m×0.80~1.05 ?m(图4-B)。菌株FX28在8种培养基上均生长良好,28 ℃培养36~48 h后开始出现菌落,72~96 h后开始产生孢子,孢子堆颜色浅灰色至深灰色。其培养特征见表4。
2.5.2 生理生化特性 研究结果表明,菌株FX28可以利用甘油、蔗糖、麦芽糖、肌醇、葡萄糖、D-阿拉伯糖、鼠李糖、D-甘露醇、α-半乳糖、D-木糖作为碳源生长,不能利用棉子糖、D-果糖。可利用L-赖氨酸、甘氨酸、L-组氨酸、精氨酸、天冬酰胺、L-酪氨酸、L-色氨酸作为氮源生长,不能利用L-谷氨酸。能使淀粉水解、明胶液化、牛奶凝固而不胨化,不能使硝酸盐还原、纤维素和色氨酸分解,也不能产生H2S和黑色素。
2.5.3 16S rDNA序列分析 FX28菌株PCR扩增得到1条约1295 bp的条带。FX28菌株的16S rDNA序列在GenBank数据库中进行同源性比对,发现FX28菌株与深红紫链霉菌(Streptomyces violaceorubidus)的同源性最高,相似度在99%以上。选择与菌株FX28同源性较高的10株菌构建系统发育树(图5),结果表明,菌株FX28的16S rDNA序列与深红紫链霉菌(S. violaceorubidus)NR 042309.1聚在一个分支,亲缘关系最近,结合菌株FX28的形态特征、培养特征、生理生化特性及16S rDNA序列分析结果,初步确定菌株FX28为深红紫链霉菌(S. violaceorubidus)。
3 讨论
琯溪蜜柚炭疽病不仅在田间引起果实腐烂,而且在贮藏过程中,对琯溪蜜柚的危害也很严重。目前,琯溪蜜柚炭疽病的防治主要采用化学杀菌剂,而化学杀菌剂对人畜的毒副作用和残留问题至今难以有效解决。生物防治对环境友好,且病害不易产生抗药性,是植物病害防治的发展趋势。目前,生产上用于防治病害的农用抗生素中大部分是由链霉菌属(Streptomyces)产生[18]。研究结果表明,菌株FX28对琯溪蜜柚炭疽病菌菌丝具有较强的抑制作用,该菌株属链霉菌属,通过培养特征、形态特征、生理生化特性、16S rDNA序列分析等,初步确定该菌株为深红紫链霉菌(S. violaceorubidus)。该菌株对供试的大部分病原真菌均有较强的抑制活性,能否作为农用抗生素的新来源,還需进一步研究。另外,从应用生防菌的角度而言,需优化该菌株的培养条件,特别是产生抗菌代谢物的培养条件。
目前,国内外已有深红紫链霉菌的相关报道,周璇[19]研究发现深红紫链霉菌具有较强的有机物分解功能,可影响红壤微生物的数量,提高红壤呼吸速率的峰值。甘龙站等[20]分离到一株具有极强的抗癌、抗糖尿病活性及中等抗菌活性的深红紫链霉菌。Asmaa等[21]从污水处理系统中分离到3株深红紫链霉菌,可抑制污水中的病原体。Adeline等[22]从油棕的空果壳堆肥中分离到一株能加快堆肥速度且抑制灵芝属(Ganoderma)致病菌的深红紫链霉菌。Wadetwar等[23-24]从印度那格浦尔(Nagpur)地区土壤中分离到一株深红紫链霉菌,对其发酵工艺优化后可大规模生产胞外抗生素。而深红紫链霉菌应用于防治果树病害尤其是琯溪蜜柚炭疽病的研究未见相关报道。本研究分离得到的深红紫链霉菌菌株生长繁殖速度快,抑菌谱广,对琯溪蜜柚炭疽病菌菌丝的抑制率达86.4%,24 h后对孢子的萌发抑制率为97.0%。吴思梦等[14]用黄色链霉菌发酵液对柚子炭疽病孢子萌发抑制率为61.54%。研究发现深红紫链霉菌的抑菌作用机制表现为菌丝分枝增多、变粗、顶端膨大、扭曲、易断裂,且菌丝内原生质凝聚,细胞内含物紊乱,与前人研究结果一致[13]。深红紫链霉菌发酵上清液对琯溪蜜柚炭疽病的预防效果和治疗效果分别为83.8%和71.1%,而汪茜等[4]用生防细菌防治柑橘采后炭疽病的防效为48.8%。后续将对深红紫链霉菌在田间的定殖能力、适应性、稳定性以及防治效果等相关方面进行研究。目前国内外未见深红紫链霉菌用于琯溪蜜柚炭疽病防治方面的相关报道。因此,以深红紫链霉菌为菌源开发用于防治琯溪蜜柚炭疽病的新型生防制剂及生物有机肥具有良好的发展前景。
參考文献
[1] 赖宝春, 吴顺章, 郑春明, 等. 琯溪蜜柚炭疽病病原鉴定[J]. 果树学报, 2017, 34(9): 1178-1184.
[2] 张 宁, 韩立荣, 孙平平, 等. 拮抗茄子黄萎病菌土壤放线菌的分离筛选和鉴定[J]. 植物保护学报, 2012, 39(2): 109-114.
[3] Lee S O, Park I K, Choi G J, et al. Fumigant activity of essential oils and components of Illieium verum and Schizonepeta tenuifolia against Botrytis cinerea and Colletotrichum gloeosporioides[J]. Journal of Microbiology and Biotechnology, 2007, 17(9): 1568-1572.
[4] 汪 茜, 胡春锦, 黄思良, 等. 生防细菌1505的鉴定及其对采后柑橘炭疽病的抑制效果[J]. 西南农业学报, 2011, 24(2): 579-585.
[5] 刘 冰, 黎 园, 丁 莎, 等. 柑橘病害生防放线菌的分离筛选及抑菌作用研究[J]. 江西农业大学学报, 2011, 33(5): 889-892.
[6] 刘 冰, 宋水林, 刘晓丽, 等. 生防放线菌ML27的鉴定及其抗真菌活性代谢产物的性质研究[J]. 江西农业大学学报, 2014, 36(3): 656-660.
[7] 汪文强, 李 勇, 张旭辉, 等. 烟管菌M-1对柑橘炭疽病菌的抑制作用及发酵条件优化[J]. 中国生物防治学报, 2018, 34(3): 423-430
[8] 袁红旭, 陈勇明, 何财能, 等. 拮抗炭疽病的柑橘内生细菌的分离与筛选[J]. 果树学报, 2005, 22(5): 510-513.
[9] 纪兆林, 童蕴慧, 凌 筝, 等. 拮抗细菌对部分水果产后病原真菌的抑制及防腐作用[J]. 南京农专学报, 2003, 19(4): 23-27.
[10] 黄 艳, 明 建, 邓雨艳, 等. 壳寡糖诱导柑橘果实抗病作用中的活性氧变化[J]. 食品科学, 2009, 30(22): 344-349.
[11] 张晓媛, 赖闻玲, 许 杨. 防治脐橙炭疽病生防菌的筛选[J]. 江苏农业科学, 2016, 44(1): 152-154.
[12] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 243-250.
[13] 宋利沙, 蒋 妮, 缪剑华, 等. 肿节风炭疽病拮抗细菌的筛选与鉴定[J]. 植物保护, 2018, 44(6): 61-65,72.
[14] 吴思梦, 王文君, 刘 冰, 等. 1株柑橘炭疽病生防放线菌对几种植物病原真菌的抑制作用[J]. 生物灾害科学, 2016, 39(2): 84-89.
[15] 中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975.
[16] 关统伟, 张小平, Rashey S G, 等. 放线菌系统分类技术[M]. 北京: 化学工业出版社, 2016: 70-81.
[17] 王涵琦, 畅 涛, 杨成德, 等. 马铃薯炭疽病(Colletotrichum coccodes)拮抗菌株的筛选及鉴定[J]. 植物保护, 2014, 40(1): 38-42.
[18] 林雁冰, 陆家贤, 颜 霞, 等. 地黄根圈土壤拮抗放线菌筛选、鉴定及发酵条件优化[J]. 植物保护学报, 2010, 37(3): 234-240.
[19] 周 璇. 外源腐解微生物对土壤微生物活性及群落结构的影响[D]. 北京: 中国农业科学院, 2018.
[20] 甘龙站, 王 幸, 刘 杨, 等. 一株藜内生放线菌活性分析及抗生素生物合成潜力的筛查[J]. 微生物前沿, 2016, 5(2): 9-18.
[21] Asmaa B, Yedir O, Lahcen H, et al. Isolation and characterization of wastewater sand filter actinomycetes[J]. World Journal of Microbiology and Biotechnology, 2010, 26(3): 481-487.
[22] Adeline S Y T, Alex H, Ka L P. Indigenous actinomycetes from empty fruit bunch compost of oil palm: Evaluation on enzymatic and antagonistic properties[J]. Biocatalysis and Agricultural Biotechnology, 2014, 3(4): 310-315.
[23] Wadetwar R N, Patil A T. Isolation and characterization of bilactive actinomycetes from soil in and around Nagpur[J]. International Journal of Pharmaceutical Sciences and Research, 2013, 4(4): 1428-1433.
[24] Wadetwar R N, Patil A T. Production of antibiotic from actinomycetes isolated from Nagpur region and optimization of parameters to increase the yield[J]. International Journal of Pharmaceutical Sciences and Research, 2013, 4(8): 3094-3098.
