巴西橡胶树HbGRF基因的克隆、物理定位及表达分析
2020-10-29张宇航潘冉冉李飞陶志强王英高和琼庄南生
张宇航 潘冉冉 李飞 陶志强 王英 高和琼 庄南生


摘 要:生長调控因子(growth-regulating factors,GRF)是植物特有的一类转录因子,该转录因子家族成员数目较多,在植物生长发育过程中发挥着重要作用。以巴西橡胶树优良品种‘热研7-33-97为材料,通过RT-PCR方法进行HbGRF基因的克隆;利用生物信息学的方法对其蛋白序列、理化性质、基因结构、进化关系进行分析;利用IS-PCR技术和FISH技术对其进行物理定位分析;采用qRT-PCR对橡胶树中HbGRF基因的表达模式进行研究。结果表明:在橡胶树雌花中克隆到3个GRF基因,分别命名为HbGRF1、HbGRF2和HbGRF3,分子量分别为65.663、41.188、52.858 kDa,其编码的蛋白长度分别为609、384、494 aa,均为不稳定蛋白;3个基因均具有GRF完整的特征结构域WRC和QLQ,分别属于3个不同亚族。基因物理定位结果表明,HbGRF1、HbGRF2和HbGRF3基因分别位于橡胶树染色体的第11号长臂、第5号短臂和第9号长臂上,基因到着丝粒的平均百分距离是77.65、42.66和65.27。表达结果显示,橡胶树3个HbGRF基因在茎尖、雌花等生长旺盛的组织中表达量较高,用外源赤霉素和脱落酸处理后,发现表达量呈上升趋势,经过48 h后表达量和初始值基本持平,3个基因在茎尖、雌花中有明显的表达特异性,可能在橡胶树花芽分化及雌花的发育过程中起到了重要作用。该结果为研究橡胶树HbGRF基因的功能及作用机制奠定了理论基础,为橡胶树精准育种提供了分子细胞学依据。
关键词:巴西橡胶树;GRF基因家族;基因定位;表达分析
中图分类号:S794.1 文献标识码:A
Abstract: Growth-regulating factor (GRF) is a plant-specific transcription factor. The transcription factor family has a large number of members and plays an important role in plant growth and development. In this study, the excellent clone ‘Reyan 7-33-97 was used as the experimental material, and the HbGRF genes were cloned by RT-PCR. The bioinformatics method was used to study its gene length, physicochemical properties, basic structure and evolutionary relationship. The physical localization analysis was carried out by in situ PCR and fluorescence in situ hybridization. The expression pattern of HbGRF genes in rubber trees was analyzed by qRT-PCR. Three GRF genes were cloned into the female flowers of rubber trees, named HbGRF1, HbGRF2 and HbGRF3, respectively. The protein length was 609 aa, 384 aa and 494 aa with molecular weight of 65.663 kDa, 41.188 kDa and 52.858 kDa, respectively, and they were all unstable protein. All the three members had the complete characteristic domains WRC and QLQ of GRF gene family. Evolutionary analysis showed that the three genes belonged to three different groups. HbGRF1, HbGRF2 and HbGRF3 were located on the long arm of chromosome 11, the short arm of chromosome 5 and the long arm of chromosome 9, and the average percentage distance between the signal site and the centromere was 77.65, 42.66 and 65.27, respectively. The expression results showed that the three HbGRF genes in rubber trees were highly expressed in the vigorous growth tissues like stem tips and female flowers. Under the treatment of exogenous GA and ABA, the expression levels of the three genes increased first, and the expression levels at 48 h were basically the same as those under the initial conditions. The three genes had obvious expression specificity in stem tips and female flowers, which may play important roles in flower bud differentiation and female flower development. This study would provide a theoretical basis and materials for further exploration of the function of HbGRF, and provide molecular cytology basis for accurate breeding of rubber trees.
Keywords: Hevea brasiliensis; GRF gene family; gene mapping; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.09.001
巴西橡胶树(Hevea brasiliensis)属于大戟科橡胶树属[1],其产生的胶乳在工业、国防等领域有着十分重要的作用。橡胶树喜高温、高湿的生长环境,易受极端天气的影响,微弱的生长环境变化就会导致胶乳品质和产量的下降[2]。生长调控因子(growth-regulating factors, GRF)是一类成员数目较多的、植物特有的转录因子家族,参与了植物生长发育等过程的调控[3-5]。本研究通过克隆橡胶树HbGRF基因,并进行了基因定位及表达分析,为研究橡胶树HbGRF基因的功能及作用机制奠定了理论基础,也为橡胶树精准育种提供了理论指导。植物里最先被发现的GRF基因是水稻的OsGRF1,它编码的蛋白通过调控赤霉素影响茎的伸长[6]。目前,已报道的GRF家族基因在拟南芥和水稻中分别有9個和12个成员[7-8],杨树中有19个成员[9],番茄中有13个成员[10],陆地棉中有33个成员[11],油菜中有34个成员[12],烟草中有25个成员[13],桃树中有10个成员[14],茶树中有11个成员[15],藜麦中有18个成员[16]。该基因家族编码的蛋白序列的N末端一般含有QLQ(Gln、Leu、Gln)和WRC(Trp、Arg、Cys)2个保守结构域,QLQ结构域与GRF互作因子(GRF-interacting factor, GIF)相互作用形成转录激活因子[17],WRC中包含一个与DNA相结合的锌指结构和核定位信号区域(NLS),它们在基因行使其生物学功能方面起到了重要作用[7]。在植物中,GRF基因家族的成员在发育活跃的部位如花芽、根尖及幼叶中表达量较高,在成熟的部位表达量相对较低[18-19],多种GRF基因在叶和茎的生长、花的发育、胚珠形成等方面发挥了重要的作用,GRF基因还可通过负反馈调节机制在植物渗透胁迫下发挥作用[7]。目前,在杨树、桃树、苹果等许多植物中已对GRF基因家族进行了鉴定及功能分析,上述研究完善了我们对GRF基因家族的认识,但该家族在橡胶树中的研究及功能分析尚未见报道。本研究经克隆得到HbGRF基因,运用生物信息学和基因表达等方法分析HbGRF及其蛋白的基本信息,初步了解HbGRF在橡胶树生长发育过程中的生物学功能及作用机制;利用原位PCR和荧光原位杂交技术探究HbGRF与其他功能基因之间的位置关系,这可为橡胶树精准育种设计提供理论指导。
1 材料与方法
1.1 材料
本研究以正常生长开割10 a的巴西橡胶树优良品种‘热研7-33-97为材料,采集根、茎、茎尖、叶片、树皮、果实、雌花以及不同发育时期的花序。实验材料由中国热带农业科学院国家橡胶树种质资源圃提供。
外源赤霉素(GA)和脱落酸(ABA)处理所用材料为1 a的‘热研7-33-97组培苗,每个处理组设置5棵幼苗。GA处理:对植株喷施浓度为200 ?mol/L的GA,使用过程中以无水乙醇溶解GA后喷施处理植株,并以喷施等浓度乙醇处理的植株为对照,分别采集处理0、0.5、2、6、12、24、48 h植株与对照植株的叶片,ABA处理与GA处理方法相同。以上所有材料取样后用液氮速冻,保存至-80 ℃冰箱中备用。
1.2 方法
1.2.1 橡胶树HbGRF基因的克隆 根据GRF家族基因的保守序列,在橡胶树基因组数据库(http://hevea.catas.cn)中做同源序列搜索,通过CDS编码区预测和序列拼接得到橡胶树HbGRF1、HbGRF2、HbGRF3基因的cDNA序列。运用Primer Primer 5.0软件进行引物设计(表1)。用反转录得到的橡胶树雌花cDNA为模板,对橡胶树HbGRF基因家族的HbGRF1、HbGRF2和HbGRF3 3个成员的编码区进行扩增,PCR反应体系为20 ?L,其中包括Prime STAR Max Premix(2×)10 ?L,cDNA模板1 ?L,上、下游引物各0.4 ?L,灭菌的ddH2O 8.2 ?L。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共扩增35个循环;最后于72 ℃延伸10 min。使用OMEGA公司的凝胶回收试剂盒对产物进行回收纯化后与pMD19-T载体进行连接,转化至大肠杆菌DH5α中,挑选阳性克隆重组子交华大基因公司测序。
1.2.2 橡胶树HbGRF基因的生物信息学分析 HbGRF基因的编码区序列及氨基酸序列的比对和预测分析是通过NCBI中的BLAST软件和ORF Finder软件完成,其所编码蛋白的理化特性通过ExPASy ProtParam在线分析[20]。HbGRF蛋白的亚细胞定位、信号肽、编码蛋白的跨膜区段及功能结构域预测,分别采用PSORT、SignalP、TMpred及SMART软件进行分析。使用PredictProtein软件对HbGRF基因家族编码蛋白的二级结构进行预测分析。使用DNAMAN 6.0软件对近源物种的HbGRF蛋白的氨基酸序列进行多重比对分析。使用MEGA 7.0软件对HbGRF蛋白进行系统进化树分析。
1.2.3 橡胶树HbGRF基因在染色体上的物理定位
(1)染色体标本的制备:参照高和琼等[21]、李懋学等[22]和张志丹等[23]的实验方法,选取古铜期幼叶进行染色体标本的制备,于-20 ℃冰箱中保存备用。
(2)特异性引物的合成与筛选:依据克隆得到的测序结果,对序列片段进行分析,参照代素珍等[24]的方法对HbGRF基因进行合成与筛选,将PCR的退火温度调整为45~65 ℃,通过凝胶电泳对PCR产物进行检测,选取条带单一、明亮的产物交华大基因公司测序,将测序结果与基因序列比对,共筛选出3对符合条件的特异性引物(表1)。
(3)原位PCR:参照官锦燕等[25]的原位PCR方法进行改进,对HbGRF1和HbGRF2基因进行检测。
(4)荧光原位杂交:将PCR扩增得到的HbGRF3基因的扩增产物回收纯化后,用地高辛切口平移试剂盒DIG-Nick Translation Mix将其标记成探针,信号位点呈现绿色;标记好的探针溶于100%去离子甲酰胺溶液中,且终浓度为50 ng/?L;将标记好的探针置于-20 ℃冰箱中避光保存备用。荧光原位杂交的方法参照本课题组邱海燕[26]报道的方法进行检测。
(5)镜检与分析:将40 ?L含有DAPI染料的抗褪色剂滴加至染色体标本上进行封片,在黑暗环境中放置60 min后,使用Leica DM5000显微镜进行观察与拍照;用Photoshop软件对所拍照片进行处理,使用Image J软件对染色体长度及信号位点距着丝粒的距离进行测量,并利用扩增信号位点百分距离的计算方法[27],结合‘热研7-33-97的核型分析参数[28],分析和确定信号位点在染色体上的位置。
扩增信号位点的百分距离= ×100
1.2.4 橡胶树HbGRF基因的表达分析 依据橡胶树HbGRF基因的ORF区设计荧光定量引物,使用TIANGEN试剂盒提取RNA,用TaKaRa的反转录试剂盒合成cDNA第1条链,以各样品的cDNA为模板,浓度统一稀释为100 ng/?L,进行定量PCR扩增。设计荧光定量特异性引物见表1,对HbGRF基因在不同组织、不同发育时期及不同外源激素处理后的表达情况进行qRT-PCR分析,以巴西橡胶树18S rRNA为内参,采用2ΔΔCT法进行定量分析,每个试验设置3次重复,定量数据使用SAS 9.1.3软件进行统计分析[29]。
2 结果与分析
2.1 橡胶树HbGRF基因的克隆和蛋白序列分析
以巴西橡胶树‘热研7-33-97雌花cDNA为模板,使用特异性引物克隆得到3个片段大小分别为1830、1155、1485 bp的基因。测序后发现这3个基因片段和转录组测序后的序列一致,将这3个基因分别命名为HbGRF1、HbGRF2和HbGRF3,其登录号分别为:MN396751、MN396752和MN396753。
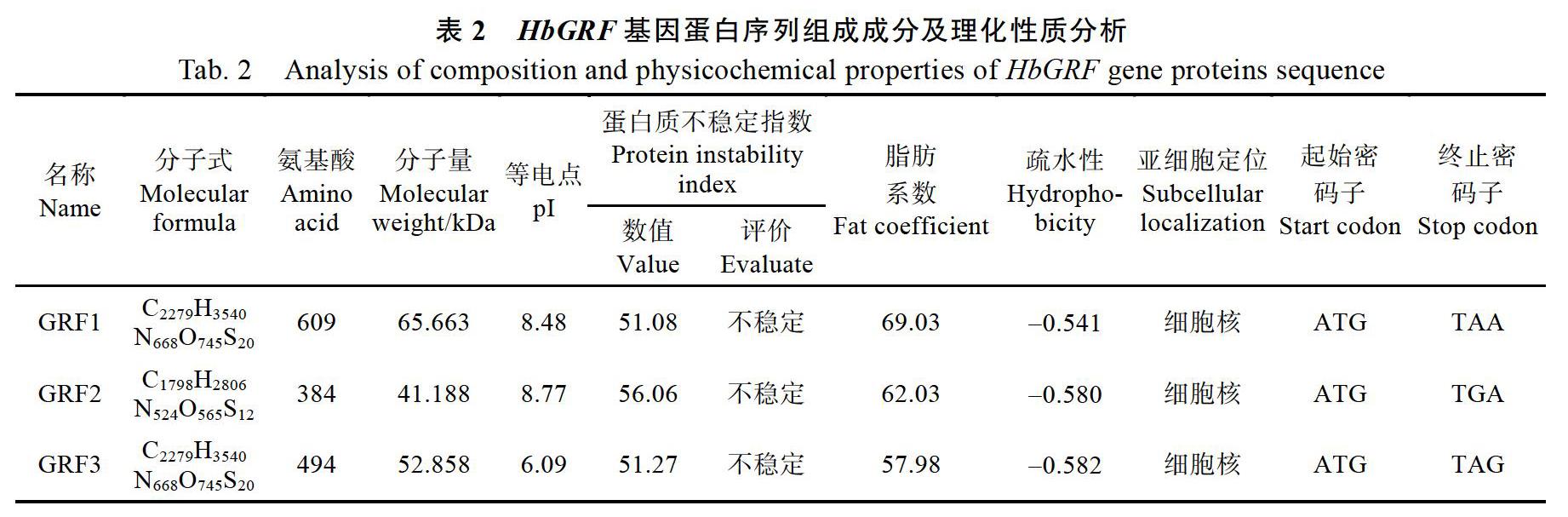
运用生物信息学方法对巴西橡胶树3个HbGRF基因进行分析,分析结果表明其编码384~609个氨基酸,分子量大小范围为41.188~ 65.663 kDa,等电点为6.09~8.77,蛋白质不稳定指数为51.08~56.06,均为不稳定蛋白,脂肪系数为57.98~69.03,疏水性平均系数范围为0.541~ 0.582(表2)。对HbGRF蛋白进行亚细胞定位分析,发现GRF蛋白均处在细胞核内,与转录因子的特征相符合。
通过Predict Protein在线软件对HbGRF1、HbGRF2、HbGRF3蛋白的二级结构进行预测,结果显示这3个蛋白都含有DNA结合区和多个蛋白结合区域(图1),说明它们可能在转录过程中发挥作用。
红色条带:螺旋结构;蓝色条带:链;黄色条带:隐藏结构;绿色条带:无规律结构;红色小方块:蛋白结合区;黄色小圆圈:DNA结合区;紫色小圆圈:RNA结合区;灰色小圆圈:核苷酸结合区。
2.2 橡胶树HbGRF蛋白的多重比对及进化分析
对HbGRF的蛋白序列和近缘物种如木薯(Manihot esculenta)、可可树(Theobroma cacao)以及麻风树(Jatropha curcas)的GRF蛋白序列进行比对。结果表明,橡胶中的3个HbGRF基因家族成员均含有QLQ和WRC保守结构域,QLQ结构域的序列是QX3LX2Q,WRC结构域的序列是CX9CX10CX2H,在橡胶HbGRF家族的3个成员中,WRC结构域比QLQ结构域更为保守(图2),表明这3个橡胶树HbGRF蛋白均含有特有的GRF结构域。
进一步选取木薯、可可树、水稻、拟南芥、麻风树等已知的GRF家族基因使用MEGA 6.1软件构建系统进化树。结果显示,在植物中GRF家族基因可以分成5个亚族(Ⅰ~Ⅴ)(图3)。其中橡胶树的HbGRF1、HbGRF2、HbGRF3基因分别属于Ⅰ亚族、Ⅱ亚族、Ⅳ亚族,且HbGRF1与HbGRF3基因亲缘关系略近。
2.3 HbGRF1、HbGRF2和HbGRF3基因的物理定位分析
分别用HbGRF1和HbGRF2基因定位的特异引物与Digoxigenin-11-dUTP等配制成扩增液,在制备好的染色体标本上进行原位PCR反应和荧光检测。在有丝分裂的间、前、中期的染色体上均能观察到2个绿色荧光信号点(图4,图5)。阴性对照组中不加入Taq酶,其细胞染色体上均未出现信号(图4D,图5D)。对信号位点所在的中期细胞进行核型分析,得到信号位点与染色体的对应关系,以及信号位点在核型模式图上的位置关系。结果表明,HbGRF1和HbGRF2基因分别位于第11号染色体长臂和第5号染色体短臂上,基因到着丝粒的平均百分距离分别是77.65和42.66。
用地高辛对HbGRF3基因的扩增纯化产物标记为探针,随后采用荧光原位杂交进行检测,在有丝分裂的间、前、中期的染色体上均能觀察到2个绿色荧光信号点(图6),阴性对照组中不加入探针,其细胞染色体上均未出现信号(图6D)。对信号位点所在的中期细胞进行核型分析,得到信号位点与染色体的对应关系,以及信号位点在核型模式图上的位置关系(图7)。结果表明,HbGRF3位于第9号染色体长臂上,基因到着丝粒的平均百分距离是65.27。
2.4 橡胶树HbGRF基因的表达分析
2.4.1 橡胶树HbGRF基因在不同组织中的表达分析 为进一步研究橡胶树HbGRF基因在生长发育过程中的作用,本研究使用qRT-PCR技术对橡胶树根、茎、茎尖等8个组织或器官中HbGRF基因的相对表达量进行分析。由图8可知,HbGRF1、HbGRF2和HbGRF3基因在植株8个不同部位中表达量有差异。其中,HbGRF1基因在茎尖、雌花中高调表达,在其他部位表达量较低。HbGRF2和HbGRF3基因在茎尖中显著高调表达,在雌花中的表达量也比别的部位高。由此推测HbGRF1、HbGRF2和HbGRF3基因可能参与橡胶树花芽分化及雌花的发育过程。
2.4.2 橡胶树HbGRF基因在不同发育时期花序中的表达分析 对橡胶树HbGRF基因在花蕾期(花序长度约为3 cm)、伸展期(花序长度约为6 cm)、盛花期(花序长度约为9 cm)和开花末期(花序长度约为12 cm)等4个花序发育阶段的表达情况进行分析,结果表明,在伸展期,HbGRF1、HbGRF2和HbGRF3基因的表达量最高,由此推测HbGRF基因在生长发育较为活跃的部位表达较强(图9)。
2.4.3 橡胶树HbGRF基因在外源激素处理下的表达分析 使用外源赤霉素对橡胶树幼叶进行处理后,HbGRF1和HbGRF2在处理后0.5 h、HbGRF3在处理后6 h时,其表达量最高;使用外源脱落酸处理时发现,3个基因均在处理后0.5 h时,表达量达到了最高值。当2种外源激素处理后48 h时,3个基因的表达量和初始条件下的表达量基本相同(图10)。
3 讨论
GRF基因家族是一类成员数目较多的转录因子家族,该转录因子对植物的生长发育过程具有重要的调控作用。目前,GRF基因家族在水稻、拟南芥、杨树、番茄、陆地棉、油菜、烟草、桃树、茶树、藜麦等多种植物中已有研究,但对于具有重要战略意义的橡胶树GRF基因的相关研究仍缺乏进一步的报道。本研究从橡胶树中克隆到3个HbGRF基因,首先对其进行生物信息学与表达模式等分析,再使用原位PCR技术和荧光原位杂交技术对基因进行了物理定位分析,试图从分子生物学及细胞学的角度对功能基因进行较为全面的研究。
伴随基因组测序技术的发展与完善,Livak等[29]对橡胶树‘热研7-33-97的全基因组进行了测序,这对橡胶树基因家族的分析与鉴定、功能基因的挖掘与研究都提供了很多便利,预测了43 792个蛋白编码基因,其中包括7个预测的橡胶树GRF基因,较为符合一般植物中GRF基因家族含有8~20个成员的规律。本研究根据拟南芥GRF的2个保守序列QLQ和WRC,在橡胶数据库搜索到7个基团,然后设计引物,以橡胶树总cDNA为模板进行扩增,结果显示,只扩增出3个基因,推测可能是其他基因的丰度比较低等原因造成。将本研究中扩增的3个HbGRF基因和预测的7个橡胶树GRF基因的序列比对,结果发现HbGRF1配对序列的一致性为99.84%,其余均完全比对,说明该比对结果与Tang等[30]的预测结果一致。
对3个HbGRF基因的氨基酸序列进行分析,结果发现3个成员均含有QLQ和WRC 2个保守结构域,且WRC结构域的特异性较高,这与藜麦、茶树等植物中的研究相一致。对橡胶树与其他植物GRF的系统进化分析表明,可将GRF分为5个亚族,其中HbGRF1与MeGRF1、HbGRF2与JcGRF3、HbGRF3与AtGRF8亲缘关系较近,基因之间的亲缘关系越接近,其功能可能也越类似。如拟南芥中的AtGRF8基因在花的发育中具有重要的调控作用,尤其是在花器官发育后期。HbGRF3基因在橡胶树雌花中的表达量相对较高,由此推测橡胶树HbGRF3基因在花的发育过程中起重要的调控作用。
前人研究结果表明,GRF基因家族的成员在发育活跃的器官或组织中表达量较高,在成熟的组织或器官中表达量相对较低。在茶树中CsGRF在生长比较旺盛的组织尤其是芽叶中起到了重要的调控作用[15]。在油菜中BnGRF可调控花器官的发育[31]。本研究对3个HbGRF基因在不同部位的表达情况分析发现,它们在茎尖及雌花中的表达量相对较高,推测这3个基因参与了调控橡胶树花芽分化以及雌花发育的过程。对HbGRF在花序不同发育时期的表达量进行分析发现,其在伸展期表达量最高,符合GRF转录因子的特点,但在开花末期,3个基因的表达量也相对较高,出现这一现象的原因及机制尚不明确,需要进行更深入的研究。在实际生产实践过程中,橡胶树座果率较低,一般为5%~8%,最高不超过10%,这是橡胶树常规育种工作效率较低的原因之一。赤霉素信号途径在调控植物株高、开花方面有着重要的作用,脱落酸信号途径在植物多种生理反应及基因的胁迫应答方面具有重要的调控作用。前人的研究发现,苹果树MdGRF基因可能在外源激素作用下调控苹果树的生长,在调控嫁接到矮化砧木上接穗的生长以及2个品种节间伸长等过程中有着重要的作用[32]。本研究用外源赤霉素和外源脱落酸对橡胶树进行处理后发现,其表达量在处理后0.5~6 h内达到最高,在外源激素处理后48 h时,3个基因的表达量回落到初始水平,表明HbGRF1、HbGRF2和HbGRF3受赤霉素和脱落酸处理的调控。
基因定位的结果表明,HbGRF1、HbGRF2和HbGRF3定位在3条不同的染色体上,它们之间可能相互独立,结合本课题组已报道的橡胶树其他功能基因的定位结果可以得知,HbGRF1与OVP-10390[33]、Hevb7[34]同時位于第11号染色体上;HbGRF2与HbMyb1[35]、HbN1N1[36]、HbNAC1[37]、HbPEPRK2[24]、HblMAC4[38]同时位于第5号染色体上;HbGRF3与HbCPT[39]、HbJAZ5[40]、HbNAC3[37]、HblMYC2、HblMYC5[38]、HbWRKY1、HbWRKY4、HbWRKY5[41]同时位于第9号染色体上。这些定位在相同染色体上的基因间可能存在互为连锁的关系。研究功能基因之间的相互关系对了解这些基因间可能存在的遗传关系提供了帮助,这些结果可以为橡胶树精准育种设计提供理论指导。
参考文献
[1] 刘少军, 周广胜, 房世波.中国橡胶树种植气候适宜性区划[J]. 中国农业科学, 2015, 48(12): 2335-2345.
[2] 刘金河. 巴西橡胶树的水分状况与生长和产胶量的关系[J]. 生态学报, 1982(3): 217-224.
[3] Chen Y Z, Cao J. Comparative analysis of Dof transcription factor family in maize[J]. Plant Molecular Biology Reporter, 2015, 33(5): 1245-1258.
[4] Hoe Kim J, Tsukaya H. Regulation of plant growth and development by the GROWTH-REGULATING FACTOR and GRF-INTERACTING FACTOR duo[J]. Journal of Experimental Botany, 2015, 66(20): 6093-6107.
[5] Schwechheimer C, Bevan M. The regulation of transcription factor activity in plants[J]. Trends in Plant Science, 1998, 3(10): 378-383.
[6] Knaap E V D, Kende K H. A novel gibberellin-induced gene from rice and its potential regulatory role in stem growth[J]. Plant Physiology, 2000, 122(3): 695-704.
[7] Kim J H, Choi D, Kende H. The AtGRF family of putative transcription factors is involved in leaf and cotyledon growth in Arabidopsis[J]. The Plant Journal, 2003, 36(1): 94-104.
[8] Dongsu C, Hoe K J, Hans K. Whole genome analysis of the OsGRF gene family encoding plant-specific putative tran-scription activators in rice (Oryza sativa L.)[J]. Plant and Cell Physiology, 2004, 45(7): 897-904.
[9] 周厚君. 楊树GRF基因家族分析及PtGRF1/2d功能研究[D]. 北京: 中国林业科学研究院, 2016: 26-35.
[10] 袁 岐, 张春利, 赵婷婷, 等. 番茄GRF转录因子家族的生物信息学分析[J]. 分子植物育种, 2017, 15(8): 2949-2956.
[11] 张书芹, 乐 愉, 武 斐. 陆地棉GRF基因家族的鉴定和生物信息学分析[J]. 分子植物育种, 2019, 17(12): 3817-3824.
[12] 阮先乐, 王俊生, 刘红占, 等. 油菜GRF基因家族的鉴定和基本特征分析[J]. 分子植物育种, 2018, 16(8): 2420-2428.
[13] Zhang J, Li Z, Jin J, et al. Genome-wide identification and analysis of the growth-regulating factor family in tobacco (Nicotiana tabacum)[J]. Gene, 2018, 639: 117-127.
[14] 曹 珂, 薛灵姿, 王 蛟, 等. 桃GRF基因家族的序列及其组织特异性表达分析[J]. 植物遗传资源学报, 2018, 19(3): 578-586.
[15] 王鹏杰, 郑玉成, 林 浥, 等. 茶树GRF基因家族的全基因组鉴定及表达分析[J]. 西北植物学报, 2019, 39(3): 413-421.
[16] 时丕彪, 何 冰, 费月跃, 等. 藜麦GRF转录因子家族的鉴定及表达分析[J]. 作物学报, 2019, 45(12): 1841-1850.
[17] Kim J H, Kende H. A transcriptional coactivator, AtGIF1, is involved in regulating leaf growth and morphology in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(36): 13374-13379.
[18] Ma J Q, Jian H J, Yang B, et al. Genome-wide analysis and expression profiling of the GRF gene family in oilseed rape (Brassica napus L.)[J]. Gene, 2017, 620: 36-45.
[19] Zheng L W, Zhao C D, Mao J P, et al. Genome-wide identification and expression analysis of brassinosteroid biosynthesis and metabolism genes regulating apple tree shoot and lateral root growth[J]. Journal of Plant Physiology, 2018, 231: 68-85.
[20] Elisabeth G, Alexandre G, Christine H, et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis[J]. Nucleic Acids Research, 2003, 31(13): 3784-3788.
[21] 高和瓊, 王 英, 金 鸽, 等. 橡胶树叶片染色体制片方法的优化[J]. 热带作物学报, 2009, 30(5): 565-569.
[22] 李懋学, 张赞平. 作物染色体及其研究技术[M]. 北京:中国农业出版社, 1996: 30-34.
[23] 张志丹, 王 英, 庄南生, 等. 巴西橡胶树染色体制片方法的改良及FISH信号检测[J]. 基因组学与应用生物学, 2019, 38(6): 2713-2717.
[24] 代素珍, 庄南生, 王 英, 等. 巴西橡胶树HbPEPRK基因家族5个成员在染色体上的定位[J]. 基因组学与应用生物学, 2019, 38(7): 3155-3160.
[25] 官锦燕, 王 英, 高和琼, 等. 巴西橡胶树4个环锌指蛋白基因(HbRZF)的物理定位[J]. 基因组学与应用生物学, 2014, 33(3): 610-616.
[26] 邱海燕. 巴西橡胶树REF、RT和SRPP基因物理定位的研究[D]. 海口: 海南大学, 2010.
[27] Song Y C, Gustafson J P J T, Genetics A. The physical location of fourteen RFLP markers in rice (Oryza sativa L.) [J]. Theoretical and Applied Genetics, 1995, 90(1): 113-119.
[28] 高和琼, 庄南生, 王 英, 等. 橡胶树两个品种的核型分析[J]. 武汉植物学研究, 2009, 27(5): 537-540.
[29] Livak K J, Schmittgen T D. Analysis of relative gene ex-pression data using real-time quantitative PCR and the 2–CT method[J]. Methods, 2000, 25(4): 402-408.
[30] Tang C R, Yang M, Fang Y J, et al. The rubber tree genome reveals new insights into rubber production and species ad-aptation[J]. Nature Plants, 2016, 2(6): 16073
[31] Ma J Q, Jian H J, Yang B, et al. Genome-wide analysis and expression profiling of the, GRF, gene family in oilseed rape (Brassica napus L.) [J]. Gene, 2017, 620: 36-45.
[32] Zheng L W, Ma J J, Song C H, et al. Genome-wide identification and expression analysis of GRF genes regulating apple tree architecture[J]. Tree Genetics & Genomes, 2018, 14(4): 54-60.
[33] 高和琼. 巴西橡胶树HbMyb1基因和OPV-10390连锁标记原位PCR定位的研究[D]. 海口: 海南大学, 2008: 26-44.
[34] 高佳佳. 巴西橡胶树几个与橡胶合成相关基因的物理定位研究[D]. 海口: 海南大学, 2014: 26-28.
[35] 高和琼, 庄南生, 王 英, 等. 巴西橡胶树HbMyb1基因的原位PCR物理定位[J]. 热带亚热带植物学报, 2012, 20(4): 365-368.
[36] 高佳佳, 王 英, 高和琼, 等. 巴西橡胶树胶乳转化酶HbNIN基因家族物理定位的研究[J]. 热带作物学报, 2014, 35(9): 1704-1709.
[37] 杨光涌, 郑 菲, 王 英, 等. 巴西橡胶树NAC基因家族5个成员的荧光原位杂交物理定位[J]. 分子植物育种, 2018, 16(2): 512-517.
[38] 高 豫, 庄南生, 王 英, 等. MYC基因家族5成员在巴西橡胶树染色体上的物理定位[J]. 热带生物学报, 2018, 9(2): 163-169.
[39] 张新新. 巴西橡胶树4个胶乳生物合成相关基因的物理定位研究[D]. 海口: 海南大学, 2013: 33-45.
[40] 李晓燕, 苏莉莉, 高佳佳, 等. JAZ基因家族6个成员在橡胶树上的物理定位[J]. 分子植物育种, 2017, 15(12): 4992-4999.
[41] 刘正林, 庄南生, 王 英, 等. 巴西橡胶树HbWRKY基因家族10个成员在染色体上的定位[J]. 植物遗传资源学报, 2018, 19(6): 1170-1179.
