芒果中性/碱性转化酶MiNI基因的克隆与表达分析
2020-10-29郭利军邓会栋冯学杰罗志文陈哲范鸿雁胡福初华敏
郭利军 邓会栋 冯学杰 罗志文 陈哲 范鸿雁 胡福初 华敏


摘 要:采用RT-PCR技术克隆了1个编码NI基因的cDNA序列,命名为MiNI基因,并对不同来源的中性/碱性转化酶的分子特征及系统进化进行比较分析。结果表明:MiNI基因开放阅读框为2034 bp,编码677个氨基酸,相对分子量为76.6 kDa,理论等电点为6.24;生物信息学分析结果显示,NI二级结构α螺旋占38.85%,无规则卷曲占35.45%,伸展链占18.91%,β折叠占6.79%;MiNI具有glycoside hydrolase family 100結构保守域,与克里曼丁桔、龙眼、巴西橡胶树和番木瓜都具有一致的motif位点;MiNI基因编码的氨基酸序列与克里曼丁桔、龙眼氨基酸序列同源性最高;构建NI系统进化树分析表明,与芒果遗传距离最近的是克里曼丁桔,最远的是玉米和枸杞。qRT-PCR分析显示,果皮MiNI基因表达量远高于果肉;花后10~40 d,果皮MiNI基因表达量显著下降;花后40~100 d,果皮MiNI基因表达量维持在一个相对稳定水平;花后100~130 d,随着果实成熟,果皮MiNI基因表达量又显著上升;而花后10~40 d,果肉MiNI基因表达量显著下降,至果实发育后期果肉MiNI基因表达量始终处于极低水平。该研究为进一步了解MiNI基因在芒果果实蔗糖代谢过程中的作用以及从分子角度阐明芒果糖代谢机理奠定理论和技术基础。
关键词:芒果;中性/碱性转化酶;克隆;生物信息学;表达分析
中图分类号:S667.7;S961.6 文献标识码:A
Abstract: The cDNA sequence of alkaline/neutral invertase (NI) gene (MiNI) in mango was cloned with Reverse Tran-scription Polymerase Chain Reaction (RT-PCR) in this study. The molecular properties and genetic relationships of NI were compared with different organisms. MiNI contained an open reading frame of 2034 bp, encoding a protein of 677 aa with a theoretical molecular weight 76.6 kDa and an isoelectric point of 6.24. Bioinformatics analysis showed that the secondary structure of NI consisted of alpha helix accounting for 38.85%, random coil accounting for 35.45%, extended strand accounting for 18.91%, and beta turn accounting for 6.79%, of which had the conserved domain of glycoside hydrolase family 100 and the same motif locations as Citrus clementine, Dimocarpus longan, Hevea brasiliensis and Carica papaya. The amino acid sequence encoded by MiNI had the highest homology with that of Citrus clementine, Dimocarpus longan. The analysis of NI phylogenetic tree showed that the closest genetic distance between mango was Citrus clementine, the furthest were Zea mays and Lycium barbarum. qRT-PCR analysis showed that the expression of MiNI in exocarp was much higher than that in mesocarp. MiNI relative expression in exocarp decreased significantly during 10 to 40 days after flowering, while the gene relative expression was maintained at a relatively stable level during 40 to 100 days after flowering. However, MiNI expression increased significantly with fruit ripening during the period from 100 to 130 days after flowering. The gene expression in mesocarp was different from that in exocarp. The gene expression of MiNI in mesocarp decreased significantly during 10 to 40 days after flowering, while the gene relative expression remained at a very low level until the later stage of fruit development. The study would provide a foundation to understand the role of MiNI in sucrose metabolism and further dissection of the sugar metabolism mechanism from molecular perspective.
Keywords: Mangifera indica L.; alkaline/neutral invertase; cloning; bioinformatics; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.09.003
芒果(Mangifera indica L.)是漆树科常绿大乔木,原产于印度半岛至东南亚一带,素有“热带果王”之美誉,全世界有84个国家生产芒果。近十几年来,海南省芒果种植面积一直稳定在4.67万hm2左右,据农业农村部2017年全国热带作物生产统计和海南省统计年鉴统计数据显示,截至2017年底,全国芒果种植面积25.79万hm2,收获面积16.31万hm2,全年总产量207.44万t,总产值114.45亿元,海南芒果种植面积5.45万hm2,收获面积4.43万hm2,产量56.73万t,产值28.93亿元,分别占全国的21.12%、27.16%、27.35%和25.28%,海南种植面积、产量和产值分别居全国第三、第二和第一位。
作为高等植物光合作用的主要产物,蔗糖在果实发育过程中发挥着无可替代的重要作用。转化酶(invertase, INV)是促使蔗糖进入各种代谢途径的关键酶,其催化蔗糖不可逆水解为葡萄糖和果糖[1]。根据最适pH,INV可分为酸性转化酶(acid invertase, AI)和中性/碱性转化酶(alkaline/neutral invertase, NI);根据亚细胞定位,可分为细胞壁转化酶(cell wall invertase, CWIN)、细胞质转化酶(cytoplasmic invertase, CIN)和液泡转化酶(vacuolar invertase, VIN),CWIN和VIN属酸性转化酶,CIN属中性转化酶[2]。已有的研究结果表明,NI是研究蔗糖代谢的关键酶之一[3],芒果糖代谢研究也不例外。赵家桔[4]的研究结果表明,‘贵妃芒‘金煌芒‘红玉芒成熟阶段果实中的果糖含量与AI、NI活性呈显著相关,蔗糖含量与蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)活性呈显著相关;但魏长宾等[5-6]研究‘爱文芒和‘粤西1号芒后熟阶段AI、SS、SPS的活性显著增加,NI活性略有增加;武红霞等[7]的研究结果表明,造成‘台农1号芒果实蔗糖积累的主要原因是成熟阶段SPS、SS活性的增加及AI活性的降低,而果实发育进程中NI活性变化不大。截至目前,已有报道在龙眼[8]、甘蔗[9]、茶树[10]、番茄[11]等作物上相继克隆NI基因并开展相关研究,虽然芒果上已有上述关于NI酶活性的报道,但有关芒果NI基因的克隆及表达分析尚未见报道。
为了明确NI基因在果实发育进程中的作用,笔者以不同发育阶段的‘台农1号果实为材料,克隆芒果NI基因,命名为MiNI,登录号(GenBank No: MN893670),并对其编码蛋白和MiNI基因在果实不同发育阶段的表达情况进行分析,为从分子角度阐明NI基因在果实发育进程中的作用及明确芒果糖代谢机理奠定基础。
1 材料与方法
1.1 材料
试验材料为种植于海南省乐东县黄流镇佛老村10年生‘台农1号芒果,芒果出花后至采收,仅进行防病虫药物喷施,不再进行任何处理。选取树势、冠幅、花期相对一致的植株3株为采样对象,分别于花后10、40、70、100、130 d采集不同发育阶段的芒果果实,随后立即分离果皮和果肉,快速装入提前备好的锡箔纸后,马上放入液氮,返回实验室后置于?80 ℃冰箱中保存备用。
1.2 方法
1.2.1 RNA提取和cDNA合成 RNA提取采用北京华越洋科技有限公司的华越洋普通RNA提取试剂盒,具体提取方法参照试剂盒说明书;cDNA第一链的合成采用宝生物工程(大连)有限公司的PrimeScript? II Reverse Transcriptase试剂盒,反转录方法参照试剂盒说明书。
1.2.2 MiNI基因全长cDNA的克隆 利用NCBI网站搜索已公布的NI基因片段序列,通过序列比对找到同源序列,再通过本地Blast从芒果转录组测序数据(SRP035450)[12]抓取MiNI基因,使用Snapgene 3.2.1軟件寻找开放阅读框,利用Primer 5.0在MiNI基因开放阅读框起始端和终止端设计特异引物,MiNIF为5-ATGAATACTGGTAGC TGTATTGGAATC-3,MiNIR为5-TTAAATGA TAATCTTGGTTCTTGAGGC-3,PCR反应程序为:95 ℃预变性3 min;95 ℃ 30 s,58 ℃ 20 s,72 ℃ 2 min,共30个循环;72 ℃延伸10 min。获得MiNI基因开放阅读框序列,连接载体转化大肠杆菌挑阳性菌液测序,得到MiNI基因编码区序列。
1.2.3 MiNI基因生物信息学分析 利用NCBI数据库Blast程序对MiNI基因进行同源分析;利用Snapgene 3.2.1软件寻找开放阅读框,分析编码的氨基酸序列组成和分子量;利用ProtParam在线软件(http://web.expasy.org/protparam)分析编码蛋白的等电点等理化性质;利用NCBI网站Conserved Domains Search功能查找蛋白保守功能结构域;利用Phyre2网站(http://www.sbg. bio.ic.ac.uk/phyre2/html/page.cgi?id=index)和PyMOL软件预测MiNI基因编码蛋白三级结构;使用MEME(http://meme-suite.org/)和SWISS-MODEL(https://swissmodel.expasy.org/)在线软件进行Motif位点分析和功能结构分析,采用Mega 5.0软件构建系统进化树。
1.2.4 芒果果实不同发育期MiNI基因的表达分析 提取芒果果实不同发育时期果皮和果肉的RNA,RNA样本中的DNA利用RNase-free DNase I进行消化,消化后1 μg的总RNA用来合成cDNA第一链。实时荧光定量PCR使用SYBR Premix Ex Taq荧光染料,在ABI StepOnePlusTM(Ambion, Foster City, CA)仪器上进行。利用Primer 5.0于MiNI基因非保守区设计荧光定量PCR引物,MiNI-RTF 5-GAGTATGAGGAATGGCGTAT-3,MiNI-RTR 5-CAAGTATGGTAGCGAGGG-3,以果期稳定表达的MiEF基因为内参基因[8]。采用2步法进行荧光定量PCR,反应程序为:95 ℃,30 s;95 ℃,5 s,60 ℃,34 s,共40个循环;采用Wang等[9]的方法分析溶解曲线,采用2CT法进行相对定量分析,计算出MiNI基因在不同阶段的相对表达量。
2 结果与分析
2.1 MiNI基因全长cDNA的克隆
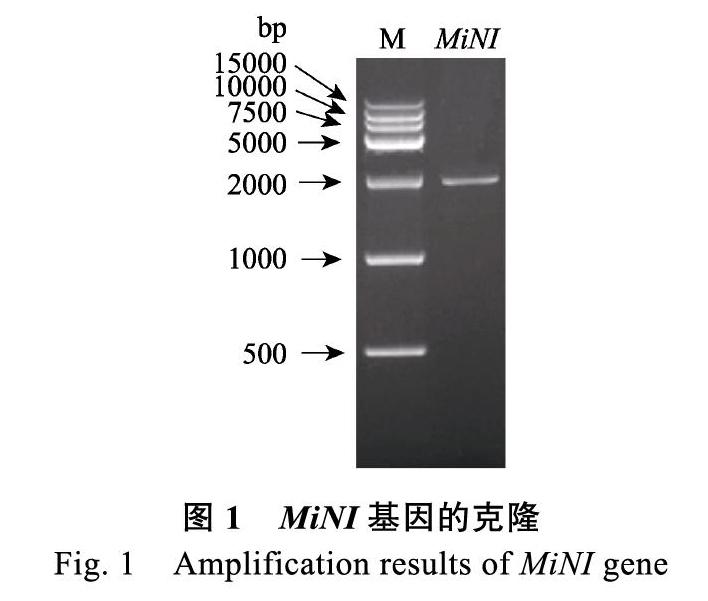
提取芒果果实总RNA,经琼脂糖凝胶电泳检测合格后,反转cDNA;以cDNA为模板,根据编码区起始端、终止端序列设计的特异引物进行MiNI基因编码区PCR扩增,凝胶电泳结果显示,目的条带约2000 bp(图1)。回收目的条带,连接克隆载体后测序,测序结果与转录组测序结果一致,证实已成功克隆MiNI基因的cDNA编码区。
2.2 MiNI基因生物信息学分析
2.2.1 理化性质分析 克隆的MiNI基因开放阅读框为2034 bp,编码677个氨基酸,相对分子量为76.6 kDa,理论等电点为6.24,分子式为C3431 H5373N927O1000S32,不稳定系数(Instability index)为38.67,属于稳定蛋白;亲水性为0.222,属亲水性蛋白;Proparam在线软件分析MiNI基因编码蛋白的氨基酸组成情况,结果发现Leu含量较高。
2.2.2 蛋白结构分析 蛋白质二级结构预测结果发现,MiNI基因编码蛋白的二级结构主要以α螺旋(alpha helix, 38.85%)和无规则卷曲(random coil, 35.45%)为主,同时也有少量的伸展链(extended strand, 18.91%)和β折叠(beta turn, 6.79%)结构;将MiNI基因编码的氨基酸序列与其他物种NI基因编码的氨基酸进行比对,结果发现均具有glycoside hydrolase family 100保守结构域和GDE_C保守结构域,利用NCBI网站Conserved Domains Search功能,查找保守功能结构域发现,MiNI基因编码的第198~634氨基酸序列为glycoside hydrolase family 100特定匹配序列,第381~435氨基酸序列为GDE_C特定匹配序列(图2)。
2.2.3 同源性分析及进化关系分析 通过NCBI blastp程序比对发现,MiNI基因编码氨基酸与柑橘属的克里曼丁桔(Citrus clementina)NI基因(XP_006419305.1)编码氨基酸同源性最高,达84.62%;与龙眼(Dimocarpus longan)NI基因(AJW82915.1)、巴西橡胶树(Hevea brasiliensis)NI基因(AGQ57013.1)、番木瓜(Carica papaya)NI基因(XP_021906847.1)、菠萝(Ananas comosus)NI基因(OAY70851.1)、葡萄(Vitis vinifera)NI基因(CBI39621.3)、拟南芥(Arabidopsis thaliana)NI基因(NP_001319483.1)、玉米(Zea mays)NI基因(AQK52953.1)编码氨基酸同源性分别为82.48%、79.39%、76.16%、73.88%、70.47%、68.09%、59.48%。
使用MEME(http://meme-suite.org/)在线软件Motif Discovery功能,对与芒果NI同源性较高的克里曼丁桔、龙眼、巴西橡胶树、番木瓜NI蛋白序列進行Motif位点分析,得到10个保守基序,结果显示芒果NI与克里曼丁桔、龙眼、巴西橡胶树、番木瓜NI具有一致的Motif位点(图3);对10个保守基序进行功能注释,SWISS-MODEL分析结果表明,Motif 3-10均为homo-hexamer结构,功能注释为中性转化酶,Motif 1-2未得到其结构功能信息(表1)。
以MiNI基因编码氨基酸序列为目标序列,在NCBI进行Blast比对,下载各同源序列;利用MEGA 5.0软件Neighbor-Joining法进行氨基酸序列进化分析,比对结果发现,MiNI基因编码的氨基酸与柑橘属的克里曼丁桔和龙眼的关系最近,与玉米和枸杞的关系最远(图4)。
2.3 MiNI基因相对表达分析
以花后10 d MiNI基因表达量为对照(由于此时新生芒果直径不足2 mm,无法将果皮果肉分开,所以图5中10 d的基因表达量仅用一横线柱表示),芒果果实不同发育阶段MiNI基因的表达结果显示,在果实的不同发育时期,MiNI基因的相对表达量存在显著性差异。从花后10~40 d,MiNI基因表达量显著下降,果皮和果肉Ct值达到0.4345和0.0289;花后40~100 d,果皮中基因表达量相对稳定,无显著差异,Ct值维持在0.4275~0.5001之间,而果肉表达量维持在一个更低的水平;直至130 d果实成熟度最高时,果皮表达量又显著增高至0.7979,但此时果肉中MiNI基因表达量降低至最低水平,Ct值仅为0.0007。从图5可看出,MiNI基因表达主要在果皮中,果肉中表达量很低,且果实发育各时期果皮内MiNI基因表达量均显著高于果肉。
不同小写字母表示不同处理间差异显著(P<0.05)。
3 讨论
本研究基于芒果转录组测序数据(SRP-035450)[12],克隆了与NI基因高度同源的cDNA序列,测序结果与转录组数据库序列一致,表明成功克隆了MiNI基因序列。蛋白结构保守域分析表明,芒果NI具有glycoside hydrolase family 100结构保守域,glycoside hydrolase family 100是糖苷水解酶的一个家族,糖苷水解酶主要功能为水解碳水化合物的糖苷键,AI和NI均属于糖苷水解酶家族100成员[13-14]。同时,本研究通过MEME在线网站分析预测了NI 10个Motif位点,结果表明芒果、克里曼丁桔、龙眼、巴西橡胶树和番木瓜具有一致的Motif位点,根据结构相似功能相似的原理,也可证实成功克隆了MiNI基因。本研究对MiNI基因进行了包括同源性分析、保守结构域分析、Motif位点分析和进化分析在内的较为全面的生物信息学分析,结果表明,MiNI基因与其它植物NI基因相似性很高,进化较为保守。
qRT-PCR分析结果显示,从花后40 d至果实发育后期,果皮MiNI基因表达量始终高于果肉,这与王婷婷等[15]的研究结果一致,而关于果皮和果肉中NI酶活性和蔗糖、果糖、葡萄糖含量的测定也将是今后研究的内容,研究结果将有利于阐明果皮果肉在糖代谢过程中的地位和作用;另一方面,武红霞等[7]关于‘台农1号芒果的研究结果表明,整个果实发育期间,果肉NI酶活性变化不大,处于相对稳定水平,这与本研究中果肉MiNI基因表达量相对稳定,始终处于较低水平的结果也是相符的。Gao等[16]研究表明,NI基因的表达量与NI活性呈显著正相关,Joubert等[17]通过转化反义NI基因至甘蔗,悬浮培养14 d,发现细胞中NI活性显著降低,使得蔗糖浓度显著增加,己糖含量明显降低,这表明NI基因在糖代谢途径发挥了重要作用。另一方面,桃果实研究结果暗示NI基因可能在糖代谢中发挥着调节作用[18]。综上所述,NI基因在植物发育过程中起重要作用,为分析该基因在芒果蔗糖代谢途径中的作用和利用分子生物学手段调控NI基因的表达,进而改变果实糖含量和改良果实品质奠定基础。
参考文献
[1] 潘秋红, 张大鹏. 植物转化酶的种类﹑特性与功能[J]. 植物生理学通讯, 2004(3): 275-280.
[2] Masuda H, Takahashi T, Sugawara S. The occurrence and properties of alkaline invertase in mature roots of sugar beets[J]. Journal of the Agricultural Chemical Society of Japan, 2006, 51(9): 2309-2314.
[3] Yao Y, Geng M T, Wu X H, et al. Genome-wide identification, expression, and activity analysis of alkaline/neutral invertase gene family from cassava (Manihot esculenta Crantz)[J]. Plant Molecular Biology Reporter, 2015, 33(2): 304-315.
[4] 赵家桔. 芒果品质构成及其发育规律的研究[D]. 海口: 海南大学, 2010.
[5] 魏长宾, 武红霞, 马蔚红, 等. 芒果成熟阶段蔗糖代谢及其相关酶类研究[J]. 西南农业学报, 2008, 21(4): 972-974.
[6] 魏长宾, 武红霞, 马蔚红, 等. 粤西 1 号芒果成熟阶段的蔗糖代谢[J]. 热带作物学报, 2009, 30(6): 735-739.
[7] 武红霞, 邢姗姗, 王松标, 等. ‘台农1号芒果果实发育过程中的糖分积累与相关酶活性研究[J]. 西北植物学报, 2011, 31(9): 1811-1815.
[8] 帅 良, 廖玲燕, 韩冬梅, 等. 龙眼中性转化酶基因(DlNI)的克隆及分析[J]. 西南农业学报, 2017, 30(10): 2202-2209.
[9] Wang L M, Zheng Y X, Ding S H, et al. Molecular cloning, structure, phylogeny and expression analysis of the invertase gene family in sugarcane[J]. BMC Plant Biology, 2017, 17(1): 109.
[10] 钱文俊, 岳 川, 曹红利, 等. 茶树中性/碱性转化酶基因CsINV10的克隆与表达分析[J]. 作物学报, 2016, 42(3): 376-388.
[11] 高媛媛, 杨郁文, 张保龙, 等. 番茄中性/碱性蔗糖转化酶基因的電子克隆、分析及表达载体的构建[J]. 江苏农业科学, 2009, 37(6): 36-38.
[12] 武红霞, 许文天, 罗 纯, 等. 芒果果实转录组数据组装及基因功能注释[J]. 热带作物学报, 2016, 37(11): 2191-2198.
[13] Lee H, Sturm A. Purification and characterization of neutral and alkaline invertase from carrot[J]. Plant Physiology, 1996, 112(4): 1513-1522.
[14] Sturm A. Invertases. primary structures, functions, and roles in plant development and sucrose partitioning[J]. Plant Physiology, 1999, 121(1): 1-8.
[15] 王婷婷, 趙紫涵, 张雅彬, 等. 枸杞中性转化酶NI基因的克隆及组织表达分析[J/OL]. 基因组学与应用生物学, (2019-04-24)[2019-12-01]. https://navi.cnki.net/knavi/Journ-alDetail?pcode=CJFD&pykm=GXNB.
[16] Gao F, Cao X F, Si J P, et al. Characterization of the alkaline/neutral invertase gene in Dendrobium officinale and its relationship with polysaccharide accumulation[J]. Genetics and Molecular Research, 2016, 15(2): 1-8.
[17] Joubert D, Bosch S, Botha F C, et al. Down-regulation of neutral invertase activity in sugarcane cell suspension cultures leads to increased sucrose accumulation[J]. South African Journal of Botany, 2007, 73(2): 293.
[18] Nonis A, Ruperti B, Falchi R, et al. Differential expression and regulation of a neutral invertase encoding gene from peach (Prunus persica): evidence for a role in fruit development[J]. Physiologia Plantarum, 2007, 129(2): 436-446.
