38例胎儿心脏肿瘤的超声、病理及遗传学特点分析
2020-10-29谷孝艳郝晓艳刘晓伟韩建成何怡华
陈 健,谷孝艳,韩 玲,郝晓艳,刘晓伟,张 烨,韩建成,何怡华
原发性心脏肿瘤是一种罕见疾病,婴幼儿发病率约为0.25%,而尸检结果其发病率更低,约为0.002%[1]。随着产前检测技术的发展,近年来越来越多的胎儿心脏肿瘤被发现和报道,其中绝大部分为超声检出,尤其是胎儿超声心动图(fetal echocardiography,FE)[2]。大多数原发性心脏肿瘤都是良性,其中最常见为横纹肌瘤,其次为畸胎瘤、纤维瘤、血管瘤、嗜酸性细胞心肌增生(症)、黏液瘤等;极少数为恶性肿瘤,如横纹肌瘤肉瘤、纤维肉瘤等[2-3]。多数心脏肿瘤对心脏本身的影响较小,常见的心脏肿瘤并发症为心脏杂音、心包积液、心律失常、瘤体引起的机械梗阻及心力衰竭等,其治疗措施在妊娠期比较有限,少数位于胎儿心包腔的肿瘤如畸胎瘤可以在妊娠期手术切除,多数需要在产后进行处理,通常预后良好[4]。
心脏肿瘤也可以是一些系统性遗传疾病的首发症状,如结节性硬化(tuberous sclerosis complex,TSC)、家族性黏液瘤综合征(呈多系统黏液瘤样表现,可累计皮肤、羊膜、心脏、乳房、肾上腺、垂体及睾丸等)、痣样基底细胞癌综合征和Beckwith-Wiedemann综合征(巨大儿、巨舌症、脐膨出)等[5],其中与TSC密切相关的肿瘤最常见的为心脏横纹肌瘤[6]。TSC是一种常染色体显性遗传疾病,累及多系统,常常预后不良,目前发现TSC1和TSC2基因与其存在密切的关系,2012年国际TSC大会已经将TSC1和TSC2基因的致病性突变作为一项单独的诊断标准[7-8]。
本研究的目的是筛选临床通过超声心动图检出的胎儿心脏肿瘤病例,对其超声心动图及其对应的病理检测结果进行分析,同时进行家系遗传学检测,深入探讨胎儿心脏肿瘤的发病特点。
1 资料与方法
1.1 研究对象 入选2015年9月—2018年2月38例因胎儿心脏肿瘤来北京安贞医院母胎医学会诊中心就诊的孕妇及其家系入组。所有胎儿均在本中心接受了胎儿超声心动图检查,均诊断出单发或多发心脏肿瘤。同时经知情同意,所有家系均选择在产前或产后接受家系TSC目标基因检测。根据2012年国际TSC协会发布的TSC诊断修订标准,入选的胎儿及父母均需要完善相关检查,对其临床表型进行确认。
1.2 知情同意 本研究经首都医科大学附属北京安贞医院伦理委员会批准。所有接受基因检测的病人或监护人均需要签署知情同意书,胎儿病理解剖需要家属签署病理解剖知情同意书,对于无法签署上述知情同意的家系将不纳入本研究。
1.3 胎儿超声心动图检测 使用GE-E8超声诊断仪,RAB 4-8-D三维容积探头,Fetal Heart模式,根据2013国际妇产科超声协会(International Society of Ultrasound in Obstetrics and Gynecology,ISUOG) FE指南采集各个标准切面图像,主要包括:心尖或肋下四腔心切面、主动脉长轴切面、肺动脉长轴切面、心室短轴切面、大血管短轴切面、主动脉弓切面、导管弓切面、上下腔静脉切面和三血管切面;重点观察心腔及心肌内有无占位性病变[9]。
1.4 样本采集 对孕妇及其家属采集外周血进行基因检测,用4 mL乙二胺四乙酸(ethylene diaminete traacetic acid,EDTA)抗凝管采集血样,每人两管;通过羊水穿刺/脐带血管穿刺抽取胎儿羊水/脐带血来进行疑似TSC的胎儿目标基因检测,羊水采集量为20 mL,脐带血采集量为4 mL。对于选择终止妊娠的孕妇,对胎儿进行病理解剖并取样送检基因,取样部位为胎儿皮肤、心肌及脐带组织,每个部位大小为5 mm×5 mm。
血液样品使用冰盒运输,24 h内送达实验室进行分析。羊水样品要求采集后2 h内进行离心处理,然后使用冰盒运输,24 h内送达实验室进行分析。
1.5 基因检测 使用标准程序从组织、羊水/脐带血、外周血样里提取DNA。本测试采用自主研发的探针捕获试剂,针对引起多发性结节硬化症的TSC1、TSC2基因,进行全基因序列捕获,覆盖区域约为368 kb。富集后在Illumina HiSeq 2500测序平台进行高通量测序,平均覆盖深度大于100X。对原始测序数据进行低质量的过滤,然后利用标准生物信息分析流程对变异位点进行检出、过滤和注释。
变异位点过滤标准包括人群数据库中频率(ExAC或千人基因组)<5%、最小覆盖深度为20X,变异功能变化(非同义突变、剪切位点变化、无义突变、移码突变等)等。使用BWA将测序结果与人类基因组序列(hg19)比对,通过samtools和pindel软件工具找出相关突变;接着结合dbSNP、OMIM及swissVar数据库对检出突变进行进一步过滤;最后使用Provean和SIFT软件对突变的致病性进行预测。所有被检出的致病突变和疑似致病突变均再次进行Sanger测序验证。
1.6 统计分析 临床医生与基因分析专员会对检出突变的生物信息、病人临床表型、临床症状以及就诊治疗情况进行综合分析,基于以上信息综合做出遗传学诊断和预后分析。
2 结 果
2.1 胎儿及其家系检测分析 共检测分析了38例胎儿及其家系(见表1)。入选孕妇年龄19~42岁,中位数为28岁;孕龄23~38周,中位数为27周。所有胎儿均经胎儿超声心动图检出心脏肿瘤,其中多发肿瘤30例,单发肿瘤8例。所有38例胎儿均成功接受了基因检测,其中产前羊水穿刺或脐带血穿刺取样6例,32例为引产后提取胎儿相关DNA样本。最终38例孕妇及家属均决定终止妊娠,并且接受了胎儿病理解剖。
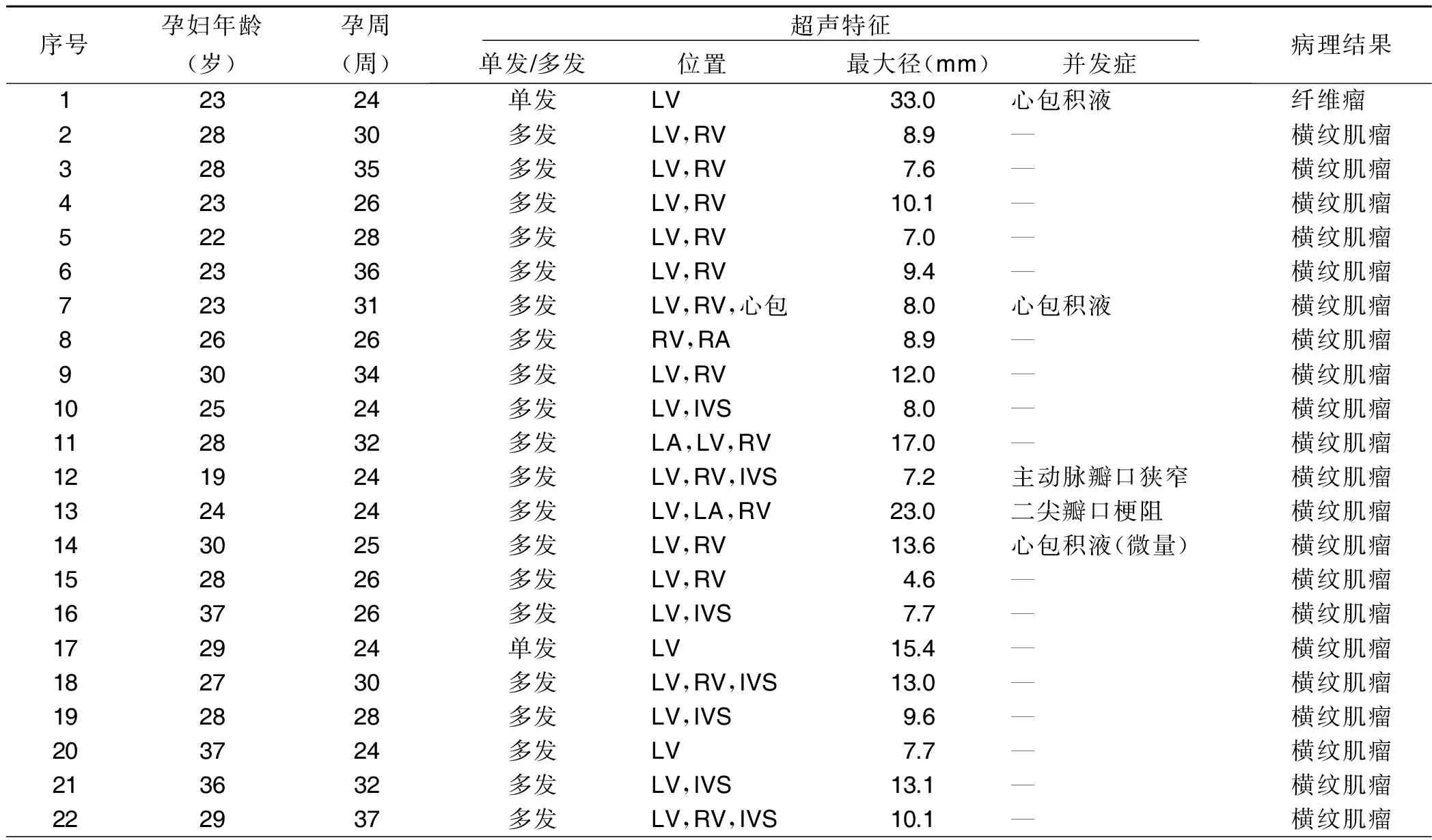
表1 38例胎儿心脏肿瘤一般资料、超声及临床特点
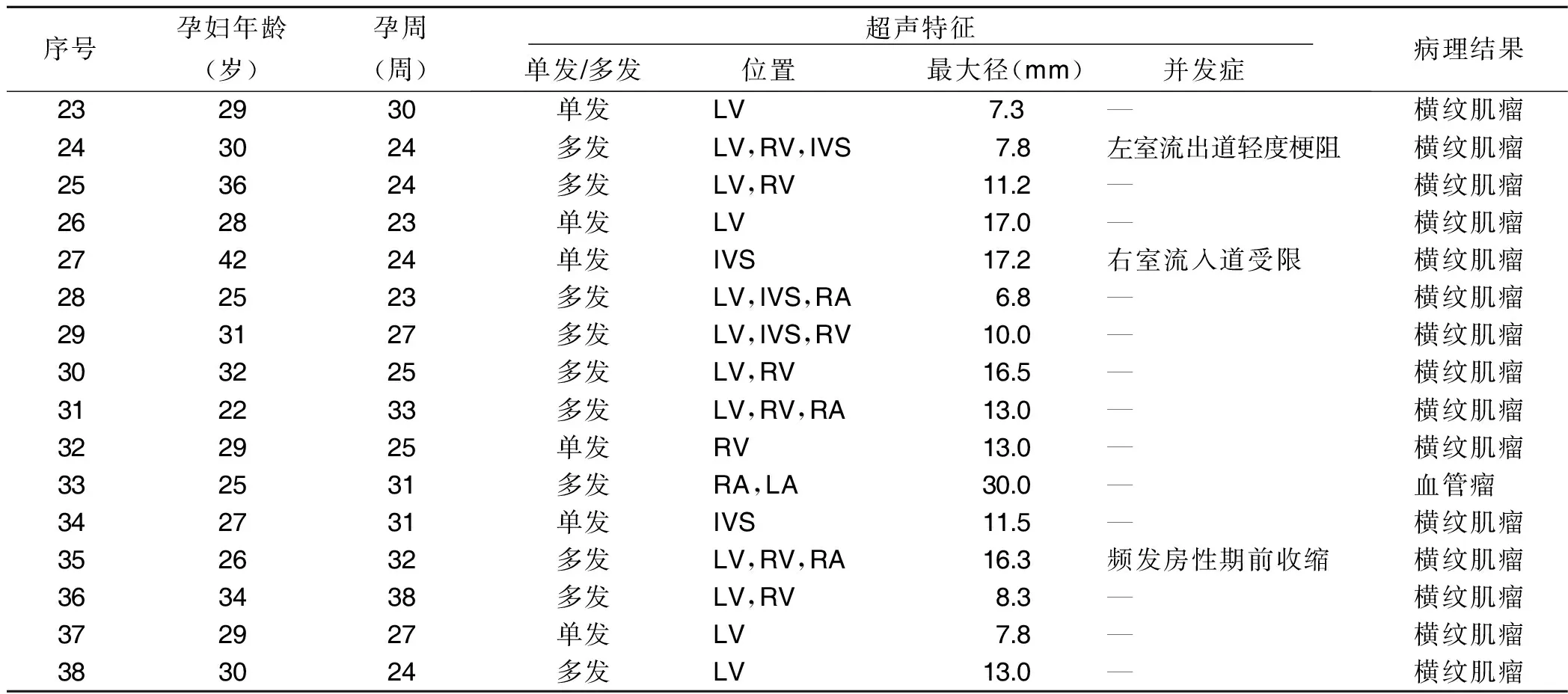
(续表)
2.2 胎儿超声心动图检测结果 38例胎儿心脏肿瘤中,多发性肿瘤30例,单发性肿瘤8例。肿瘤以多发为主,最常累及的位置是左室,累及次数为33次,其次是右室,累及次数为23次;肿瘤最大径约为33.0 mm,最小径为4.6 mm;大多数肿瘤位于心腔内或心肌,与正常心肌组织分界尚清,仅有1例出现向外生长累及心包腔的情况。8例(15%)胎儿出现心脏肿瘤并发症,其中,4例瘤体引起的机械梗阻,3例心包积液,1例心律失常。其中12号家系胎儿的心脏肿瘤与主动脉瓣关系紧密,并有轻度的粘连,导致明显的左室流出道梗阻。这8例存在心脏肿瘤并发症的家系均选择终止妊娠,病理结果显示其心脏肿瘤均为横纹肌瘤。典型胎儿超声心动图见图1、图2。
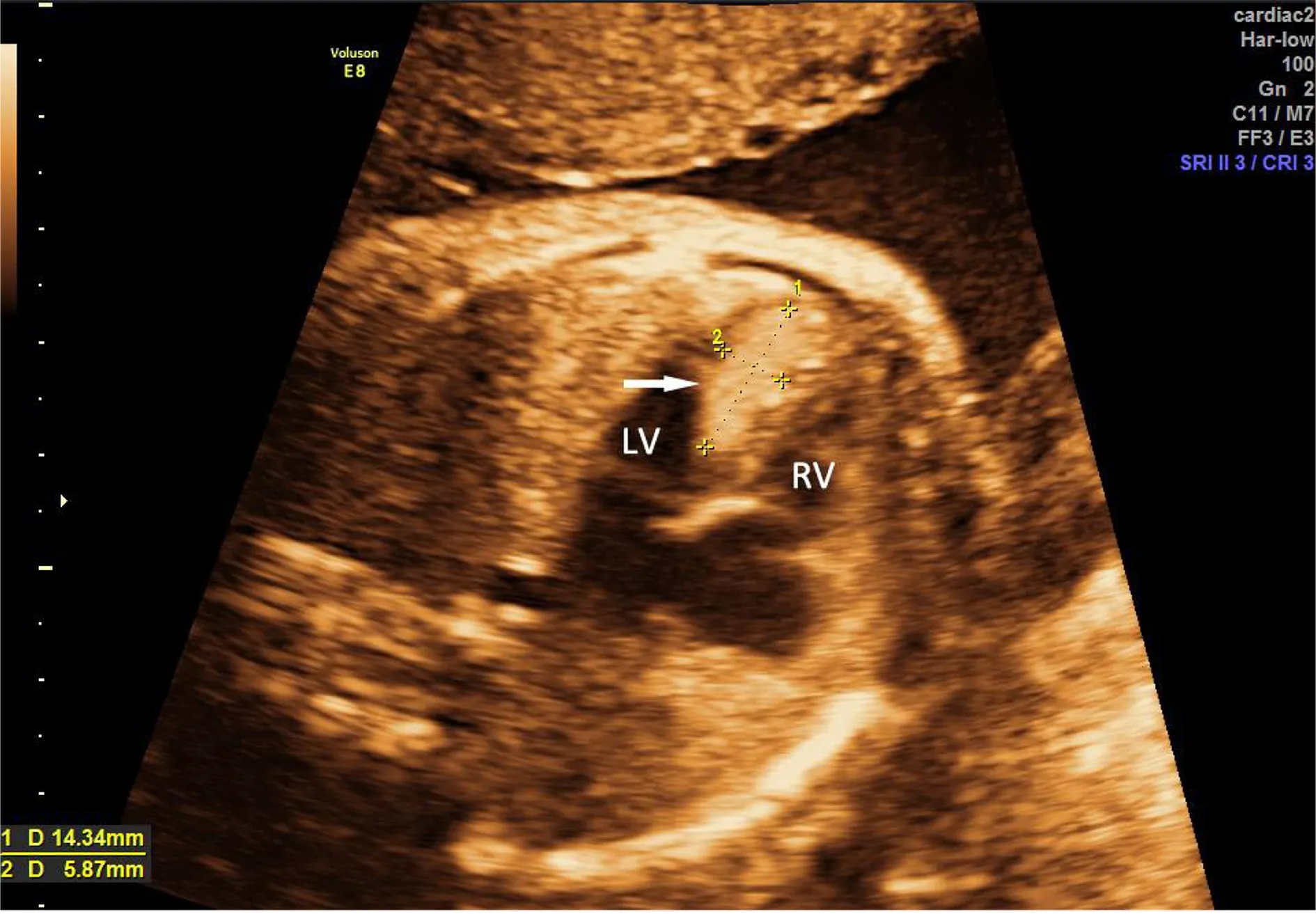
图1 胎儿超声心动图四腔心切面(一)
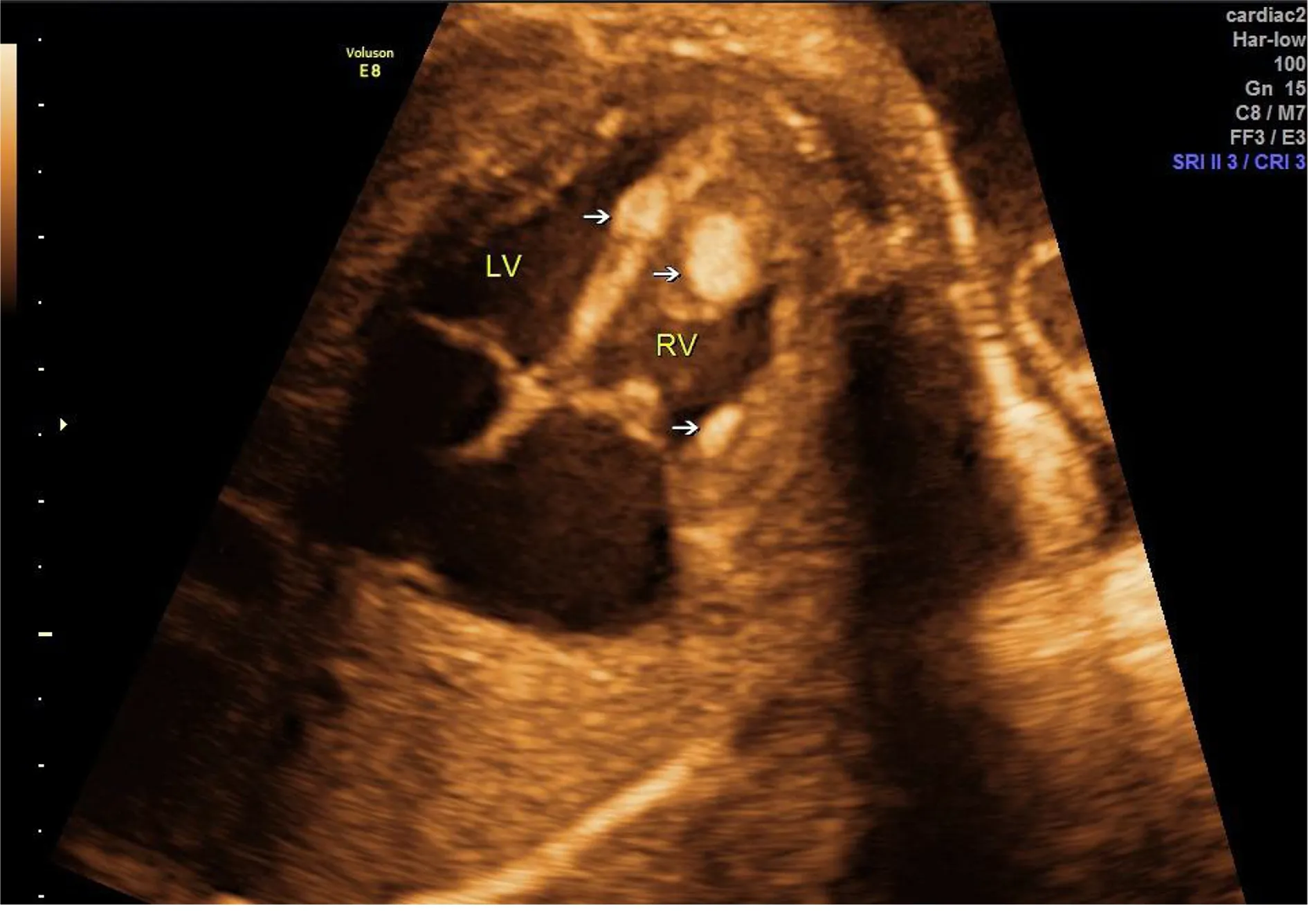
图2 胎儿超声心动图四腔心切面(二)
2.3 胎儿心脏肿瘤病理及基因检测结果 38例胎儿心脏肿瘤家庭均选择终止妊娠,并接受了胎儿心脏病理检查,结果显示其中36例为横纹肌瘤(其中多发横纹肌瘤29例,单发横纹肌瘤7例,见图 3),1例为多发性血管瘤,1例为单发性纤维瘤(见表2)。TSC基因检测结果显示,除1例血管瘤和1例纤维瘤外,横纹肌瘤病例中,29例多发横纹肌瘤TSC基因阳性27例(93%,27/29),7例单发横纹肌瘤TSC基因检测阳性5例(5/7)。4例胎儿横纹肌瘤家系基因检测结果均为阴性,其中单发和多发横纹肌瘤各2例。
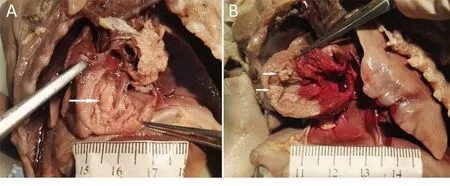
图3 胎儿大体解剖图
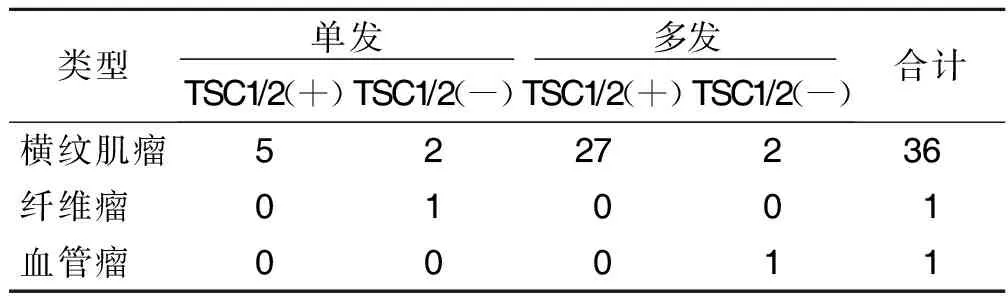
表2 38例胎儿心脏肿瘤病理类型与基因对照 单位:例
2.4 TSC1和TSC2基因家系检测结果 38例胎儿及父母均接受了TSC1和TSC2目标基因检测,其中通过32例为引产后提取胎儿相关DNA样本,4例为产前脐带血管穿刺取样,2例为通过产前羊水穿刺取样。共有32例胎儿TSC基因检测阳性,TSC1突变5例,TSC2突变27例,均为致病或疑似致病的突变,在基因学方面可确诊TSC。在上述32个突变中,新发突变20例,家系遗传突变12例(见表3)。少数胎儿在影像学及病理检查中被发现有其他系统病变:1例胎儿尸检时发现存在明显的多发皮肤白斑;5例胎儿在晚孕期胎儿头部核磁检查显示出现室管膜下多发结节。

表3 38例胎儿心脏肿瘤TSC基因检测结果 单位:例
3 讨 论
横纹肌瘤是胎儿期最常见的心脏肿瘤[10],本研究也证实了这一点,尸检胎儿中横纹肌瘤占比为95%。胎儿的孕周对于胎儿心脏肿瘤的发现有较大的影响,本研究中超声心动图检出心脏肿瘤的孕周中位数达27周,最小孕周为23周。在合适的孕龄,所有心脏肿瘤均能被FE检出,主要使用切面为四腔心切面。对于高危家系,孕期FE筛查时间越早越好,但最佳检测时间为孕中期,但对于直径小于3 mm的肿瘤,超声心动图可能会出现漏诊,对于可疑病例推荐有经验的医生连续多次扫查[11]。总体来说,权衡检出率、病人接受度和经济适用性等方面的因素,FE检测是目前最适合的筛查方式。
心脏横纹肌瘤的生长具有双向性,在孕32周左右部分横纹肌瘤开始出现退化的趋势,并持续至出生后一年[5]。而引起心脏横纹肌瘤出现自限性表现的主要因素就是肿瘤里的“蜘蛛样细胞”,其并非真正的肿瘤细胞,而是富含糖原的异型心肌细胞,其不断增大的糖原空泡会使细胞质丝退化,最终结局为凋亡、坏死和黏液样变性[1]。肿瘤的退化与肿瘤的大小、数目及位置并没有明显的关系。约80%的心脏横纹肌瘤会在儿童期退化直至自行消失[12],因此,胎儿期是检出心脏横纹肌瘤的最佳时间段。本研究中大多数心脏肿瘤局限于心腔内,并且生长相对缓慢,仅有8例(21%)胎儿出现心脏并发症,且没有出现影响胎儿生命的严重并发症。
胎儿心脏横纹肌瘤在TSC的众多临床表现中,可能是其最早的表现之一[13]。因此,FE对于胎儿心脏横纹肌瘤的识别具有重要的诊断意义,本研究中93%(27/29)的多发横纹肌瘤胎儿基因检测阳性,这也证实了多发的心脏横纹肌瘤是TSC强有力预测因子[14]。而单发的心脏横纹肌瘤情况则略有不同,既往的研究显示约50%的单发横纹肌瘤合并TSC[2],但本研究中共有7例单发心脏横纹肌瘤经病理证实,其中5例TSC1或TSC2基因检测阳性,4例为新发突变,1例为家系遗传突变。本研究结果显示单发心脏横纹肌瘤与TSC也有着较高的相关性,其原因可能是本研究依据病理结果进行统计,而不是仅仅根据FE,排除了非横纹肌瘤病例的影响,但病例数较少,仍需增加病例进一步证实。
FE难以对非TSC的心脏横纹肌瘤与合并TSC的心脏横纹肌瘤进行鉴别,2012年国际TSC大会对TSC诊断标准进行了修订,将基因诊断作为一个单独诊断标准,因此,FE联合基因诊断可将产前诊断TSC变为可能[8]。TSC1基因和TSC2基因分别位于染色体9q34和16p13.3,分别参与编码形成错构瘤蛋白和马铃薯蛋白,形成TSC蛋白复合体,对雷帕霉素靶蛋白(mTOR1)信号通路起到关键的抑制调控作用[15]。常规外周血外显子测序,约有85%的TSC病人检测出明确的TSC1或TSC2致病突变[16];通过改进检测方法如增加测序深度等和增加样本取材部位等,剩余病人中2/3能够被检测出非常规位置的TSC1或TSC2突变,包括内含子区域突变或嵌合体形成[17]。目前研究显示没有证据支持存在新的TSC致病基因[18]。因此,基因诊断对于TSC的临床诊断是一个重要的补充,尤其是对于临床表型不明显的胎儿。
随着对胎儿心脏病围生期管理的关注以及多学科协作医疗模式的广泛开展,越来越关注的不仅是产前胎儿心脏疾病的检出,更多的是对每一种疾病给予正确的预后咨询和围生期管理。对于胎儿横纹肌瘤而言,预后咨询指导中不单纯向孕妇及家属介绍肿瘤本身的预后,还要注重交代横纹肌瘤与TSC的关系及TSC的预后,并为可能的早期治疗做好准备。
