完全腹腔镜与开腹手术治疗复发性肝癌的疗效及外周血SDF-1/CXCR4的动态变化
2020-10-29黄致远梅洪亮胡逸林金炜东
黄致远,梅洪亮,胡逸林,金炜东
(中国人民解放军中部战区总医院普通外科,湖北 武汉,430071)
肝癌是临床常见的恶性肿瘤之一,具有高复发倾向,目前暂无有效方法能将其阻断。肝癌复发的原因在于肿瘤的同源性及术中可能引起的扩散转移等[1]。手术切除是目前治疗复发性肝癌最有效的方法,远期治疗效果佳。开腹手术具有手术切口大、操作复杂、术后康复慢等缺点;完全腹腔镜下切除肝癌组织已得到一定应用,具有切口小、出血少等优点[2-3]。为进一步明确两种手术的治疗效果,对70例复发性肝癌患者分别行开腹切除术与完全腹腔镜手术,观察近、远期临床疗效及外周血基质细胞衍生因子1(stromal cell derived factor-1,SDF-1)及其受体CXCR4的动态变化。现将体会报道如下。
1 资料与方法
1.1 临床资料 选取2014年2月至2018年1月我科收治的70例复发性肝癌患者,随机分为两组,每组35例,两组患者性别、年龄、肝功能Child分级等临床资料差异无统计学意义(P>0.05),见表1。纳入标准:(1)接受原发性肝癌根治性治疗;(2)经细胞学及组织学病理诊断为肝癌复发;(3)无明显的手术禁忌证;(4)无大血管、胆管侵犯及转移;(5)肝功能评级[4]:A级或B级;(6)经医院伦理委员会审批,患者自愿参与本研究。排除标准:(1)肿瘤已侵犯大血管与胆管;(2)明显的手术禁忌证;(3)肝功能C级;(4)基础合并症急性期。
表1 两组患者临床资料的比较(±s)
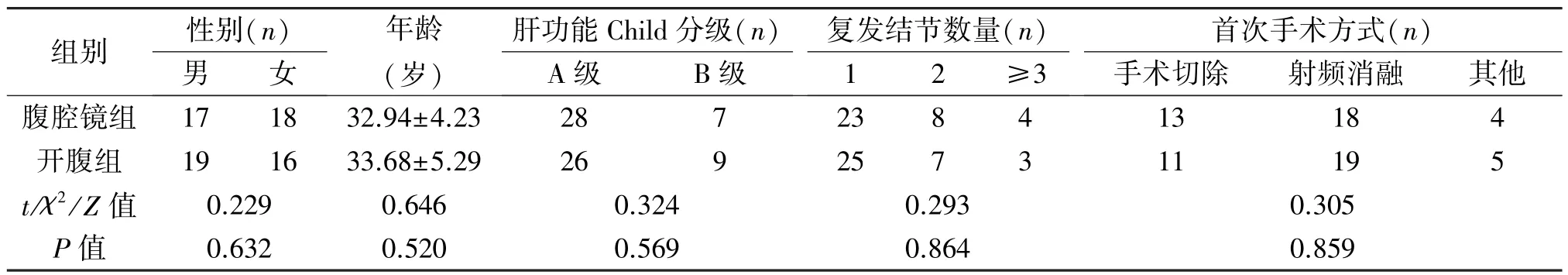
表1 两组患者临床资料的比较(±s)
组别 性别(n)复发结节数量(n)肝功能Child分级(n)首次手术方式(n)男 女年龄(岁)A级 B级1 2 ≥3手术切除 射频消融 其他腹腔镜组 17 18 32.94±4.23 28 7 23 8 4 13 18 4开腹组 19 16 33.68±5.29 26 9 25 7 3 11 19 5 t/χ2/Z 值 0.229 0.646 0.324 0.293 0.305 P值 0.632 0.520 0.569 0.864 0.859
1.2 手术方法 采用全身插管麻醉。腹腔镜组[5]:常规五孔法施术,首先于脐上缘做1.5 cm小切口,穿刺气腹针建立气腹,压力维持在8~12 mmHg,如果肿瘤位于 S2、S3段,则采取4孔法施术,左侧肋缘下做0.5 cm辅助操作孔即可。打开肝胃韧带,暴露网膜孔,阻断肝门(图1),切除肝癌病灶时用超声刀分离术野粘连,见图2,上述操作孔位置尽量避开粘连;如无法避开腹腔粘连,可先行腹腔镜下粘连分离。分离完成后采用LigaSure电凝止血,如仍不能止血,可用连发钛夹止血。超声刀(确保切缘距肿瘤大于2 cm)沿肝表面的切线分离肝实质(图3)。如术野仍有少量渗血,可使用明胶海绵止血。检查创面无活动性出血后,于脐侧缘扩大切口,取出标本。常规不放置腹腔引流管。开腹组[6]:根据肿瘤位置,可采用腹壁正中或肋缘下斜切口,开腹后分离术野粘连,肿瘤位于S2、S3段,行开腹肝左外叶切除,常规放置腹腔引流管。
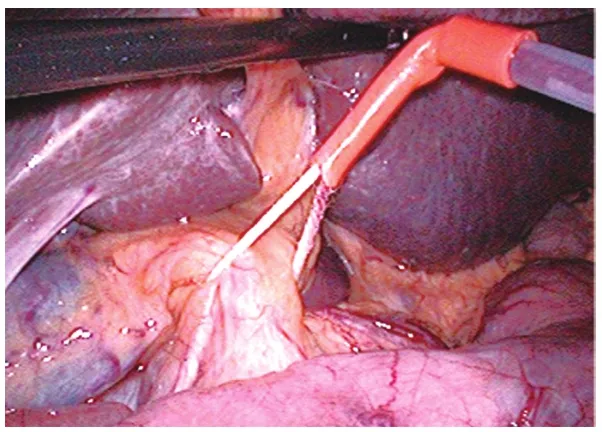
图1 肝门阻断
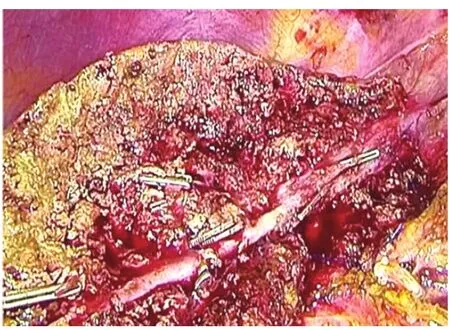
图2 游离并预处理左静脉

图3 左半肝切除断面
1.3 随访情况 手术结束后通过门诊及电话随访一年,每3个月随访1次,主要通过体格检查、血常规、胸片、结肠镜检查确定患者肿瘤复发、转移情况及生存情况。
1.4 评价标准 比较两组治疗情况、术后疼痛评分、SDF-1/CXCR4的动态变化及预后情况。(1)两组治疗情况:包括手术出血量、住院时间、术后使用镇痛药物及进食时间。(2)两组术后疼痛评分:采用视觉模拟评分法进行评估,采用0~10分评价疼痛程度,分数越高疼痛越剧烈。(3)两组外周血SDF-1/CXCR4的动态变化:分别于术前、术后第3天取患者空腹静脉血3 mL,用BCA试剂盒测定蛋白含量,并以10 μg为上样量进行SDS-PAGE凝胶电泳,将不同相对分子质量的蛋白分离为清晰条带,转印至NC膜。5%的脱脂牛奶封闭90 min,进行一抗孵育SDF-1、CXCR4及GAPDH的抗体稀释浓度分别为 1∶1500、1∶1000、1∶2500,4℃ 孵育过夜。 清洗,进行二抗孵育,SDF-1、CXCR4及GAPDH的抗体稀释浓度均为1∶1500,暗室显影。(4)两组预后:包括术后肝癌转移、复发情况及术后一年生存率,于术后定期复查项目包括甲胎蛋白、癌胚抗原、肝功能指标等,数值异常者进行肝脏强化CT检查,新发癌灶与手术切缘相连或位于肝脏其他部位均为肝癌复发,出现在肝外视为肝癌转移。
1.5 统计学处理 采用SPSS 18.0软件进行数据分析,计数资料以率表示,采用χ2检验,计量资料以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗情况的比较 腹腔镜组手术出血量、住院时间、术后使用镇痛药物、进食时间均优于开腹组,差异有统计学意义(P<0.05)。见表2。
2.2 两组术后疼痛情况 术后第1天、第3天,腹腔镜组疼痛评分较术前升高;术后第1天、第3天、第5天、第7天,开腹组疼痛评分较术前升高(P<0.05),腹腔镜组疼痛评分均低于开腹组,差异有统计学意义(P<0.05)。见表3。
2.3 两组外周血SDF-1、CXCR4的动态变化 术后,两组SDF-1、CXCR4均低于术前,差异有统计学意义(P<0.05),其中腹腔镜组低于开腹组,差异有统计学意义(P<0.05)。见表4。
表2 两组治疗情况的比较(±s)
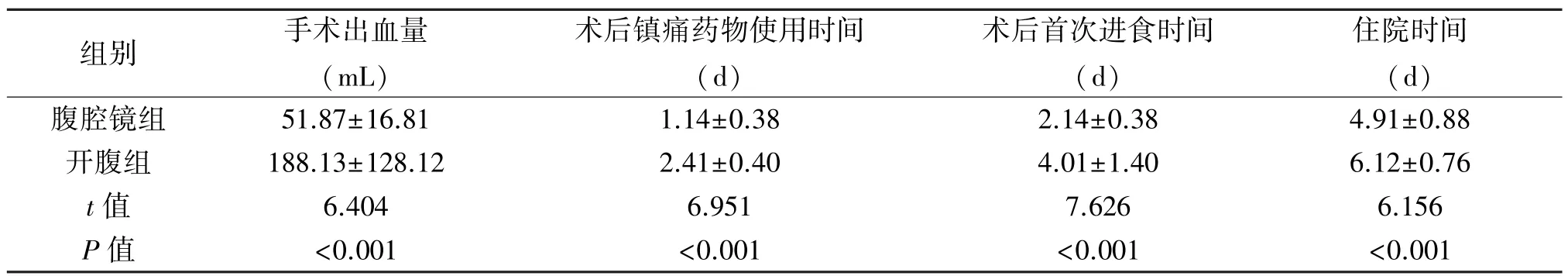
表2 两组治疗情况的比较(±s)
手术出血量 术后镇组别 (mL)痛药物使用时间(d)术后首次进食时间(d)住院时间(d)腹腔镜组 51.87±16.81 1.14±0.38 2.14±0.38 4.91±0.88开腹组 188.13±128.12 2.41±0.40 4.01±1.40 6.12±0.76 t值 6.404 6.951 7.626 6.156 P 值 <0.001 <0.001 <0.001 <0.001
表3 两组患者术后疼痛情况的比较[(±s),分]

表3 两组患者术后疼痛情况的比较[(±s),分]
∗P<0.05 vs.术前 1 d
组别 术前1 d 术后第1天 术后第3天 术后第5天 术后第7天腹腔镜组 1.52±0.60 2.32±0.60∗ 2.09±0.71∗ 1.92±0.87 1.73±0.66开腹组 1.48±0.72 3.19±0.81∗ 2.90±0.86∗ 2.72±0.78∗ 2.29±0.82∗t值 0.252 5.106 4.297 4.051 3.147 P值 0.801 <0.001 <0.001 <0.001 0.002
表4 两组患者外周血SDF-1、CXCR4动态变化的比较[(±s),分]

表4 两组患者外周血SDF-1、CXCR4动态变化的比较[(±s),分]
组别 SDF-1 CXCR4术前 术后 P值 术前 术后 P值腹腔镜组 0.97±0.10 0.34±0.08 <0.001 0.78±0.08 0.06±0.02 <0.001开腹组 0.98±0.12 0.56±0.05 <0.001 0.81±0.07 0.16±0.11 <0.001 t值 0.379 13.796 1.670 5.292 P值 0.706 <0.001 0.100 <0.001
2.4 两组预后情况的比较 两组肝癌转移、复发、1年死亡率差异无统计学意义(P>0.05)。见表5。
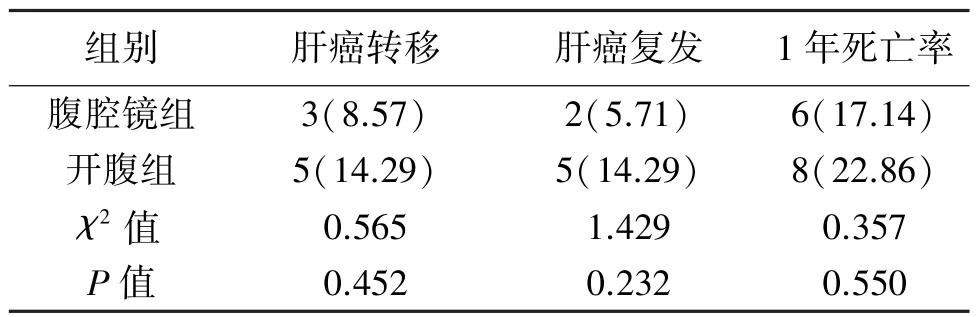
表5 两组患者预后情况的比较[n(%)]
3 讨 论
原发性肝癌经过手术切除后,术后3年复发率高于50%,直接影响肝癌患者的远期疗效[7]。复发性肝癌的治疗方法有多种,如再手术切除、经皮穿刺肿瘤内无水酒精注射、射频治疗、氩氦刀冷冻治疗等,其中常用的还是手术切除[8]。肝癌再手术切除尤其面对复发灶的再手术,机体对手术的耐受力有限,加大了手术难度与风险。近年完全腹腔镜手术治疗复发性肝癌由于具有切口小、手术出血量少、利于术后康复等优点,得到了更多应用[9]。
目前,手术切除治疗肝癌已得到广泛认可,靳和平等[10]对比了开腹切除术与射频消融术治疗原发性肝癌的疗效,发现开腹切除术后患者康复较慢,对其免疫功能指标的影响较大。近年完全腹腔镜手术已广泛应用于临床,周兵等[11]比较了腹腔镜与开腹手术治疗小肝癌的疗效,发现腹腔镜组住院时间明显缩短,患者恢复速度加快,但随访5年后,两组生存率差异并无统计学意义,表明手术方式对患者预后的影响较小。张杰等[12]评价了完全腹腔镜手术治疗复发性肝癌的效果,发现完全腹腔镜手术可明显改善复发性肝癌患者的围手术期指标,降低住院费用。
本研究中,腹腔镜组手术出血量、住院时间、术后使用镇痛药物及进食时间均低于开腹组(P<0.05);术后第1天、第3天、第5天、第7天,开腹组疼痛评分均高于术前1 d,高于相同时点腹腔镜组(P<0.05),提示与开腹切除术相比,完全腹腔镜手术不仅可有效控制手术出血、缩短住院时间,还可减轻术后疼痛。完全腹腔镜手术优化了整个切除过程,原因为:(1)腹腔镜手术的第一步是建立气腹,气腹压力的升高会使肝癌粘连处的张力增大,更利于分离;(2)完全腹腔镜手术的术野较大,利于分离粘连,对于部分非手术区的粘连,也可通过器械避开;(3)通过LigaSure电凝止血、其他直线切割闭合器的辅助,可进一步减少手术出血;(4)手术切口小,手术风险明显降低,减轻了患者恢复期的痛苦。完全腹腔镜手术也存在一定局限,主要在于:(1)不易控制术中出血情况,如肝癌伴肝硬化患者,术中易渗血,如不能及时控制会影响手术效果;(2)不适于体积较大的肝癌切除,因为完全腹腔镜的技术限制,发展较缓慢,在腔镜下切割肝实质、阻断肝门等基本操作较困难;(3)不适于病灶位置深、多发、合并多脏器功能不全的患者。术前应对患者的病史、体质、病灶进行严格评估,谨慎选择手术方案;术中评估肿瘤情况,利用超声刀判断肿瘤与四周血管的情况,减少手术出血,提高手术安全性;此外,腔镜手术可探查肿瘤周围、肝胆血管的行径及关系,对肝切除具有一定的指导作用。
SDF-1最初发现于小鼠骨髓基质细胞分泌的细胞因子,后经证实主要由基质细胞分泌[13]。目前,发现的SDF-1受体主要有CXCR4、CXCR7两种,因CXCR7发现较晚,医学界对SDF-1/CXCR7生物轴的认识尚处于初期阶段,SDF-1/CXCR4轴则已被证实参与了多种肿瘤的病灶转移过程[14]。孙小英等[15]的研究建立了结直肠癌肝脏转移瘤的裸鼠模型,发现SDF-1及其受体CXCR4可能参与了结肠癌肝转移过程,其机制可能与SDF-1诱导细胞增殖及定向迁移有关。陈民佳等[16]的研究发现低浓度H2O2通过活化干细胞SDF-1/CXCR4信号轴,活化其下游PI3K/AKT/mTOR信号通路,促进干细胞增殖与迁移。因此,SDF-1/CXCR4信号轴与癌细胞的增殖、转移均有一定联系。本研究中,两组SDF-1、CXCR4均低于术前水平,腹腔镜组术后SDF-1、CXCR4水平低于开腹组(P<0.05),提示手术切除肝癌病灶后,肿瘤细胞转移、侵袭能力均出现降低;而完全腹腔镜手术可进一步减弱术后癌细胞增殖与转移的危险性,与既往研究结论相似[17-18]。手术结束后,两组肝癌转移、复发、1年死亡率差异无统计学意义(P>0.05),推测可能由于肝癌本身转移率与复发率较高,经过再切除也不能完全根除病灶,因此降低肝癌患者复发率、提高远期疗效的方法仍需进一步研究。
综上所述,相较开腹切除术,完全腹腔镜手术治疗复发性肝癌在手术出血量、住院时间、术后疼痛方面优于开腹切除术,同时可更快地降低患者体内外周血SDF-1/CXCR4水平,治疗有效率较高。
