吉西他滨与厄洛替尼联合治疗胰腺癌的试验研究
2020-10-25张强秦爱玉秦玉刚
张强,秦爱玉,秦玉刚
胰腺癌是消化系统肿瘤的一种,具有早期难发现,发病预后差,治疗难度大等特点[1]。近年来胰腺癌呈现出病发群体年轻化、发病死亡率上升的趋势,故寻找更好的治疗方案引起广泛的关注[2]。尽管通过手术切除可以根治胰腺癌,但由于病人确诊时多为晚期使得术后存活率大大降低。吉西他滨是一种细胞周期特异性的DNA合成和修复抑制剂,是延长晚期胰腺癌病人生存时间的最佳化疗药物[3-4]。胰腺癌细胞具有获得性或内在的耐药性特点,使得吉西他滨单独使用存在治疗失败后没有后续治疗方案的缺点,治疗效果并不理想。因此需要新型的其他治疗药物与它联合使用,在一定程度上达到增强抑癌作用,减少某些不良反应的效果[5-6]。厄洛替尼是一种可以抑制表皮生长因子受体信号通路转导的小分子抑制药,具有一定的抗肿瘤作用[7]。本研究于2018年4月至2019年4月探讨吉西他滨与厄洛替尼联合使用对体外胰腺癌细胞的药物联合作用,为胰腺癌的治疗提供依据。
1 材料与方法
1.1 药物与试剂吉西他滨(江苏豪森药业股份有限公司,批号160605)、厄洛替尼(上海罗氏制药有限公司,批号SH0039);胎牛血清(杭州四季青公司,批号 2016-0596);RPMI-1640(RPMI 是 Roswell Park Memorial Institute 的缩写,代指洛斯维·帕克纪念研究所。RPMI 是该研究所研发的一类细胞培养基,1640 是培养基代号。)培养基(Gibco 公司,美国,批号AAXR0596);八肽胆囊收缩素-8(Cholecystokinin octapeptide-8,CCK-8)试剂盒(上海碧云天生物技术研究所,批号2018-11A1058);胰蛋白酶(上海碧云天生物技术研究所,批号2018-06A0012);Annexin V-FITC 细胞凋亡检测试剂盒(南京凯基生物发展有限公司,批号NJ180023)。
1.2 细胞培养人胰腺癌细胞系购自中国医学科学院基础医学研究所。在温度为37℃、二氧化碳含量为5%的细胞培养箱中用含有10%的胎牛血清的RPMI1640 培养液培养人胰腺癌细胞系。细胞单层贴壁生长,待细胞贴壁生长完全后用胰蛋白酶消化细胞,使其分散成单细胞悬液,进行传代培养。本研究所用胰腺癌细胞PANC-1(人胰腺癌细胞PANC-1)均为对数生长期细胞(目前无资料认为胰腺癌细胞株PANC-1 在RPMI1640 培养基中培养是会影响PANC-1的活性)。
1.3 PANC-1细胞形态学观察用0.25%胰蛋白酶将处于对数生长期的PANC-1细胞制备成单细胞悬液,用6 孔板培养细胞,每孔以1.0×103量接种细胞并补充培养液至每孔2 mL,每两天更换一次培养液。加入厄洛替尼 1.5 mg 分别作用24、48、72 h 后,在倒置显微镜下观察细胞形态改变,与对照组做比较(每个时间点设置12个培养皿)。
1.4 CCK-8细胞增殖-毒性检测用CCK-8法分别检测吉西他滨与厄洛替尼对Panc-1 细胞增殖的影响。用胰蛋白酶处理对数生长期的PANC-1 细胞,制成单细胞悬液,通过细胞计数将细胞悬液浓度调整为5×104/mL,以1×104/孔的细胞数量接种细胞到96孔板。将细胞培养板放入37 ℃、5%二氧化碳的细胞培养箱中,待细胞贴壁后,将原培养液换为含有不同浓度梯度吉西他滨(0,5,10,20,40,80,160 nM)和厄洛替尼(0,2,4,8,16,32,64,128 nM)的培养液,每个浓度设6 个重复孔,其中,药物浓度为0是对照组,另外给培养板留1 个孔只加入培养液作为调零孔。加药后将培养板放回细胞培养箱分别培养 24、48、72 h(注:每个时间点设置12 个培养皿。)。药物作用结束前1 h,向各孔加入10µL CCK-8,继续培养1 h。用酶标仪在450 nm波长下检测每个孔的吸光度(A)值,计算细胞抑制率,细胞抑制率=[1-(A实验组-A空白调零)/(A对照组-A空白调零)]×100%,绘制生长曲线。并计算出两种药物分别对PANC-1细胞的半抑制浓度(50% inhibiting concentration,IC50)。
1.5 Chou-Talalay 法进行药物联合分析我们根据两种药物对PANC-1的IC50值,按照不同比例(厄洛替尼:吉西他滨=1:2、1:1、2:1、3:1)和不同处理时间(24、48、72 h)重复观察两种药物联合使用对PANC-1 细胞的细胞毒性情况,以Chou-Talalay 法分析两种药物的联合作用效果。我们收集所有实验的结果,并获得每个数据点的平均值,用组合指数CI 来反映两种药物之间的作用:CI<1 表示协同作用,CI>1分别表示拮抗作用。
1.6 细胞平板克隆实验实验分组:厄洛替尼组、吉西他滨组、联合作用组(1:2、1:1、2:1、3:1),每组设12 个培养皿。用0.25%胰蛋白酶将处于对数生长期的PANC-1 细胞制备成单细胞悬液,用6 孔板培养细胞,每孔以1.0×103量接种细胞并补充培养液至每孔2 mL,每组设置3 个复孔。将细胞分散均匀后,放入37 ℃、5%二氧化碳的细胞培养箱中培养1~3 周。每天固定时间拿出6 孔板在显微镜下观察细胞状态,当出现肉眼可见的克隆时,终止培养,弃去上清液,用PBS 冲洗3 次左右,加入4%多聚甲醛固定15 min。用结晶紫染色液对细胞染色后,漂洗,空气干燥。在倒置显微镜低倍镜下,观察细胞形态,并计数各孔细胞克隆形成数,最后计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。
1.7 统计学方法采用SPSS 20.0统计分析软件进行处理。计量资料采用±s表示,组间比较采用单因素方差分析,不同时间点比较行重复测量方差分析,组间两两比较采用LSD-t检验,组内两两比较采用差值t检验。计数资料采用例(%)表示,组间比较采用χ2分析,多组之间两两比较采用P值修正的方法。P<0.05表示差异有统计学意义。
2 结果
2.1 PANC-1 细胞形态用厄洛替尼处理后,正常细胞数量减少,细胞收缩,细胞间距离变大,细胞培养液中出现细胞碎片。随着厄洛替尼作用时间的延长,细胞变化更加明显(见图1)。
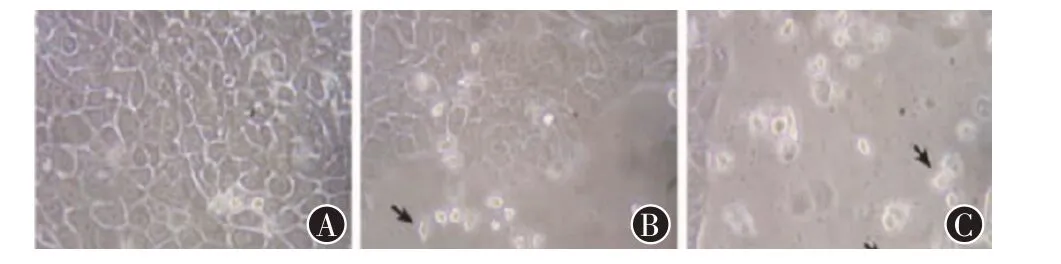
图1 倒置显微镜下观察厄洛替尼处理后胰腺癌PANC-1细胞变化:A为24 h,B为48 h,C为72 h
2.2 细胞毒性试验结果CCK-8试验结果显示:在给予系列浓度的厄洛替尼和吉西他滨培养液培养胰腺癌PANC-1细胞后,在一定时间内,不同浓度的吉西他滨和厄洛替尼均能抑制PANC-1 细胞增殖,并且抑制作用随浓度增加而增强,且一定浓度下,药物处理时间越长,抑制作用越强[128 nM 厄洛替尼浓度72 h 细胞抑制率为(76.72±5.51)%;320 nM吉西他滨浓度72 h 细胞抑制率为(75.43±0.97)%]。各浓度组与对照组相比,均差异有统计学意义(P<0.05)。结果说明,吉西他滨和厄洛替尼对胰腺癌PANC-1 细胞生长的影响具有时间-浓度依赖性。通过IC50 计算软件计算药物处理48 h 时的IC50值,结果显示厄洛替尼对PANC-1 的IC50 值为12 nM,吉西他滨对 PANC-1 的 IC50 值为 80 nM。(见表1,2)。
表1 厄洛替尼对12例PANC-1细胞的抑制率比较/(%,±s)

表1 厄洛替尼对12例PANC-1细胞的抑制率比较/(%,±s)
注:球型性校P>0.05,分析选取主体内效应检验,无需校正。显著性标记a、b、c、d、e 分别为和A、B、C、D、E 组同时点相比P<0.05。时间精细比较显著性标记X,Y为和组内第1、2时间点比较,P<0.05。结果说明:同一时间点24 h,不同浓度其细胞抑制率均不同。同一浓度不同时间点,浓度2、4、8、32三个时间点均差异有统计学意义。浓度16,浓度64和浓度128三个浓度组,48 h和72 h比较差异无统计学意义,其余均差异有统计学意义
厄洛替尼浓度2 nM 4 nM 8 nM 16 nM 32 nM 64 nM 128 nM球形检验χ2/P值组间差异(药物浓度)F/P值主体内效应(时间点)F/P值交互效应F/P值细胞抑制率24 h 13.28±7.04 25.75±3.58a 35.34±2.85ab 46.61±2.61abc 55.53±1.47abcd 69.45±4.98abcde 77.38±4.26abcdef 0.14,0.931 1 173.64,0.000 386.48,0.000 6.85,0.000 48 h 46.19±21.95x 26.64±3.78x 30.72±1.05abx 40.71±5.38abcx 61.11±4.89abcdtx 69.41±1.65abcdex 78.89±4.86abcdefx 72 h 89.23±3.53x,y 56.68±23.02xy 32.65±2.68abxy 37.03±5.84abcx 56.19±2.78abcdxy 63.57±2.10abcdx 76.72±5.51abcdefx
2.3 药物联合试验结果根据厄洛替尼与吉西他滨对PANC-1 的IC50 值,分别按照不同比例重复观察两种药物联合使用对细胞的细胞毒性情况。
不同组合药物对PANC-1 细胞的抑制率:整体比较(两因素重复测量方差分析)知:组间差异、时间差异及交互作用均差异有统计学意义(P<0.05)。两两精细比较并结合主要数据分析:厄洛替尼和吉西他滨联合使用可以增大细胞抑制率,减少单独使用吉西他滨的起效时间[厄洛替尼∶吉西他滨为3∶1是时,72 h 细胞抑制率为(89.89±1.56)%,IC50 值为(3.89±1.65)nmol/L]。详见表3,4。
表2 吉西他滨对12例PANC-1细胞的抑制率比较/(%,±s)

表2 吉西他滨对12例PANC-1细胞的抑制率比较/(%,±s)
注:球型性校P>0.05,分析选取主体内效应检验,无需校正。显著性标记a、b、c、d、e 分别为和A、B、C、D、E 组同时点相比P<0.05。时间精细比较显著性标记X,Y 为和组内第1、2时间点比较,P<0.05。结果说明:同一时间点24 h,浓度5和浓度10浓度10和浓度20,浓度20和浓度40,浓度40和浓度80,结果比较差异无统计学意义,其余各组比较均差异有统计学意义。同一浓度不同时间点,浓度5、10,24 h和48 h比较差异无统计学意义,其余浓度组三个时间点比较均差异有统计学意义
吉西他滨浓度5 nM 10 nM 20 nM 40 nM 80 nM 160 nM 320 nM球形检验χ2,P值组间差异(药物浓度)F,P值主体内效应(时间点)F,P值交互效应F,P值细胞抑制率24 h 9.33±4.15 14.39±9.21 20.39±6.14a 25.96±6.11ab 32.43±2.85abc 47.08±7.52abcde 58.92±2.11abcdef 1.45,0.458 530.13,0.000 472.85,0.000 11.53,0.000 48 h 11.07±4.16 18.63±2.21a 26.5±8.22abx 35.39±3.52abcx 49.04±10.06abcx 55.69±2.35abcdex 68.25±4.95abcdefx 72 h 37.80±20.13XY 17.08±1.79aXY 27.73±5.36abxy 43.07±3.17abcxy 51.86±3.78abcdxy 64.46±3.23abcdexy 75.43±0.97abcdefxy
2.4 Chou-Talalay 法分析吉西他滨与厄诺替尼的联合作用效果采用Chou-Talalay 法分析吉西他滨与厄诺替尼的联合指数CI,在不同的联合给药方案中,2∶1 组和3∶1 组处理 24、48、72 h 均表现出协同作用,尤其是48 h,从细胞生长抑制率CI 图中可以看出,随着细胞生长抑制率的增加,CI 值逐渐下降。当细胞生长抑制率达到35%时,联合效应开始出现协同作用(小于0.9)。当细胞生长抑制率为40%时,CI 下降(均小于0.5),具有的协同作用。同时,2∶1组曲线低于3∶1组曲线,说明厄洛替尼和吉西他滨浓度比为2∶1 的协同效应优于浓度比3∶1(图2,表5)。
表3 不同组合药物对12例PANC-1细胞的抑制率比较/(%,±s)

表3 不同组合药物对12例PANC-1细胞的抑制率比较/(%,±s)
注:整体分析为两因素重复测量方差分析,资料球型性校正采用HF 系数法。组间精细比较为LSD-t 检验,显著性标记a、b、c、d、e分别为和A、B、C、D、E 组同时点相比P<0.05。时间精细比较为差值t检验,与组内第1时间点比较fP<0.05
药物组合(厄洛替尼:吉西他滨)A→1∶0 B→0∶1 C→1∶2 D→1∶1 E→2∶1 F→3∶1整体分析组间F,P值时间F,P值交互F,P值细胞抑制率24 h 43.89±3.00 64.42±4.99a 50.60±6.05ab 67.34±4.20ac 63.87±2.94acd 81.97±4.21abcde(HF系数:0.829 5)344.191,0.000 79.761,0.000 16.391,0.000 48 h 33.17±4.28t 78.20±4.29at 49.52±8.40ab 85.54±8.43abct 63.45±3.96abcd 91.61±3.96abcdet 72 h 53.29±5.08t 80.13±5.34at 59.52±8.34abt 82.22±3.14act 70.54±3.77abcdt 89.89±1.56abcdet

图2 不同组合药物处理24 h时的细胞抑制率CI图
2.5 细胞平板克隆形成实验结果每组接入1 000个细胞,3周后平板克隆形成实验结果为:对照组细胞数为361;单独加厄洛替尼组细胞数为128;单独加吉西他滨组细胞数为114,联合作用组细胞数为118、98、76、80。结果表明,加入药物后细胞克隆形成率下降,且两种药物联合干预PANC-1 细胞导致细胞克隆形成数低于单独使用吉西他滨或厄洛替尼干预,其细胞克隆形成率也下降(P<0.05),见表6。
表4 不同组合药物处理下PANC-1细胞的IC50值/(nmol/L,±s)

表4 不同组合药物处理下PANC-1细胞的IC50值/(nmol/L,±s)
药物作用时间24 h 48 h 72 h整体分析组间 F,P 值时间 F,P 值交互 F,P 值单独给药厄洛替尼25.71±1.27 12.36±2.05 6.63±1.41(HF系数:0.683 9)290.526,0.000 136.472,0.000 19.201,0.000吉西他滨206.28±2.01 80.59±1.02 35.31±0.93(HF系数:0.715 2)292.153,0.000 115.866,0.000 7.129,0.000联合给药(厄洛替尼∶吉西他滨)1∶2 27.36±2.16 12.03±1.72 6.52±3.11 1∶1 26.58±2.63 10.47±2.18 5.84±1.68 2∶1 20.53±3.18 7.54±2.39 4.41±2.06 3∶1 18.28±2.14 5.51±1.93 3.89±1.65
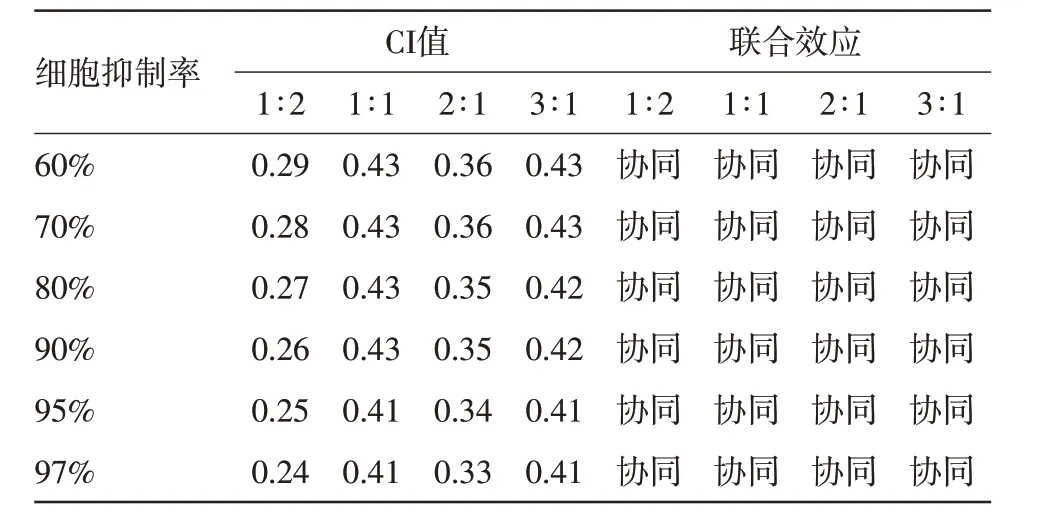
表5 不同组合药物处理48 h时的CI值

表6 不同组合药物处理下PANC细胞克隆形成情况
3 讨论
近年来,随着生活环境和生活方式的改变,胰腺癌发病率也逐渐上升,并伴随着发群体年轻化、发病死亡率升高等特征[8-9]。胰腺癌细胞中表皮生长因子受体过度表达,这对肿瘤细胞的增殖起到促进作用,导致胰腺癌预后性差[10]。其发病初期症状不明显,使得多数病人错失了最佳手术时间[11]。只能通过后期治疗来提高生存的概率,延长生存时间[12]。治疗晚期胰腺癌最有常用的方法是使用化疗药物[13]。吉西他滨单药是目前晚期胰腺癌的标准治疗药物,具有一定的临床收益率和客观缓解率。胰腺癌已经获得了对吉西他滨的抵抗力,使得这种治疗方法受到耐受性的限制,且治疗失败后存在缺失后续有效治疗方案的缺点[14-15]。因此,研发新型药物或者寻找合适药物与吉西他滨协同作用对胰腺癌的治疗极为重要。但是在大规模随机临床试验中发现多种以吉他西滨为基础的联合化疗方案都未能显示出比吉西他滨单药有更好的生存获益[16-17]。厄洛替尼是一种新型抗肿瘤药物,它与三磷酸腺苷存在竞争关系,可以抑制在癌组织中表达率很高的人表皮生长因子受体络氨酸激酶活性,抑制磷酸化反应,从而阻滞下游信号传导,达到抑制癌细胞增殖作用[18]。厄洛替尼在治疗非小细胞肺癌中发挥作用,在其他肿瘤疾病治疗中也能起到促进作用[19-20]。本研究通过比较吉西他滨与厄洛替尼的单独使用与联合使用对体外胰腺癌细胞生长影响,来初步探讨两种药物的联合作用效果。
在PANC-1 细胞形态观察实验中,用厄洛替尼处理细胞,并观察不同时间处理下细胞形态改变。正常的胰腺癌细胞在离体培养条件下贴壁生长活跃、细胞数量较多,且个体饱满,轮廓清晰。而加药处理后,细胞出现皱缩现象,细胞间隙变大,数量减少。随着处理时间的延长,细胞的生长状态与正常贴壁生长差别更明显。这说明厄洛替尼起到了抑制细胞生长的作用,且抑制效果与作用时间相关。
在细胞毒性试验中,用不同浓度的吉西他滨和厄洛替尼培养液培养胰腺癌PANC-1 细胞,细胞抑制率均较对照组高,表明吉西他滨和厄洛替尼都可以抑制胰腺癌细胞的增殖。控制处理时间不变,随着药物浓度的增加,细胞抑制率也增大。控制药物浓度不变,随着药物处理时间的延长,细胞抑制率也增大。这表明一定条件下,吉西他滨和厄洛替尼对癌细胞生长的影响具有时间-浓度依赖性。
在药物联合分析实验中,厄洛替尼和吉西他滨联合使用可以增大细胞抑制率,减少单独使用吉西他滨的起效时间,降低IC50 值。采用Chou-Talalay法分析吉西他滨与厄诺替尼的联合指数CI,在细胞抑制率达到一定数值后,联合指数小于1,吉西他滨与厄诺替尼发挥协同作用。这为胰腺癌细胞对吉他西滨产生耐药性提供了新的解决思路,可以通过厄洛替尼的协同作用来减少吉西他滨的使用量,使得吉西他滨作用失败后还可以继续采取其他补救措施。
在细胞平板克隆实验中,接入相同数量细胞,药物处理一段时间后,药物联合作用组比单独加厄洛替尼或吉西他滨组的细胞克隆数量减少,细胞克隆形成率下降,这表明两种药物联合对用对PANC-1 细胞的生长影响作用较大,联合使用两种药物对体外胰腺癌细胞增殖的抑制更有效。
综上所述,吉西他滨和厄洛替尼单独使用均能在体外抑制人胰腺癌细胞的生长,发挥抑制胰腺癌肿瘤的作用。吉西他滨和厄洛替尼联合使用可以降低两种药物的使用剂量并起到药物的协同作用,达到并提高抑制体外胰腺癌细胞增殖的效果。尽管厄洛替尼与吉西他滨联合治疗胰腺癌有一定功效,但其疗效是否伴有严重不良反应仍需被考虑。
