微小RNA-25-3p 靶向下调甘油磷酸二酯酶磷酸结构域5 基因对乳腺癌细胞顺铂耐药性的影响
2020-10-25缪玖麟王建荣徐志敏邱卫明陈保华李新建
缪玖麟,王建荣,徐志敏,邱卫明,陈保华,李新建
乳腺癌是一种常见的癌症,是世界范围内女性癌症相关死亡的主要原因[1]。顺铂作为一种高效广谱的抗癌药物,其通过与DNA 交联,阻断DNA 复制和转录,诱导肿瘤细胞凋亡,在乳腺癌的临床化疗中发挥着重要作用[2]。然而,随着顺铂在临床化疗中的长期重复使用,将不可避免地引起乳腺癌细胞对顺铂产生耐药性[3]。近年来的研究表明,微小RNA(miRNA)的异常表达与肿瘤细胞的顺铂耐药有关。如上调微小RNA-192(miR-192)[4]、微小RNA-34a(miR-34a)[5]或下调微小 RNA-19a(miR-19a)[6]可提高肿瘤细胞的顺铂敏感性,逆转肿瘤细胞对顺铂的耐药性。微小RNA-25-3p(miR-25-3p)是微小RNA-106b(miR-106b)家族中的一员,研究发现,miR-25-3p通过靶向信号素4C(Sema4C)可增加宫颈癌细胞对顺铂的敏感性[7]。甘油磷酸二酯酶磷酸结构域 5(GDPD5)位于 11q13.5 位置,研究发现,GDPD5 除具有渗透调节甘油磷酸胆碱的生理作用外,其还是乳腺癌肿瘤发生的阳性调控因子[8-9]。此外,有研究报道,沉默GDPD5 可增加结直肠癌细胞的顺铂敏感性[10]。因此,2018 年 10 月至 2019 年 6月,本研究通过检测乳腺癌顺铂耐药(MCF-7/DDP)细胞中miR-25-3p和GDPD5的变化,探讨miR-25-3p及GDPD5调控乳腺癌细胞顺铂耐药的机制。
1 材料与方法
1.1 实验材料DMEM培养基和胎牛血清,Hyclone公司;LipofectamineTM2000相关转染试剂和TRIzol试剂,Invitrogen公司;顺铂(DDP),齐鲁制药有限公司;四甲基偶氮唑盐比色(MTT)和二甲基亚砜(DMSO试剂),Sigma公司;蛋白质印迹法相关试剂,上海碧云天公司;引物、miR-25-3p过表达载体(miR-25-3p mimics)、miR-25-3p过表达空载体(miR-con)、GDPD5过表达载体(pcDNA-GDPD5)、GDPD5 过表达载体(pcDNA-con)、miR-25-3p抑制表达空载体(anti-miR-con)、miR-25-3p 抑制表达载体(anti-miR-25-3p)、GDPD5 野生型荧光素酶报告载体(WT-GDPD5)和GDPD5突变型荧光素酶报告载体(MUT-GDPD5)的构建和测序,北京华大基因有限公司;β-actin抗体,Santa Cruz公司;甘油磷酸二酯酶磷酸结构域5(GDPD5)、谷胱甘肽巯基转移酶π(GST-π)、细胞周期蛋白D1(Cyclin D1)抗体和HRP标记的Ⅱ抗,Abcam公司。
1.2 细胞培养和转染人乳腺癌细胞MCF-7 和乳腺癌顺铂耐药细胞MCF-7/DDP 购于中国科学院上海细胞研究所,分别培养于含有10%胎牛血清的DMEM培养基中,培养条件为37 ℃、湿度饱和、二氧化碳体积分数为5%的细胞培养箱。miR-25-3p 过表达载体的转染:取对数生长期的MCF-7/DDP细胞按照每孔2×105细胞接种于6 孔板,当细胞生长至50%~60%时,利用LipofectamineTM2000 进行转染。设为NC组(正常培养的MCF-7/DDP细胞)、miR-con组(转染miR-con)和miR-25-3p 组(转染miR-25-3p mimics)。转染48 h后,检测转染效率并进行后续实验分析。同时设置DDP干预组,用不同终浓度DDP(60、120、240、480、960 µmol/mL)处理各组细胞24 h后,检测各组细胞的生长抑制率。
为进一步验证miR-25-3p通过调控GDPD5表达影响MCF-7/DDP细胞的增殖和对顺铂的耐药性,将miR-25-3p mimics 和 pcDNA-GDPD5 同时转入 MCF-7/DDP 细胞,检测MCF-7/DDP 细胞的增殖情况。实验分为miR-25-3p+pcDNA-con组(miR-25-3p mimics和pcDNA-con共转染)和miR-25-3p+pcDNA-GDPD5组(miR-25-3p mimics 和pcDNA-GDPD5 共转染)。同时设置DDP干预组,方法同上。
1.3 qRT-PCR 检测利用TRIzol 试剂分别提取MCF-7、MCF-7/DDP 和各转染组细胞的总RNA,检测其浓度后,取适量RNA将其逆转录为cDNA,采用SYBR Green real-time PCR 方法检测 miR-25-3p(以U6为参照)、GDPD5 mRNA和GST-π mRNA(以β-actin为参照)的表达,按照2-ΔΔCt法计算其相对表达量。
1.4 双荧光素酶报告基因检测TargetScan软件预测显示,miR-25-3p 与GDPD5 存在部分特异性结合位点,GDPD5可能是miR-25-3p的潜在靶基因,并利用双荧光素酶报告基因实验进行验证。构建野生型 WT-GDPD5 和突变型 MUT-GDPD5 的 GDPD5-3’UTR 荧光素酶报告基因载体,利用LipofectamineTM2000 将 miR-25-3p mimics 和 miR-con 分 别 与 WTGDPD5 或 MUT-GDPD5 转染到 MCF-7/DDP 细胞,细胞培养箱常规培养48 h后,检测各组MCF-7/DDP细胞的荧光素酶活性。
1.5 MTT法检测细胞活力取生长良好的MCF-7/DDP细胞和各转染组MCF-7/DDP细胞,按照每孔2×103细胞接种于96孔板中,培养24 h后,更换细胞培养液为含DDP 的培养液(DDP 终浓度分别为60、120、240、480、960 µmol/mL),另分别设置不加DDP组。继续培养24 h后,每孔加入MTT溶液15µL,培养箱孵育4 h后,弃去各孔内的细胞培养液,再向每孔加入150µL的DMSO,继续孵育2 h后,490 nm处用酶标仪测定各孔的吸光度值,并计算细胞存活率或细胞抑制率。
1.6 蛋白质印迹法(Western Blot)检测消化收集各组细胞,用适量的RIPA 裂解液于冰上裂解30 min,12 000 r/min 离心 30 min 收集细胞蛋白,用BCA 试剂盒测定蛋白浓度,并将各组蛋白稀释至相等浓度。经过SDS-PAGE 电泳,常规湿法转膜,5%脱脂牛奶室温封闭2 h,稀释的抗GDPD5、CyclinD1 和 GST-π 蛋白的Ⅰ抗室温孵育 2 h,洗膜后稀释的Ⅱ抗孵育2 h,用ECL 试剂盒于暗处显影,并利用Bio-Rad 凝胶成像系统获取图像,分析目的条带的灰度值。
1.7 统计学方法采用SPSS 22.0软件进行数据处理和分析,所有数据均用±s 表示,两组间比较采用t检验,多组间比较进行单因素方差分析,总体有差异进一步采用LSD-t检验进行两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-25-3p、GDPD5 和GST-π 在正常乳腺细胞、乳腺癌细胞和乳腺癌顺铂耐药细胞中的表达图1和表1显示,与MCF-7细胞相比,MCF-7/DDP细胞miR-25-3p 的表达显著下调,GDPD5 mRNA、GDPD5蛋白、GST-π mRNA 和GST-π 蛋白的表达均显著上调(P<0.05)。提示,miR-25-3p、GDPD5 和GST-π 的异常表达可能与乳腺癌细胞的顺铂耐药有关。

图1 蛋白质印迹法检测GDPD5、GST-π蛋白的表达量
2.2 miR-25-3p过表达对MCF-7/DDP细胞增殖的影响图2和表2显示,与miR-con 组相比,miR-25-3p 组 MCF-7/DDP 细胞 miR-25-3p 的表达显著升高,表明成功构建了过表达miR-25-3p的MCF-7/DDP细胞株。与miR-con组比较,miR-25-3p组MCF-7/DDP细胞CyclinD1 和GST-π 蛋白的表达显著降低,细胞存活率显著降低(P<0.05)。表明,过表达miR-25-3p可抑制MCF-7/DDP细胞增殖。
表1 用qRT-PCR检测GDPD5 mRNA的表达,蛋白质印迹法检测GDPD5、GST-π蛋白的表达量/±s

表1 用qRT-PCR检测GDPD5 mRNA的表达,蛋白质印迹法检测GDPD5、GST-π蛋白的表达量/±s
注:MCF-7为乳腺癌细胞,MCF-7/DDP为乳腺癌顺铂耐药性细胞,miR-25-3p为微小RNA-25-3p,GDPD5 mRNA为甘油磷酸二酯酶磷酸结构域5mRNA,GST-π mRNA为胎盘型谷胱甘肽巯基转移酶π mRNA,GDPD5 protein为甘油磷酸二酯酶磷酸结构域5蛋白,GST-π protein为胎盘型谷胱甘肽巯基转移酶π蛋白
细胞MCF-7 MCF-7/DDP t 值P 值重复次数99 miR-25-3p 1.00±0.10 0.26±0.03 12.348 0.000 GDPD5 mRNA 1.02±0.16 2.89±0.29 12.500 0.000 GST-πmRNA 1.02±0.10 2.12±0.20 14.758 0.000 GDPD5 protein 0.95±0.10 1.50±0.16 8.745 0.000 GST-πprotein 0.41±0.06 1.15±0.11 17.718 0.000

图2 蛋白质印迹法检测CyclinD1和GST-π蛋白的表达
表2 miR-25-3p过表达抑制MCF-7/DDP增殖/±s

表2 miR-25-3p过表达抑制MCF-7/DDP增殖/±s
注:NC为乳腺癌耐药细胞未做处理组;miR-con为空载体处理组;miR-25-3p为miR-25-3p过表达转染处理组;CyclinD1为G1/S-特异性周期蛋白-D1;GST-π为胎盘型谷胱甘肽巯基转移酶π。与miR-con组比较,at=18.596,15.740,16.877,12.005,P=0.000,0.000,0.000,0.000
组别NC miR-con miR-25-3p F 值P 值重复次数999 miR-25-3p 1.00±0.10 1.02±0.15 2.56±0.25a 227.634 0.000 CyclinD1 1.10±0.11 1.12±0.11 0.40±0.05a 170.023 0.000 GST-π 1.12±0.11 1.15±0.12 0.35±0.04a 197.584 0.000细胞存活率/%100.00±10.16 100.00±10.11 50.36±5.04a 96.072 0.000
2.3 miR-25-3p过表达对MCF-7/DDP细胞顺铂的耐药性的影响表3 显示,与miR-con 组比较,miR-25-3p组MCF-7/DDP细胞的生长抑制率显著增加(P<0.05),且呈一定的剂量依赖性。这表明过表达miR-25-3p可提高MCF-7/DDP细胞对顺铂敏感性。
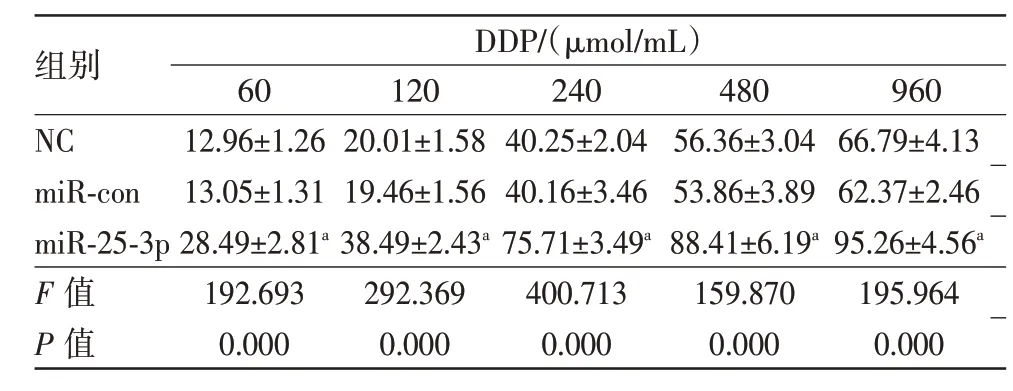
表3 miR-25-3p过表达联合不同浓度DDP处理对MCF-7/DDP细胞的生长抑制率/(%,xˉ±s)
2.4 miR-25-3p 靶向调控GDPD5 的表达TargetScan 软件预测显示,见图 3A,miR-25-3p 和GDPD5 之间存在连续结合位点。表4 显示,当上调miR-25-3p表达后,转染GDPD5-WT的3’-UTR 报告基因的MCF-7/DDP 细胞的相对荧光素酶活性显著下降(P<0.05),而转染GDPD5-MUT 的3’-UTR 报告基因的MCF-7/DDP 细胞的相对荧光素酶活性无显著变化(P>0.05)。表5 显示,当上调miR-25-3p表达后,MCF-7/DDP细胞GDPD5蛋白的表达量显著降低;当下调 miR-25-3p 表达后,MCF-7/DDP 细胞GDPD5 蛋白的表达量显著升高(P<0.05)。以上结果提示,miR-25-3p可靶向负性调控GDPD5的表达。

图3 miR-25-3p靶向GDPD5,调控GDPD5表达:A为生物信息软件预测miR-25-3p与GDPD5靶向关系,B为蛋白质印迹法检测GDPD5蛋白表达量
表4 miR-con或miR-25-3p与报告质粒共转染MCF-7/DDP细胞后双荧光素酶活性检测/±s
注:miR-con为过表达空载体处理组,miR-25-3p为miR-25-3p过表达转染处理组,WT 为GDPD5 野生型报告质粒转染组,MUT 为GDPD5突变型报告质粒转染组
组别miR-con miR-25-3p t 值P 值重复次数99荧光素酶活性WT 1.01±0.11 0.35±0.05 16.387 0.000 MUT 1.03±0.11 1.00±0.10 0.605 0.553
2.5 过表达GDPD5 可以部分逆转miR-25-3p 对MCF-7/DDP细胞增殖和顺铂耐药性的影响图4、表 6 和表 7 显示,与 miR-con 组相比,miR-25-3p 组MCF-7/DDP 细胞 GDPD5、CyclinD1 和GST-π 蛋白的表达量显著降低,细胞存活率显著降低,MCF-7/DDP细胞对顺铂的耐药性显著降低;与miR-25-3p+pcDNA-con组相比,miR-25-3p+pcDNA-GDPD5组MCF-7/DDP 细胞 GDPD5、CyclinD1 和 GST-π 蛋白的表达量显著升高,细胞存活率显著升高,MCF-7/DDP细胞对顺铂的耐药性显著升高(P<0.05)。这表明miR-25-3p通过下调GDPD5的表达提高MCF-7/DDP细胞的顺铂敏感性。
表5 蛋白质印迹法检测GDPD5的表达/±s

表5 蛋白质印迹法检测GDPD5的表达/±s
注:GDPD5为为甘油磷酸二酯酶磷酸结构域5蛋白,miR-con为过表达空载体处理组,miR-25-3p 为转染过表达miR-25-3p 处理组,anti-miR-con为低表达空载体处理组,anti-miR-25-3p为miR-25-3p低表达转染组。与 miR-con 组比较,at=11.853,P=0.000,与 anti-miR-con组比较,bt=12.262,P=0.000
组别miR-con miR-25-3p anti-miR-con anti-miR-25-3p F 值P 值重复次数9999 GDPD5 1.00±0.10 0.42±0.05a 0.95±0.09 1.55±0.15b 178.135 0.000

图4 蛋白质印迹法检测GDPD5、CyclinD1和GST-π蛋白的表达
3 讨论
自从1978年顺铂首次被用于治疗睾丸癌以来,至今已有40余年。然而,由于顺铂在恶性肿瘤中的长期且重复使用,导致了严重的耐药性。肿瘤细胞对顺铂的耐药主要与以下几种机制有关[11]:谷胱甘肽(GSH)及其转移酶(GST-π)的过量表达对化疗药物的解毒作用;肿瘤细胞的凋亡途径异常;肿瘤细胞增加对胞内顺铂的泵出;减少进入肿瘤细胞内的顺铂量。最近的研究表明,调控miRNAs 的表达水平在一定程度上可提高顺铂抗性肿瘤细胞对顺铂的敏感性,增强顺铂的治疗效果[12-13]。
表6 过表达GDPD5可以部分逆转miR-25-3p对MCF-7/DDP细胞增殖的抑制作用/±s

表6 过表达GDPD5可以部分逆转miR-25-3p对MCF-7/DDP细胞增殖的抑制作用/±s
注:本试验重复9次,GDPD5为甘油磷酸二酯酶磷酸结构域5蛋白,GST-π 为胎盘型谷胱甘肽巯基转移酶π,CyclinD1 为G1/S-特异性周期蛋白-D1,miR-con为空载体处理组,miR-25-3p为过表达miR-25-3p转染组,miR-25-3p+pcDNA-con为过表达miR-25-3p和pcDNA-con 空载体共转染组,miR-25-3p+pcDNA-GDPD5 为 miR-25-3p 和GDPD5 过表达共转染组。与 miR-con 组比较,at=22.831,18.708,15.000,14.651,均 P<0.001,与 miR-25-3p+pcDNA-con 组比较,bt=17.231,13.096,12.400,10.470,均P<0.001
组别miR-con miR-25-3p miR-25-3p+pcDNA-con miR-25-3p+pcDNA-GDPD5 F 值P 值GDPD5 1.48±0.13 0.42±0.05a 0.45±0.05 1.25±0.13b 275.814 0.000 CyclinD1 1.10±0.11 0.40±0.05a 0.42±0.05 0.91±0.09b 177.274 0.000 GST-π 1.13±0.12 0.38±0.04a 0.40±0.13 1.02±0.11b 126.793 0.000细胞存活率/%100.00±10.01 48.24±4.82a 50.17±5.02 87.16±8.72b 109.677 0.000
miR-25-3p定位于人基因组7号染色体,是miR-106b-25 簇成员之一。有研究显示,miR-25-3p 在胶质瘤组织和细胞中呈高表达,且miR-25-3p 通过靶向FBXW7 和DKK3 促进胶质瘤细胞的增殖和迁移[14]。然而,miR-25-3p 在舌鳞癌组织和细胞中呈低表达,上调miR-25-3p 通过抑制cyclinD1、蛋白激酶B(AKT)、叉头转录因子O1(FOXO1)等蛋白表达,促进细胞周期蛋白依赖性激酶抑制剂1A(p21)和细胞周期蛋白依赖性激酶抑制剂1B(p27)蛋白表达,进而抑制肿瘤细胞增殖[15]。进一步研究发现,miR-25-3p 在顺铂耐药宫颈癌细胞中表达显著下调,上调miR-25-3p通过靶向Sema4C抑制顺铂耐药宫颈癌细胞异种移植瘤的生长,逆转宫颈癌顺铂耐药细胞的EMT 表型,增强对顺铂的敏感性[7]。胆碱磷脂代谢异常是肿瘤的一个新特征,与肿瘤的发生、发展密切相关[16]。最近的研究表明,GDPD5 在乳腺肿瘤细胞和恶性程度较高的雌激素受体阴性乳腺癌细胞中呈过表达,沉默GDPD5可改变乳腺癌模型体内磷脂代谢产物的分布[17]。同时,Cao 等[18]研究发现,沉默GDPD5 可抑制乳腺癌细胞的增殖、迁移和侵袭。此外,Feng 等[10]研究表明,miR-195-5p通过靶向下调GDPD5诱导结直肠癌细胞凋亡,增加结直肠癌细胞的化学敏感性。提示miR-25-3p和GDPD5与肿瘤细胞的耐药明显相关。
表7 各组细胞转染条件联合不同浓度DDP处理对MCF-7/DDP生长抑制率的影响/(%,±s)

表7 各组细胞转染条件联合不同浓度DDP处理对MCF-7/DDP生长抑制率的影响/(%,±s)
注:miR-con为空载体处理组,miR-25-3p为过表达miR-25-3p转染组,miR-25-3p+pcDNA-con为过表达miR-25-3p和pcDNA-con空载体共转染组,miR-25-3p+pcDNA-GDPD5 为miR-25-3p 和GDPD5 过表达共转染组;与miR-con 组比较,at=16.371,15.671,20.948,14.703,12.030,均P<0.001;与miR-25-3p+pcDNA-con组比较,bt=11.221,10.646,15.544,10.976,8.981,均P<0.001
组别miR-con miR-25-3p miR-25-3p+pcDNA-con miR-25-3p+pcDNA-GDPD5 F 值P 值重复次数9 9 9 9 DDP/(µmol/mL)60 12.46±1.21 26.13±2.06a 27.16±2.15 17.79±1.49b 140.980 0.000 120 18.56±1.53 36.18±3.01a 37.49±2.79 25.52±1.89b 128.647 0.000 240 38.25±2.61 72.13±3.89a 70.28±4.01 45.14±3.01b 228.429 0.000 480 50.35±3.88 85.26±5.26a 83.18±5.38 57.12±5.46b 112.862 0.000 960 63.79±4.96 93.26±6.01a 92.46±5.58 70.46±4.02b 76.082 0.000
本研究结果显示,MCF-7/DDP 细胞中miR-25-3p 的表达较对顺铂敏感的MCF-7 细胞显著下调,MCF-7/DDP 细胞中GDPD5 的表达较对顺铂敏感的MCF-7 细胞显著上调。GST-π 是药物代谢的功能酶,GST-π 可加速抗肿瘤药物的降解,增加肿瘤细胞的耐药性[19]。我们发现MCF-7/DDP 细胞中GST-π 的表达较MCF-7 细胞显著上调。提示miR-25-3p、GDPD5 和 GST-π 可能参与调控 MCF-7 细胞对顺铂的耐药。随后,我们用脂质体转染法上调miR-25-3p,发现过表达 miR-25-3p 可抑制 CyclinD1 和GST-π蛋白表达,抑制MCF-7/DDP细胞增殖,并提高MCF-7/DDP细胞对顺铂敏感性。TargetScan 在线预测显示,GDPD5 是miR-25-3p 的潜在靶基因。同时蛋白质印迹法和双荧光素酶实验显示,miR-25-3p 可靶向负性调控GDPD5 的表达。为了进一步证实miR-25-3p 通过靶向下调GDPD5 表达参与对MCF-7/DDP细胞顺铂敏感性的调控,进行回复实验,发现过表达GDPD5 可以部分逆转miR-25-3p 对MCF-7/DDP细胞增殖、CyclinD1 和 GST-π 蛋白表达的抑制作用,增强MCF-7/DDP 细胞对顺铂的耐药性。提示,miR-25-3p 通过靶向调控下调GDPD5 表达抑制细胞存活,进而降低MCF-7/DDP 细胞对顺铂的耐药性。
综上所述,miR-25-3p 通过靶向下调GDPD5 表达,降低MCF-7/DDP 细胞对顺铂的耐药性。上调miR-25-3p有望为顺铂耐药乳腺癌的治疗提供新的思路。
