血管生成样蛋白2在子宫内膜腺癌中的表达及作用研究
2020-10-20金纬纬蔡平生林一禾郑飞云
金纬纬 蔡平生 林一禾 郑飞云
子宫内膜腺癌是起源于女性子宫内膜上皮的恶性肿瘤[1]。近年来,随着人们生活水平的提高和饮食结构的改变,其发病率在世界范围内逐年增高。虽然目前手术及放化疗在子宫内膜腺癌的治疗中取得了良好效果,但是部分患者仍存在化疗毒性、肿瘤复发或放化疗耐受等问题[2]。因此,探究子宫内膜腺癌细胞全新的特异性治疗靶点迫在眉睫[3]。血管生成样蛋白2(angiopoietin-like protein 2,ANGPTL2)是抑制性人白细胞免疫球蛋白样受体家族重要成员。研究表明,ANGPTL2在肿瘤免疫反应[4]、肿瘤细胞识别[5]、免疫逃逸[6]及血管粥样硬化[7]等过程中发挥重要作用,且在多种肿瘤细胞中呈高表达。而在子宫内膜腺癌细胞中ANGPTL2的表达及其在子宫内膜腺癌发生、发展、放化疗耐受及复发过程中的作用,相关研究报道不多。深入探讨ANGPTL2在子宫内膜腺癌中的作用及其调控信号通路,可为子宫内膜腺癌临床治疗提供新的思路,为特异性靶向药物研发提供新的治疗靶点。因此,本研究分析子宫内膜腺癌患者临床病理资料,探讨ANGPTL2表达水平与患者临床病理特征的关系,及其对腺癌细胞增殖与侵袭的影响,现报道如下。
1 材料和方法
1.1 组织标本收集 选取2017年1月至2019年12月在温州市中西医结合医院或温州医科大学附属第一医院确诊为子宫内膜腺癌、行子宫全切除术的子宫内膜腺癌组织标本60例(温州市中西医结合医院20例,温州医科大学附属第一医院40例),排除术前接受放疗、化疗或激素治疗的患者。病理分级G1级38例,G2级16例,G3级6例;临床分期Ⅰ期30例,Ⅱ期10例,Ⅲ期15例,Ⅳ期5例。另择因子宫肌瘤行子宫全切除术的子宫内膜正常组织标本60例(温州市中西医结合医院60例)。收集的组织标本以冻存管分装后立即置入液氮罐中,后转入-80℃冰箱保存。子宫内膜腺癌患者年龄32~60(42.5±13.6)岁;子宫内膜正常患者年龄 40~62(45.5±15.4)岁。两者年龄比较无统计学差异(P>0.05)。本研究经温州市中西医结合医院医学伦理委员会批准。
1.2 主要仪器、试剂及细胞株 BIO-RAD凝胶电泳系统(Experion,美国伯乐公司),曝光机(ImageQuant LAS 4000 mini Biomolecular Imager,美国 GE Healthcare公司),DMEM 培养基(11960044,美国Gibco公司);1640培养基(31870074,美国Gibco公司);FBS(1921005PJ,美国Gibco公司);青霉素和链霉素双抗(10378016,美国Gibco公司);TrizolReagen(t15596026,美国Invitrogen公司)、实时荧光定量 PCR混合液(204243,美国Invitrogen公司);cDNA合成试剂盒购(B532435-0010,上海生工生物有限公司);抗体ANGPTL2(PA5-44219,美国Invitrogen公司);BCA蛋白浓度测定试剂盒(WB101)、RIPA 细胞裂解液(北京博奥龙免疫技术有限公司);SDS-PAGE凝胶配制试剂盒(碧云天生物技术有限公司);Tris碱(252859-100G,美国Sigma公司);甘油(G2289,美国 Sigma公司);Tween-20(美国 Sigma公司);NC膜(上海时代生物科技有限公司);LipofectamineTM2000(美国Invitrogen公司);HEPES(15630106,美国 Sigma公司);质粒pSPAX2、pMD2G、shRNA由温州医科大学附属第一医院内科实验室保存;子宫内膜腺癌Ishikawa细胞(子宫内膜腺癌高分化细胞)、人肾上皮细胞系293T细胞由温州医科大学附属第一医院内科实验室赠送。Nude小鼠购自上海斯莱克实验动物责任有限公司。
1.3 方法
1.3.1 ANGPT2 mRNA表达检测 采用实时荧光定量PCR法。两组新鲜组织RNA的提取:采用液氮研磨法将组织磨成粉末,加入Trizol混合,按Trizol说明书抽提总RNA。利用在线Primer 3.0软件设计引物,DNA双链胞嘧啶与胸腺嘧啶核苷酸碱基对含量即GC含量为40%~60% ,产物大小为89~203 bp,再用Oligo 6.0软件评估。检测目的基因表达水平引物均跨内含子以减少基因组DNA的干扰,引物序列由上海生工生物工程公司合成。引物:ANGPTL2(162 bp):上游 5′-GAACCGAGTGCATAAGCAGGA-3′,下游 5′-GTGACCCGCGAGTTCATGTT-3′;GAPDH(101bp):上游 5′-ACAACTTTGGTATCGTGGAAGG-3′;下游 5′-GCCATCACGCCACAGTTTC-3′。反应在25 μl的体系中进行,其中2×实时荧光定量PCR混合液 12.5 μl、10 μmol/L 的上下游引物各 1 μl、样本cDNA 2 μl(300 ng)、高压处理过的去离子水8.5 μl。热循环如下:94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,40个循环;72℃10 min。选择适宜的基线,各荧光曲线与基线的交叉点即为荧光阈值(Ct)值。应用2-ΔΔCt法分析mRNA相对表达水平。
1.3.2 ANGPT2蛋白表达检测 采用Western blot法。用含有蛋白酶抑制剂的RIPA蛋白裂解液提取标本蛋白。采用BCA试剂盒测定蛋白浓度。用BIO-RAD凝胶电泳系统,取60 μg样本,置于足量的电泳液中,根据测得的蛋白浓度上样,10% SDS-PAGE胶电泳,恒压100 V,90 min;电泳结束后,将样品转移到NC膜,恒压100 V,90 min。用PBS配置的5%脱脂牛奶室温封闭1 h,然后用PBS配置的2% FBS按相应浓度稀释抗体,4℃轻摇孵育过夜。第2天,回收一抗,用TBST(Tween-20与TBS按照1∶1 000的比例配制成)室温洗膜5 min,洗3次;用PBS配制的2% BSA按照1∶5 000稀释二抗,NC膜室温孵育二抗1 h,然后TBST洗膜5min,3次。凝胶图像采集及分析:用CCD摄像头,Quantity One凝胶图像处理系统,分析得出蛋白表达水平。
1.3.3 ANGPTL2敲除慢病毒制备 提前24 h准备1.5×106293T细胞接种到10 cm细胞培养皿中,加入10 ml DMEM培养液(含10% FBS)中。将细胞放入细胞培养箱24 h后,待细胞密度大约70%时准备转染;将慢病毒包装质粒 pSPAX2 12 μg、pMD2G 4 μg、目的基因敲除 shRNA 质粒 16 μg(敲除组)和 pSPAX2 12 μg、pMD2G 4 μg、plKO.1-Scramble 质粒 16 μg(对照组)分别加入1.5 ml无菌EP管中,再加入2.5 mol/L氯化钙 50 μl,并用灭菌水补至 500 μl,吹打混匀;将配置好的混合液逐滴加入500 μl 2×HBS(280 mmol/L氯化钠,10 mmol/L氯化钾,1.5 mmol/L磷酸氢二钠,12 mmol/L葡萄糖,50 mmol/L HEPES),室温静置 30 min;将上述混合液缓慢逐滴加入293T细胞培养液中;4 h后,换液,用10 ml新鲜DMEM培养液(含10% FBS)更换原培养液;48 h后,收取该293T培养液上清液即慢病毒上清液。
1.3.4 ANGPTL2敲除慢病毒感染子宫内膜腺癌细胞收集子宫内膜腺癌Ishikawa细胞,先按照2 ml/孔,细胞悬液密度为1×105/ml的标准接种至6孔板,24 h后对其进行慢病毒感染,将细胞培养液吸尽,加入慢病毒上清液,37°C 2 000 r/min离心感染2 h,分为ANGPTL2敲除组和对照组,分别采用实时荧光定量PCR法和Western blot法检测细胞ANGPTL2 mRNA、蛋白表达水平,方法同上。然后采用流式细胞仪分选绿色荧光蛋白阳性细胞,即慢病毒感染阳性细胞,进行培养扩增,绘制细胞增殖曲线检测细胞增殖情况。
1.3.5 小鼠皮下成瘤实验 利用构建成功的ANGPTL2敲除子宫内膜腺癌Ishikawa细胞(ANGPTL2敲除组和对照组),用1 ml注射器,分别植入20只6~8周龄小鼠左、右背部皮下,细胞数量为2×106个,移植6周后处死小鼠取出肿瘤组织,记录肿瘤体积和重量。
1.4 统计学处理 采用SPSS19.0统计软件。计量资料以表示,组间比较采用两独立样本t检验。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜腺癌组织与正常组织ANGPTL2 mRNA、蛋白表达水平比较 见图1-2。

图1 子宫内膜腺癌组织与正常组织血管生成样蛋白2(ANGPTL2)mRNA表达水平比较

图2 子宫内膜腺癌组织与正常组织血管生成样蛋白2(ANGPTL2)蛋白表达电泳图
由图1可见,子宫内膜腺癌组织ANGPTL2 mRNA表达水平为子宫内膜正常组织的2.64倍;由图2可见,4组蛋白ANGPTL2条带灰度扫描结果为(1.0,1.23,4.82,4.52),子宫内膜腺癌组织ANGPTL2蛋白表达水平为子宫内膜正常组织的4.2倍,两者比较差异均有统计学意义(均P<0.05)。即ANGPTL2在子宫内膜腺癌组织中呈现高表达。
2.2 ANGPTL2 mRNA、蛋白表达水平与子宫内膜腺癌临床病理特征的关系分析 见表1。
由表1可见,ANGPTL2 mRNA表达水平与子宫内膜腺癌病理分级、临床分期均有关(均P<0.05),与患者绝经情况、雌激素受体、孕激素受体、BMI均无关(均P>0.05)。ANGPTL2蛋白表达水平与子宫内膜腺癌病理分级有关(P<0.05),与绝经情况、临床分期、雌激素受体、孕激素受体BMI均无关(均P<0.05)。
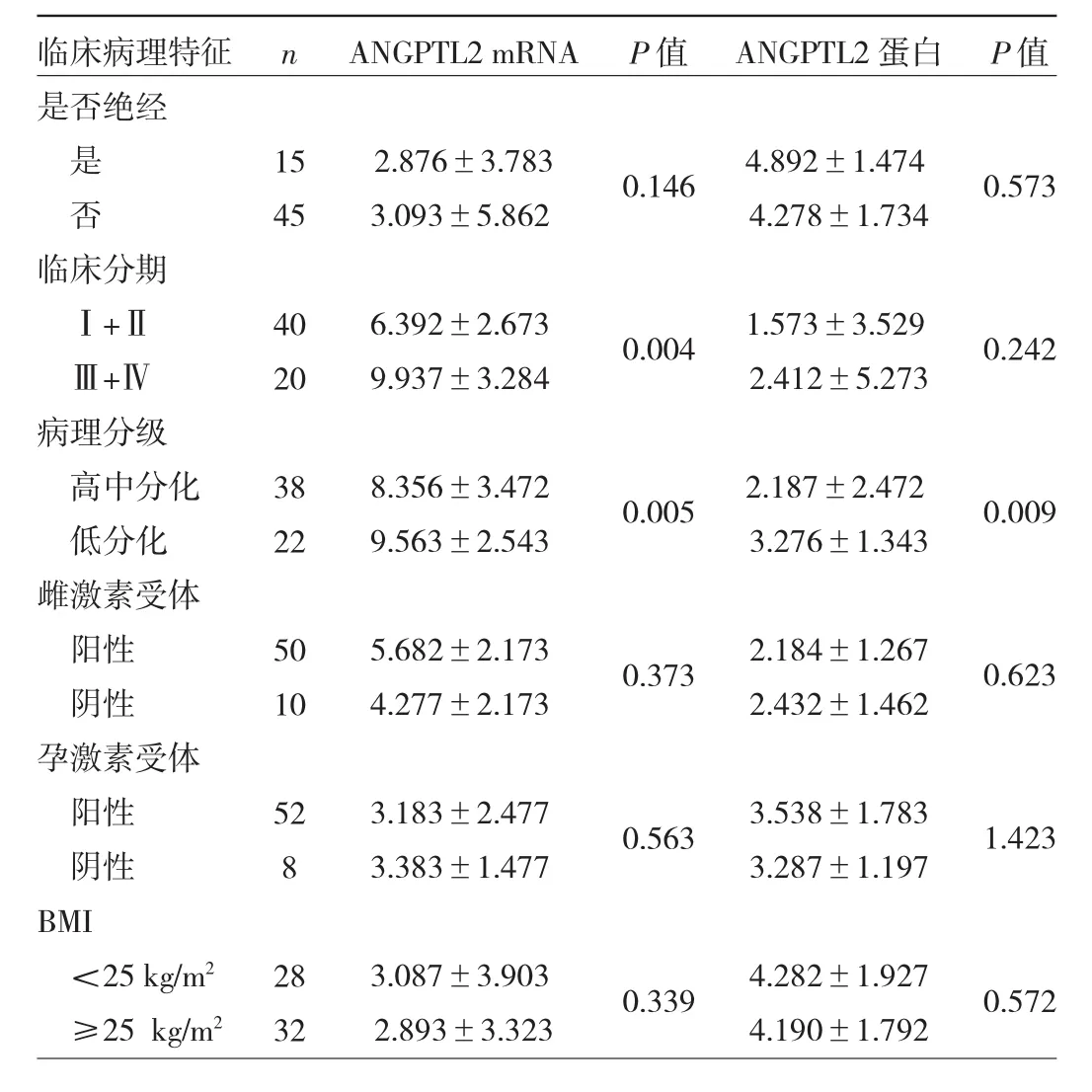
表1 血管生成样蛋白2(ANGPTL2)mRNA、蛋白表达水平与子宫内膜腺癌临床病理特征的关系
2.3 敲除组和对照组子宫内膜腺癌细胞ANGPTL2 mRNA、蛋白表达水平和增殖情况比较 见图3-5。

图3 敲除组和对照组子宫内膜腺癌细胞血管生成样蛋白2(ANGPTL2)mRNA表达水平比较

图4 敲除组和对照组子宫内膜腺癌细胞血管生成样蛋白2(ANGPTL2)蛋白表达电泳图
由图3-4可见,与对照组细胞相比,敲除组子宫内膜癌细胞ANGPTL2 mRNA、蛋白表达水平均下降(均P<0.05)。由图5可见,敲除组子宫内膜腺癌细胞增殖受抑制,即敲除ANGPTL2可以有效抑制子宫内膜腺癌细胞生长。

图5 敲除组和对照组子宫内膜腺癌细胞增殖情况比较
2.4 ANGPTL2敲除组与对照组子宫内膜腺癌细胞皮下成瘤小鼠肿瘤生长情况比较 对照组肿瘤体积(502.93±134.23)mm3,重量(0.71±0.37)g;敲除组肿瘤体积(122.90±39.13)mm3,重量(0.32±0.20)g;两组比较差异均有统计学意义(均P<0.05)。
3 讨论
子宫内膜腺癌是原发于子宫内膜表面或腺上皮的恶性肿瘤。近年来,子宫内膜腺癌的发病率有升高的趋势,在发达国家中已成为女性生殖道最常见的恶性肿瘤。目前,子宫内膜腺癌的治疗以手术为主,辅以放化疗以及孕激素治疗[8-10]。随着人们对子宫内膜腺癌研究的深入,逐渐认识到子宫内膜癌的发生发展是一个多因素、多步骤、多基因改变的过程。因此尝试多种治疗子宫内膜腺癌的潜在途径和方法,如基因的靶向治疗[11]或肿瘤的免疫治疗[12],显得尤为重要。
现有研究结果显示,ANGPTL2在多种肿瘤组织中呈现高表达,如胃癌[5]、肝癌[13]等。Lin等[13]研究结果提示在肝癌组织中,ANGPTL2明显高于正常对照组,高ANGPTL2水平与肿瘤转移密切相关。刘展等[14]研究结果提示,胃癌组织中ANGPTL2表达水平显著升高,且ANGPTL2表达水平与肿瘤的病理分期及淋巴结转移情况密切相关,并且体外细胞实验结果显示,胃癌细胞株中肿瘤细胞恶性程度越高,ANGPTL2表达越强。本研究结果显示,与正常子宫内膜组织相比,子宫内膜腺癌组织中ANGPTL2的表达水平,无论是mRNA水平还是蛋白水平,均显著增高,并且ANGPTL2与肿瘤的分化情况、病理分级密切相关。这提示,ANGPTL2与子宫内膜腺癌的发生、发展甚至预后紧密相关。这与现有报道结果也是相符的。
ANGPTL2表达可调控肿瘤细胞多条重要通路,且与患者预后密切相关。研究表明ANGPTL2可通过NF-κB/AKT/mTOR信号通路调控肿瘤微环境中破骨细胞再生过程,促进骨质流式过程[15]。而在造血干细胞中ANGPTL2通过与其配体结合,促进造血干细胞的扩增,自我更新及干性维持过程[16];ANGPTL2同时也参与了免疫系统相关的免疫过程,如巨噬细胞及T淋巴细胞的激活过程[17];而肿瘤组织中,ANGPTL2起到了各种不同的作用,在胃癌组织中,高表达ANGPTL2可促进肿瘤的增殖及转移过程[5];而在肺癌中,ANGPTL2通过CREB/CAMK1/SHP2信号通路调控肿瘤细胞增殖过程[18],另一方面,ANGPTL2表达促进非小细胞性肺癌细胞淋巴结侵袭过程[19]。因此,ANGPTL2在机体正常环境中与在肿瘤微环境过程中呈现完全不同的功能,且其具体调控机制复杂。因此,本研究探讨了子宫内膜腺癌实体肿瘤与子宫内膜正常组织中ANGPTL2的表达水平是否存在差异,以及其在子宫内膜癌细胞增殖与侵袭中所发挥的作用,以期为治疗子宫内膜腺癌提供新的靶点。
本研究在子宫内膜癌细胞中敲除ANGPTL2表达,结果显示敲除组子宫内膜腺癌细胞增殖能力受到显著抑制。体内移植实验显示ANGPTL2表达的减少,可使子宫内膜腺癌细胞在Nude鼠体内的增殖能力显著减弱,ANGPTL2敲除组子宫内膜癌细胞具有较低的成瘤能力。本研究结果表明ANGPTL2有助于子宫内膜腺癌细胞增殖。抑制ANGPTL2表达可在一定程度上缓解子宫内膜腺癌细胞恶性增殖能力,联合现有的临床治疗,或能改善患者预后。
