金丝桃苷在大鼠蛛网膜下腔出血后早期脑损伤中的神经保护作用及机制研究
2020-10-20俞越蔡菁
俞越 蔡菁
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是由于颅内血管壁完整性受到破坏,血液直接流入蛛网膜下腔引起的一种临床综合征,主要由颅内动脉瘤破裂引起。文献报道SAH患者在初次发病时病死率即高达30%,且幸存患者常遗留不同程度的神经功能障碍[1]。早期脑损伤(early brain injury,EBI)是指 SAH 发生 72 h内脑组织的损伤过程。越来越多的研究表明,EBI是SAH预后不良的关键因素[2-3]。EBI的病理机制十分复杂,炎症反应是SAH后EBI发生、发展的重要环节。因此,深入研究SAH后炎症反应的相关机制,研发针对性治疗措施,对于减轻EBI、改善SAH患者预后具有重要意义。Akt作为一种蛋白激酶,在神经元、胶质细胞和内皮细胞等部位均广泛表达[4]。它是调控细胞发育、存活等信号转导网络中的一个关键节点,以往对Akt的研究多着眼于抗凋亡效应[5]。最新研究表明,Akt能够结合其下游靶点GSK-3β,并促进后者发生磷酸化,进而减轻炎症反应[6]。金丝桃苷是提取自药用植物芦丁的黄酮醇苷类化合物。现代药理学研究证明,金丝桃苷具有抗氧化应激、减轻细胞凋亡、改善心血管功能、调节内分泌等多重药理学作用,是近年来国内外学者研究的热点中药单体[7]。近期有研究指出,Akt信号通路是金丝桃苷发挥心肌保护等多种药理学作用的关键靶点[8]。然而,金丝桃苷及其介导的Akt信号通路能否影响SAH后EBI病理过程,目前尚无相关报道。因此,本研究拟通过构建大鼠SAH模型,探讨金丝桃苷在SAH后EBI病理过程中的作用及其分子机制,以期为SAH治疗提供新的思路和理论依据。
1 材料和方法
1.1 实验动物 192只体重280~320 g的健康雄性SD大鼠购自上海斯莱克实验动物有限公司,饲养于浙江大学医学院附属第二医院实验动物中心,饲养温度(22±3)℃,动物自由觅食、饮水,适应性喂养1周。动物相关实验内容经浙江大学医学院附属第二医院实验动物伦理委员会审查通过,实验过程中严格遵守动物实验原则指南(1996年修订版)的要求。
1.2 主要药物与试剂 金丝桃苷(纯度≥98%)购自南京泽朗农业科技发展有限公司;Akt抑制剂MK2206购自美国Sigma公司;2%伊文思蓝溶液购自美国Sigma公司;二喹啉甲酸(BCA)试剂盒、Trizol试剂、反转录试剂盒均购自美国 Thermo Fisher公司;β-actin、Akt、p-Akt、GSK-3β、p-GSK-3 等兔抗大鼠一抗,Iba-1 山羊抗大鼠一抗均购自美国Abcam公司;辣根过氧化物酶标记的二抗购自北京中衫金桥公司;驴抗山羊荧光二抗购自美国Invitrogen公司;封闭液、一抗稀释液、二抗稀释液购自武汉碧云天有限公司;RIPA裂解液购自碧云天生物科技有限公司;loading buffer购自福德生物技术公司。
1.3 大鼠SAH模型的建立 采用颈内动脉穿刺法建立大鼠SAH模型[9]。SD大鼠用1%戊巴比妥钠(40 mg/kg)腹腔麻醉后,仰卧位固定在手术架上。分离并暴露右侧颈总动脉、颈外动脉和颈内动脉,经颈外动脉向颈内动脉置入4-0单丝尼龙线,在尼龙线头端距颈总动脉分叉处18~19 mm稍感阻力时,再向内送入约4 mm刺破动脉管壁,造成SAH;约15 s后迅速退出尼龙线,用丝线结扎颈外动脉残端,恢复血流,缝合颈部切口。假手术(sham)组大鼠除不刺破动脉管壁外,其余步骤相同。麻醉未清醒前继续给予电热毯保暖,术后大鼠单笼饲养。采用过量1%戊巴比妥钠(40 mg/kg)深度麻醉处死大鼠并获取脑组织标本,枕大池、基底池、小脑、脑干或大脑表面有血凝块存在即建模成功。若建模失败,则以备用动物补充。
1.4 动物分组与给药 整个实验分为3个部分进行。(1)金丝桃苷对SAH大鼠的保护作用及最佳治疗浓度确定:将60只SD大鼠按随机数字表法分为sham组、SAH+0.9%氯化钠溶液(SAH+vehicle)组、SAH+10 mg/kg金丝桃苷(SAH+Hyp-L)组、SAH+25 mg/kg金丝桃苷(SAH+Hyp-M)组、SAH+50 mg/kg金丝桃苷(SAH+Hyp-H)组,每组12只。在建模后24 h评估神经功能,随后处死大鼠评估SAH严重性评分,检测脑组织含水量(每组6只)和血脑屏障通透性(每组6只)。(2)金丝桃苷对SAH大鼠炎症反应的调控作用:将36只SD大鼠按随机数字表法分为sham组、SAH+0.9%氯化钠溶液(SAH+vehicle)组、SAH+50 mg/kg金丝桃苷(SAH+Hyp)组。在建模后24 h,采用免疫荧光法检测小胶质细胞激活情况(每组6只),qRT-PCR法检测炎症因子水平(每组6只)。(3)金丝桃苷调控SAH大鼠炎症反应的分子机制:将96只SD大鼠按随机数字表法分为sham组、SAH+0.9%氯化钠溶液(SAH+vehicle)组、SAH+50 mg/kg金丝桃苷(SAH+Hyp)组、SAH+50 mg/kg金丝桃苷+Akt抑制剂(SAH+Hyp+MK2206)组。在建模后24 h评估神经功能,采用 Western blot法检测 Akt、p-Akt、GSK-3β、p-GSK-3β水平(每组6只),qRT-PCR法检测炎症因子水平(每组6只),同时检测脑组织含水量(每组6只)和血脑屏障通透性(每组6只)。金丝桃苷采用灌胃给药法,按10、25、50 mg/kg称取金丝桃苷并溶解于1ml的0.9%氯化钠溶液中,建模前30 min进行灌胃给药;sham组、SAH+vehicle组大鼠在相同时间点给予1 ml的0.9%氯化钠溶液进行灌胃。以2 μg/μl的浓度将10 μg MK2206溶解于0.9%氯化钠溶液中,在建模前30 min使用立体定位仪注射至大鼠侧脑室内。
1.5 神经功能及出血程度评估 采用改良的加西亚评分体系评估大鼠神经功能,得分越低表示神经功能越差[10]。采用Sugawara评分标准对出血程度进行评分,总分0~18分[11],得分越高表示SAH越严重。
1.6 脑组织含水量测定 将大鼠深度麻醉处死后迅速取出脑组织,称取湿重。随后置于100℃烘箱烘干72 h直至重量不再变化,测定干重。脑组织含水量=[(湿重-干重)/湿重]×100%。
1.7 血脑屏障通透性测定 取材前1 h经微静脉注射2%伊文思蓝溶液(5 ml/kg)至大鼠体内。循环1 h后处死大鼠,经PBS灌注后取出左侧半球并称重。随后将脑组织浸润于甲酰胺溶液,60℃孵育24 h后收集浸出液,使用酶标仪在620 nm波长处测定光密度(OD)值,评估血脑屏障通透性。
1.8 小胶质细胞激活情况观察 采用免疫荧光法。大鼠深度麻醉后,依次经心脏灌注PBS和4%多聚甲醛后,取出脑组织置于4%多聚甲醛固定24 h,随后转移至30%蔗糖溶液脱水至沉底。将大鼠脑组织切至8 μm厚冷冻切片,用5%驴血清封闭后,滴加山羊抗大鼠I-ba-1一抗,4℃孵育过夜。洗涤后滴加驴抗山羊荧光二抗(美国Invitrogen公司),37℃避光孵育1 h后洗涤。封片后于荧光显微镜下观察Iba-1阳性细胞数量,即小胶质细胞激活情况。
1.9 脑组织炎症因子mRNA相对表达量检测 采用qRT-PCR法。Trizol法提取左侧大脑皮质组织内的总RNA,随后用反转录试剂盒将总RNA反转录为cDNA。根据以下体系进行qRT-PCR:5 μl反应混合物+0.25 μl上下游引物溶液+500 ng cDNA模板,补充焦碳酸二乙酯(DEPC)水至 10 μl。qRT-PCR 引物由 Takara公司设计合成,引物序列见表1。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用 2-ΔΔCt法计算 TNF-α、IL-1β、IL-6、诱导型一氧化氮合酶(iNOS)、单核细胞趋化蛋白1(MCP-1)的mRNA相对表达量。
1.10 脑组织Akt、GSK-3β等蛋白相对表达量检测采用Western blot法。脑组织加入RIPA裂解液,超声匀浆,4℃、12 000 r/min离心15 min,取上清液,用BCA法测定蛋白浓度。随后加入5×loading buffer,100℃加热5 min,置于-80℃保存。10% SDS-聚丙烯酰胺凝胶电泳,每孔加入40 μg总蛋白样品;在250 mA下将蛋白转移至聚偏氟乙烯膜,5%牛血清白蛋白室温下封闭1 h,将膜分别与 β-actin、Akt、p-Akt、GSK-3β、p-GSK-3等兔抗大鼠一抗于4℃孵育过夜,TBST缓冲液洗涤;在室温下孵育辣根过氧化物酶标价的小鼠抗兔二抗1 h,TBST缓冲液洗涤后;ECL法显影后,以β-actin为参数,用Image J软件计算各条带灰度值,即Akt、GSK-3β、p-Akt、p-GSK-3β 蛋白相对表达量;p-Akt、GSK-3β 的磷酸化水平(p-Akt/Akt、p-GSK-3β/GSK-3β) 分别用 p-Akt、p-GSK-3β的灰度值与各自总蛋白灰度值的比值表示。
1.11 统计学处理 采用SPSS 22.0统计软件。符合正态分布的计量资料用表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。采用Graphpad Prism6软件进行绘图。
2 结果
2.1 金丝桃苷对SAH大鼠的保护作用及最佳治疗浓度 各模型组大鼠出血程度评分比较,差异无统计学意义(P>0.05)。与sham组相比,各模型组大鼠神经功能评分均明显下降(均P<0.05),脑组织含水量均明显升高(均P<0.05),血脑屏障通透性亦明显增加(均P<0.05)。与SAH+vehicle组相比,金丝桃苷治疗组大鼠神经功能评分明显升高(均P<0.05),脑组织含水量明显减少(均P<0.05),血脑屏障通透性明显降低(均P<0.05),且呈剂量递增效应,见图1。因此,本研究后续实验选择50 mg/kg作为金丝桃苷的治疗浓度。

表1 qRT-PCR引物序列
2.2 金丝桃苷对SAH大鼠炎症反应的调控 与sham组相比,SAH+vehicle组大鼠脑组织内Iba-1阳性细胞数量明显增加,TNF-α、IL-1β、IL-6、iNOS、MCP-1 等炎症因子水平明显升高,差异均有统计学意义(均P<0.05);与SAH+vehicle组相比,SAH+Hyp组大鼠脑组织内Iba-1阳性细胞数量明显减少,上述炎症因子水平亦明显降低,差异均有统计学意义(均P<0.05),提示金丝桃苷能抑制SAH后的炎症反应,见图2-3。
2.3 金丝桃苷调控SAH大鼠炎症反应的分子机制与sham组相比,SAH+vehicle组大鼠脑组织内p-Akt/Akt、p-GSK-3β/GSK-3β 均明显下降(均 P<0.05);与SAH+vehicle组相比,SAH+Hyp组大鼠脑组织内p-Akt/Akt、p-GSK-3β/GSK-3β明显升高(均 P<0.05);与 SAH+Hyp 组相比,SAH+Hyp+MK2206 组 p-Akt/Akt、p-GSK-3β/GSK-3β及神经功能评分均明显降低(均P<0.05),而各炎症因子水平、脑组织含水量及血脑屏障通透性均明显增加(均P<0.05),提示SAH后大鼠Akt/GSK-3β信号通路被抑制,而金丝桃苷能在SAH后显著上调Akt/GSK-3β信号通路的激活水平,见图4。
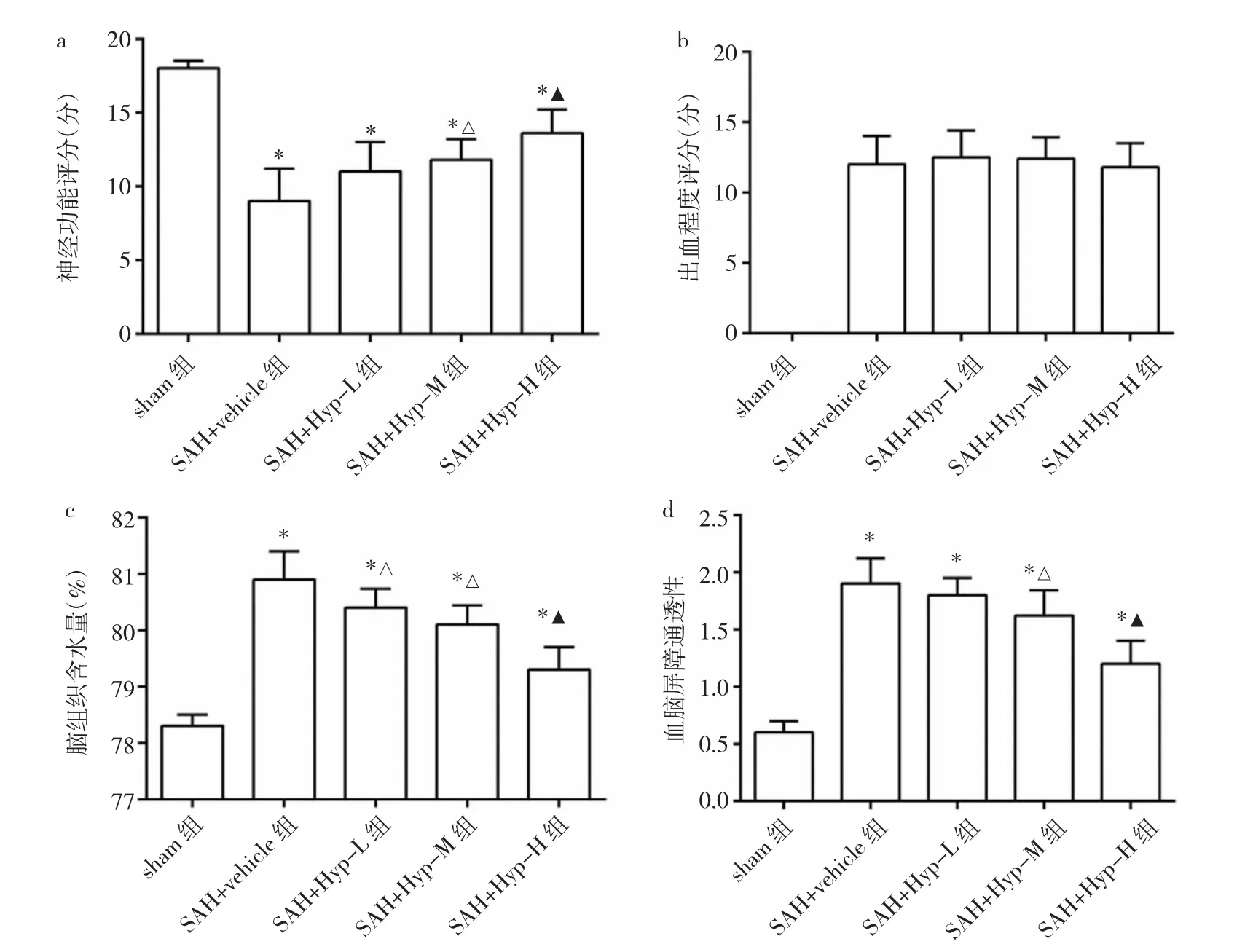
图1 金丝桃苷对蛛网膜下腔出血(SAH)后大鼠神经功能、出血程度、脑组织含水量及血脑屏障通透性的影响(a:神经功能评分;b:出血程度评分;c:脑组织含水量;d:血脑屏障通透性;与sham组比较,*P<0.05;与SAH+vehicle组比较,△P<0.05;与SAH+Hyp-L组比较,▲P<0.05)
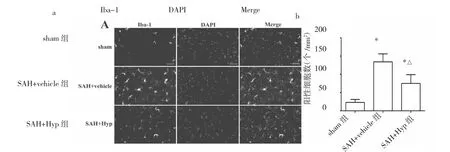
图2 金丝桃苷对蛛网膜下腔出血(SAH)后大鼠脑组织内小胶质细胞激活的影响(a:免疫荧光染色图,×200,DAPI为4′,6-二脒基-2-苯基吲哚,Merge为合并重叠;b:Iba-1阳性细胞数量比较,与sham组比较,*P<0.05,与SAH+vehicle组比较,△P<0.05)
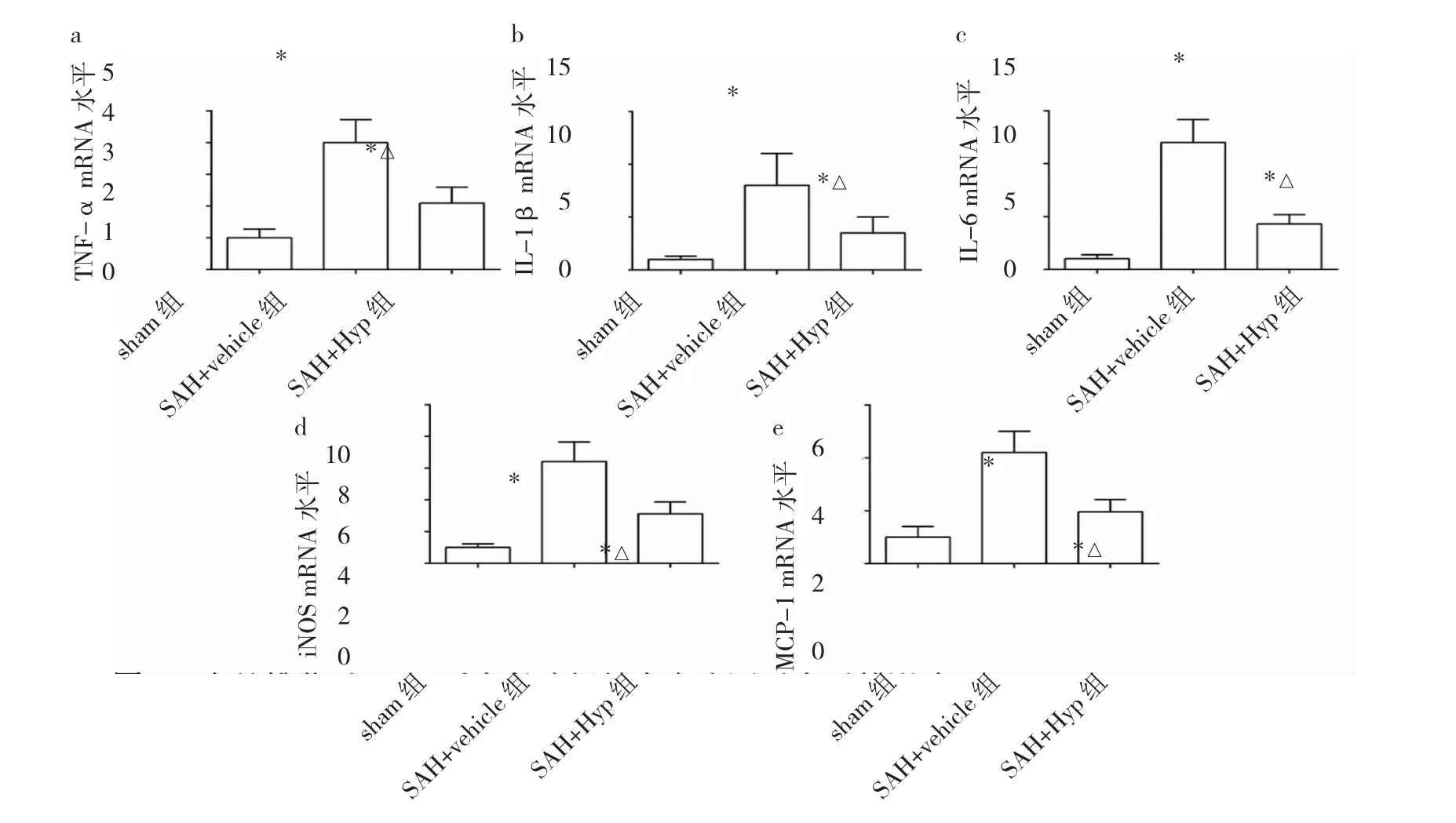
图3 金丝桃苷对蛛网膜下腔出血(SAH)后大鼠脑组织内炎症因子水平的影响[a:TNF-α;b:IL-1β;c:IL-6;d:诱导型一氧化氮合酶(iNOS);e:单核细胞趋化蛋白 1(MCP-1);与 sham 组比较,*P<0.05;与 SAH+vehicle 组比较,△P<0.05]
3 讨论
金丝桃苷作为一种具有抗氧化应激、改善心血管功能、调节内分泌等多种药理学作用的中药单体,日益受到学者的关注[12-13]。然而,关于金丝桃苷在SAH病理过程中的作用及机制,目前尚无确切研究。本研究初步探索了金丝桃苷在SAH后的效应,结果发现金丝桃苷治疗能明显减轻SAH后的脑水肿、减少血脑屏障破坏。更为重要的是,金丝桃苷能够明显减轻SAH引起的神经功能障碍,且疗效呈剂量递增效应。以上结果提示金丝桃苷能在SAH后发挥强大的神经保护效应。
神经炎症是SAH后EBI的关键致病机制,与SAH预后不良有关[14]。小胶质细胞作为常驻中枢神经系统的免疫细胞,能够快速感知各种病理刺激,并作出迅速应答。激活的小胶质细胞一方面能够通过合成和释放炎症因子,对神经细胞和内皮细胞造成直接杀伤;另一方面,小胶质细胞还可通过分泌MCP-1等趋化因子,进一步招募中性粒细胞、巨噬细胞等免疫细胞,最终放大炎症反应,加重脑组织损伤[15]。越来越多的研究证实,通过多种途径抑制SAH后小胶质细胞的异常激活,能够有效地抑制炎症反应,进而缓解EBI,改善SAH的预后[16-17]。笔者进一步探讨了金丝桃苷在SAH后对小胶质细胞及神经炎症的调控作用,发现大鼠SAH后脑组织内小胶质细胞被激活,且有大量炎症因子合成,提示SAH后发生了显著的神经炎症反应,这与Gris等[18]研究结果类似;但给予金丝桃苷治疗后,小胶质细胞的激活和炎症因子的合成均被明显抑制,提示金丝桃苷能够在SAH后抑制炎症反应,进而减轻EBI。
Akt作为广泛分布于真核细胞的蛋白激酶,能够通过激活其下游靶点参与细胞发育、分化和存活等一系列关键的生命过程[4]。以往研究主要集中在Akt对细胞凋亡的调控作用。Gugliandolo等[19]证实,Akt信号通路异常失活可引起多巴胺能神经元的凋亡,加速帕金森病等多种退行性神经系统疾病的病理进程。在脑外伤、脊髓损伤等疾病模型中也发现,通过外源性药物特异性激活Akt信号通路,能够减轻神经元凋亡,改善运动功能[20-21]。近期研究指出,Akt同样参与了炎症反应这一重要的生命过程。Akt能够磷酸化GSK-3β第9号位点上的丝氨酸残基,促进GSK-3β的激活。随后,激活的Akt/GSK-3β信号通路可以进一步调控下游NF-κB和mTOR等靶点,减轻炎症反应[22]。考虑到金丝桃苷能够在体外激活Akt信号通路[23],笔者推测Akt/GSK-3β可能参与了金丝桃苷在SAH后的抗炎效应。最后,本研究通过给予MK2206来特异性地阻断Akt/GSK-3β信号通路,以探讨金丝桃苷发挥抗炎作用的分子机制,结果发现特异性地阻断Akt/GSK-3β信号在逆转金丝桃苷抗炎作用的同时,也消除了金丝桃苷减轻脑水肿、减少血脑屏障破坏、改善神经功能等部分保护效应。以上结果提示Akt/GSK-3β调控的抗炎信号通路参与了金丝桃苷在SAH后的神经保护效应。

图4 金丝桃苷对蛛网膜下腔出血(SAH)后大鼠神经保护效应与Akt/GSK-3β信号通路的关系[a:p-Akt、Akt、p-GSK-3β、GSK-3β蛋白表达的电泳图;b:p-Akt/Akt水平;c:p-GSK-3β/GSK-3β 水平;d-h:TNF-α、IL-1β、IL-6、诱导型一氧化氮合酶(iNOS)、单核细胞趋化蛋白1(MCP-1)等炎症因子水平;i:脑组织含水量;j:血脑屏障通透性;k:神经功能评分;与sham组比较,*P<0.05;与SAH+vehicle组比较,△P<0.05;与 SAH+Hyp 组比较,▲P<0.05]
本研究重点探讨了金丝桃苷在大鼠SAH后EBI中的神经保护效应及其相关机制,主要发现有以下3点:(1)金丝桃苷能够减轻SAH后的脑水肿、减少血脑屏障破坏并改善神经功能;(2)金丝桃苷能显著下调SAH后的炎症反应;(3)金丝桃苷在SAH后的神经保护效应与Akt/GSK-3β信号通路有关。
综上所述,金丝桃苷治疗可以激活Akt/GSK-3β相关的抗炎信号通路,减轻SAH后的脑水肿和血脑屏障破坏,促进神经功能恢复。金丝桃苷及其介导的Akt/GSK-3β信号通路有望成为治疗SAH的潜在靶点。
