MCAO大鼠皮质小胶质细胞极化的研究及脑泰方Ⅱ号的干预
2020-10-18张秀丽葛金文张君宇任永镇
张秀丽,雷 昌,刘 洋,葛金文,张君宇,任永镇,资 冬,王 婧,朱 伟
(1.湖南中医药大学科技创新中心; 2.湖南省中药粉体与创新药物省部共建国家重点实验室培育基地;3.湖南中医药大学心脑疾病中西医结合防治湖南省重点实验室,湖南 长沙 410208)
缺血性卒中(ischemic stroke)约占全部脑卒中的80%~87%,其危害性广、致残率高[1]。小胶质细胞(microglia,MG)由于其对中枢神经系统损伤和保护的双重作用,在缺血性卒中的防治中日益受到重视。正常情况下,MG呈静息态,当受到外界刺激时,其迅速极化。极化的MG有两种类型:M1型的MG可引发神经损伤、凋亡,产生并加重脑损伤,而M2型的MG可通过促进神经发生、血管生成、轴突重塑及髓鞘再生等参与脑修复,MG极化释放的炎症因子贯穿于缺血/再灌注损伤病理发展的全过程[2-4]。因此,调控MG极化已成为治疗缺血性脑卒中的新靶点和新策略。
缺血性脑卒中(脑梗塞)属中医“中风”范畴,“气虚血瘀”系其中医病机关键,因此,治宜以“益气活血”为法。课题组前期采用具有“益气活血”作用的脑泰方治疗气虚血瘀证脑梗塞取得较好疗效[5],前期研究表明其可降低梗死患神经元损伤[6]、促进神经再生[7],后在脑泰方基础上加味形成的脑泰方Ⅱ号可明显抑制体外培养的MG的M1型极化,促进M2型极化(在发表)。本文重点对局灶性脑缺血(middle cerebral artery occlusion,MCAO)大鼠造模后1周内皮质MG极化形态与极化标志进行研究,并采用脑泰方Ⅱ号进行干预。
1 材料与方法
1.1 动物模型的建立84只♂SPF级SD大鼠,体质量(300±50) g,适应性喂养3 d后,随机分为正常组(6只)、假手术组(6只)、MCAO模型组(24只)、米诺环素组(24只)、脑泰方Ⅱ号组(24只)。采用大脑中动脉线栓法复制MCAO大鼠模型,动物于清醒后2 h参照Longa的5分制法进行神经功能评分,分值在1~3分者入组,动物清醒后爬行时向右转圈(追尾现象),严重时向右跌倒,提尾时右前肢内收屈曲提示造模成功。实验所用SD大鼠购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2016-0002,实验动物环境设施合格证号:SYXK(湘)2009-0001。
1.2 药物制备与给药脑泰方Ⅱ号由黄芪、川芎、防风、地龙、白术、僵蚕组成,药材均购自湖南中医药大学第一附属医院,购置药材选择黄芪甲苷、川芎嗪、阿魏酸成分含量为考察指标进行药材质量控制,经检测每80 g复方中含有川芎嗪0.36 mg、阿魏酸2.52 mg、黄芪甲苷13.72 mg,合格的药材经水煎醇提浓缩后制成。药物结合前期实验,脑泰方Ⅱ号按9.18 g·kg-1灌胃给药;盐酸米诺环素(M9511) , 购自Sigma公司,溶解后按50 mg·kg-1腹腔注射给药;脑泰方Ⅱ号和盐酸米诺环素均从造模成功后d 1即开始,连续给药1周。
1.3 激光共聚焦观察MCAO模型组于造模成功后于d 1、3、5、7处死大鼠,米诺环素组与脑泰方Ⅱ号组于给药d 1、3、5、7处死大鼠,留取距额叶前端1/3~2/3处脑组织,固定后石蜡切片,免疫荧光染色(Iba1一抗,abcam ab5076; FITC二抗,abcam ab6881),激光共聚焦(Zeiss LSM800)观察皮质MG形态。
1.4 Real-time PCR法检测相关基因的表达取与“1.3”相应部位的脑组织皮质提取总RNA,逆转录成cDNA 后,real time-PCR(Bio-Rad 7900HT)检测M1型标志分子MHCⅡ、iNOS、MCP-1、CD11b,M2型标志分子Arg1(精氨酸酶)、Mrc1(甘露糖受体)、Ym1(几丁质酶)的表达。Transcriptor First Strand cDNA Synthesis Kit(Roche,货号:04 896 866 001);NoVoStart SYBR qPCR SuperMix plus(NoVoprotein,货号:E096-01A)。引物序列见Tab 1。
1.5 数据处理采用SPSS 16.0 计软件包对数据进行统计分析,多组总体比较方差齐者用方差分析,两两比较用Q检验,方差不齐者用Tamhane检验。
2 结果
2.1 MCAO大鼠脑皮质MG极化形态的变化及脑泰方Ⅱ号的作用正常组与假手术组大鼠皮质区MG呈静息态,表现为胞体较小,分支较细(如Fig 1 A、B、F、G);与空白组比较,MCAO模型组MG胞体明显增大、变形,突触变短、变粗,分支减少(如Fig 1 C1、C2、C3、C4、H、I),但从d 5开始部分MG突触分支增加,如Fig 1C3、C4、J、K)。
经脑泰方Ⅱ号干预后d 3 MG突触分支增加(如Fig 1D2),从d 5~7,分支增加的MG数量增多(如Fig 1 D3、D4),部分胞体体积呈现回缩(如Fig 1 M)。米诺环素组亦可逆转MG胞体胀大、突触分支减少的状况,且在d 3效果就比较明显(如Fig 1 E2),但在d 5~7米诺环素促MG分支的作用有下降的趋势(如Fig 1 E3、E4、N)。
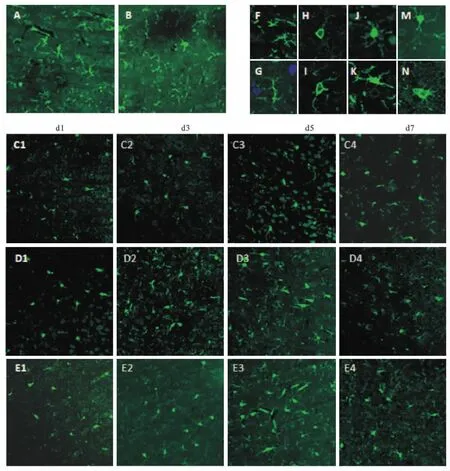
Fig 1 Morphological changes of MG at different time points in each group (200×)A. Normal group; B. Sham-operated group; C1~C4. MCAO model group; D1~D4. minocycline group; E1~E4. Naotaifang Ⅱ group.F,G:microglia in "resting";H, I:M1 polarized microglia with expanded cell body,short and thick synapses;J, K, M, N:Polarized microglia from M1 to M2 with increased synaptic branches, lengthen, thin.
2.2 M1型标志分子MHCⅡ、iNOS、MCP-1、CD11b的表达变化及脑泰方Ⅱ号对M1型极化的抑制作用与假手术相比,模型组M1型标志分子MHCⅡ、iNOS、MCP-1、CD11b表达都明显增加(P<0.01,Fig 2),其中尤以MCP-1的变化最为剧烈(Fig 2C)。从时间表达轴上看,模型组MHCⅡ的表达在d 3最高,之后逐渐减少(Fig 2A);iNOS、MCP-1与CD11b的表达在d 5达到最高,之后出现不同程度的下降(Fig 2B、C、D)。
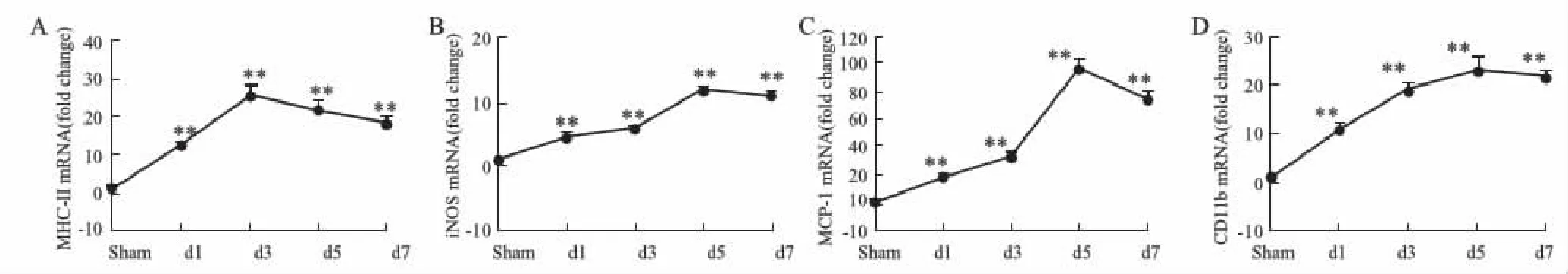
Fig 2 MRNA expression of M1 markers MHCⅡ, iNOS, MCP-1 and CD11b in MCAO model rats n=3)*P<0.05,**P<0.01 vs sham
与模型组相比,脑泰方Ⅱ号在d 3后可明显降低MHCⅡ、iNOS的表达(P<0.05或P<0.01,见Fig 3A、B),但在d 5后才对MCP-1与CD11b的表达有明显调节作用(P<0.01,见Fig 3C、D);米诺环素对iNOS、CD11b的调节作用从d 1差异有显著性(P<0.05,见Fig 3B、D),对MHCⅡ、MCP-1调节作用从d 3差异有显著性(P<0.01,见Fig 3A、C)。
与米诺环素相比,脑泰方Ⅱ号对MHCⅡ的抑制作用在d 3明显弱于米诺环素(P<0.05),在d 5后虽强于米诺环素,但差异无显著性(P>0.05,见Fig 3A);其对iNOS、MCP-1、CD11b的抑制作用均在d 5后才优于米诺环素(P<0.05或P<0.01,见Fig 3B、C、D)。
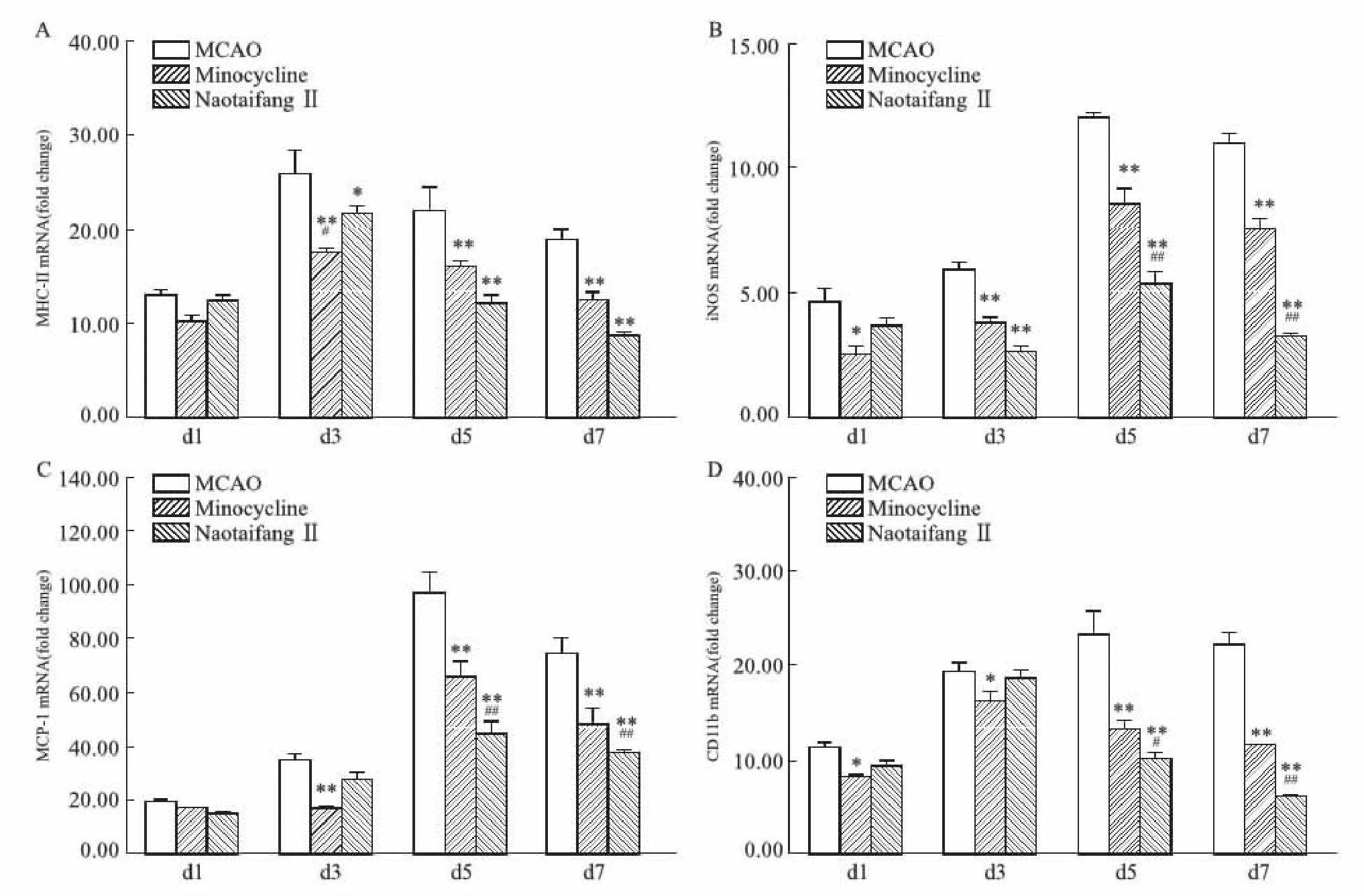
Fig 3 Effects of NaotaifangⅡon mRNA expression of M1 markers MHCⅡ, iNOS, MCP-1 and CD11b n=3)*P<0.05,**P<0.01 vs sham;#P<0.05,##P<0.01 vs model
2.3 M2型标志分子Arg1、Mrc1、Ym1表达变化及脑泰方Ⅱ号的调节作用与假手术相比,模型组M2型标志分子Arg1、Mrc1、Ym1表达在d 3、5均有明显增加(P<0.05或P<0.01,见Fig 4),但总体表达水平较M1型标记分子偏低。从时间表达轴上看,模型组Arg1、Ym1的表达在d 3最高,之后逐渐减少(Fig 4A、C);而Mrc1的表达在d 5达到最高,之后出现不同程度的下降(Fig 4B)。
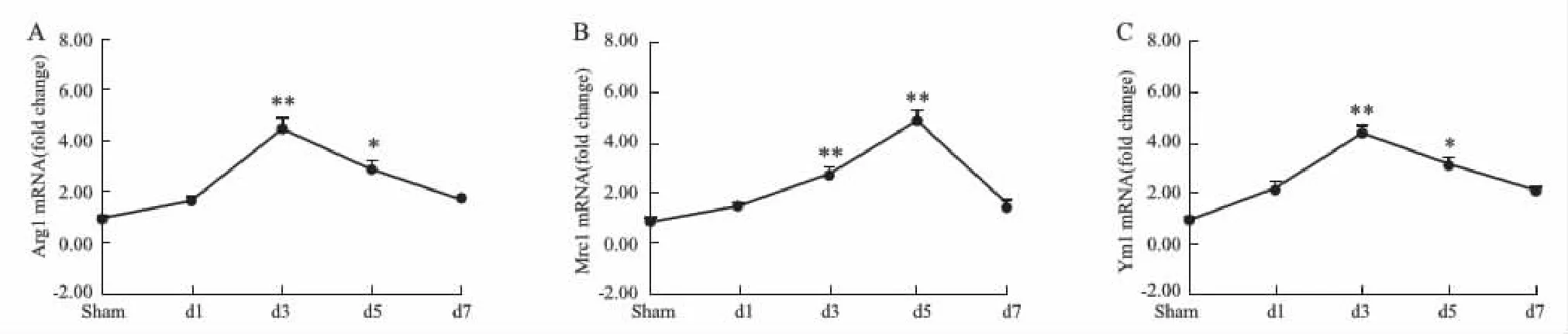
Fig 4 MRNA expression of M2 markers Arg1, Mrc1, Ym1 in MCAO model rats n=3)*P<0.05,**P<0.01 vs sham
与模型组相比,脑泰方Ⅱ号在d 3后可明显升高Arg1、Mrc1、Ym1的表达(P<0.05或P<0.01),且在d 5达到最高点(Fig 5)。米诺环素对Arg1、Mrc1、Ym1的调节作用从d 1起即差异有显著性(P<0.05或P<0.01),但在3 d后其调节作用即下降。
与米诺环素组相比,脑泰方Ⅱ号虽在d 3对Arg1、Mrc1、Ym1的调节作用明显弱于米诺环素组(P<0.01),但在d 5~7均强于米诺环素组(P<0.01)。

Fig 5 Effects of NaotaifangⅡon mRNA expression of M2 markers Arg1, Mrc1 and Ym1 n=3)*P<0.05,**P<0.01 vs sham;#P<0.05,##P<0.01 vs model
3 讨论
MG的形态与MG的功能密切相关[8],在非病理条件下,MG处于高度分支的静息状态,当受到外界刺激后,MG迅速活化,并伴随着突触分支形态、数量,胞体体积等的变化[9]。本项研究结果表明,MCAO模型组皮质MG胞体明显增大、变形,突触变短、变粗,分支减少,这与Chen 等[10-11]的研究结果一致。但本研究还发现,在d 5后MCAO大鼠皮质MG有突触分支增加、胞体回缩的趋势,这可能与大鼠一定程度的自愈有关。与米诺环素相比,脑泰方Ⅱ号对MG极化调节有滞后性,米诺环素促MG突触分支与数量增加的作用在d 3效果就比较明显,但脑泰方Ⅱ号促MG突触分支及数量增加的作用在d 5后效果才明显。
MG表面标记分子是区分M1型与M2型MG的重要标志,其表达变化反映了M1/M2型MG在体内的动态变化过程。本项研究表明:MCAO大鼠皮质MG在造模1 d后被激活,M1/M2型标记分子的表达均增加,且不同M1/M2型标记分子的表达具有时间差异,分别在d 3或d 5达到最高点,呈现出逐步被激活的趋势。这与Hu等[12]的研究结果一致。但在本文中CD11b的表达在造模d 5达到高点后呈现出下降的趋势,这与Hu等[12]的研究结果“CD11b持续上升”不一致,估计可能与造模损伤的程度有关[13]。除此之外本项研究还发现,M1型标记分子在造模后均明显增加,且分别在d 3或d 5达到最高点;而M2型标记分子在造模后d 1虽有增加,但差异并无显著性,造模后d 3、5虽明显增加,但在d 7后回落,M2型标记分子的表达变化(2~6倍)整体较M1型标记分子变化较小,这一结果从侧面解释了MCAO模型后1周内脑损伤的原因,且与本研究中形态学观察结果一致。
脑泰方是课题组前期临床研究获得的具有“益气活血”作用的、用于治疗气虚血瘀证脑梗塞的中药复方,临床药效明显[5],后期在脑泰方的基础上加入白术、防风形成脑泰方Ⅱ号。方中以黄芪作为君药,借其力专、性走,周行全身,大补脾胃元气,令气旺则血活,血活则瘀除,以治其本;川芎活血行气,白术健脾益气,助君药加强补气之功,共为臣药;防风祛风通络,地龙、僵蚕通经活络,共为佐药,诸味配合,共呈益气活血通络之效。本研究表明,脑泰方Ⅱ号可通过明显降低M1型标记分子MHCⅡ、iNOS、MCP-1、CD11b的表达抑制MG的M1型极化,通过促进M2型标志分子Arg1、Mrc1、Ym1表达促进MG的M2型极化。但与米诺环素相比,脑泰方Ⅱ号对MG M1/M2型极化标记分子的调节显示出一定的滞后性,米诺环素在d 1到d 3逐步明显激活M1型标记分子,而脑泰方Ⅱ号在d 3~5逐步明显激活M1型标记分子;米诺环素在d 1即对M2型标记分子起明显调节作用,但脑泰方Ⅱ号对M2型标记分子的调节作用在d 3才有显著性;这也与本研究中形态学观察的结果相一致。但脑泰方Ⅱ号又有自身独特的优势,其在d 5后对M1/M2型MG极化标记分子的调节作用均明显优于米诺环素组,这进一步解释了其在d 5~7,促MG分支增加和数量增多的作用逐步增强的现象。
综上,MCAO大鼠皮质MG极化具有时序性,是一个逐步活化的过程;脑泰方Ⅱ号对缺血性卒中后皮质MG极化具有明显的调节作用。本项研究结果将为缺血性卒中的中医药治疗提供新的理论依据与治疗靶点,后续将进一步对脑泰方Ⅱ号调节MG极化的分子机制进行研究。
