莫诺苷对大鼠原代皮层神经元氧糖剥夺模型线粒体质量控制体系的影响
2020-10-18王明洋牛红妹李雅莉
王明洋,牛红妹,张 丽,李雅莉,李 林,张 兰
(首都医科大学宣武医院药学部;北京市神经药物工程技术研究中心;北京脑重大疾病研究院;神经变性病教育部重点实验室,北京 100053)
脑卒中是导致中国居民死亡和残疾的第一致病因素,同时给社会和病患家庭带来极重的经济压力[1]。在脑缺血导致的多种病理损伤中,线粒体能量代谢障碍被当作是引发系列损伤的源头[2]。且日益增多的研究证据表明,脑缺血后线粒体功能障碍可直接影响神经元的存活或死亡状态[3],调控并维持正常线粒体网络稳态有助于神经系统功能的执行,靶向线粒体的新药研发有可能为脑缺血治疗带来新的突破。
细胞内线粒体网络稳态依赖于严密精准的线粒体质量控制系统(mitochondria quality control,MQC)调控,主要包括线粒体自噬及分裂、融合等线粒体动力学过程[4]。线粒体自噬是受损或者老化的线粒体被选择性降解的途径,经由激活的AMPK-ULK-Beclin通路启动自噬作用,细胞将受损线粒体部分隔离成为自噬小体,随后通过溶酶体途径降解,防止受损线粒体在细胞内堆积[5]。而线粒体经过不断的分裂融合可保证各个线粒体之间内容物的互换,促进健康线粒体的生成并分离受损部分。且有研究表明,激活的线粒体分裂可进一步刺激线粒体自噬过程来加速清除受损的线粒体[6]。受损线粒体的及时清除可有效阻断其引起的细胞死亡。因此,通过调控MQC过程,减轻线粒体损伤,对于促进脑缺血后的神经功能恢复有着重要意义。
传统中药山茱萸中含有大量的具有多种生物活性的环烯醚萜类化合物,莫诺苷是其中重要成分之一。研究表明,莫诺苷具有抗炎、抗凋亡、促血管生成等活性作用[7-8]。同时,本研究室前期研究发现,莫诺苷具有神经保护作用[9],但具体作用机制尚未完全阐明。本研究在体外培养的大鼠原代皮层神经元上建立氧糖剥夺(oxygen-glucose deprivation,OGD)模型,模拟脑缺血损伤后神经元的病理改变,研究莫诺苷对OGD后神经元损伤的影响,并进一步从调控维持线粒体稳态的线粒体质量控制体系的角度探讨其发挥神经保护作用的机制。
1 材料与方法
1.1 药品与试剂莫诺苷(morroniside)(B20872)购于上海源叶生物科技有限公司,纯度>97%。多聚赖氨酸(P6407)、连二亚硫酸钠(Na2S2O4)(71699)等购于Sigma公司;Neurobasal(含/不含葡萄糖)(21103049,A2477501)、B27添加剂(17504044)等细胞用试剂购于Gibco公司;CCK-8检测试剂盒购于北仁化学科技(北京)有限公司(CK04);线粒体膜电位检测试剂盒(C2006)、Fluo-4 AM(钙离子荧光探针)(S1060)、蛋白酶磷酸酶抑制剂(P1045)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(ST506)、RIPA(P0013B)、BCA蛋白浓度测定kit(P0010)等购于碧云天生物技术有限公司;抗体AMPKα(#5832)、Phospho-AMPKα(Thr172)(#2535)、ULK1(#8054)、Phospho-ULK1(Ser555)(#5869)、Beclin1(#3495)、p62(#39749)、Nix(#12396)、OPA(#80471)、MFF(#84580)、β-actin(#3700)等购于CST公司。
1.2 仪器倒置荧光显微镜购于日本Olympus公司; CO2培养箱、台式高速离心机购自美国Thermo公司;全波长酶标仪购于法国巴德斯公司;恒温振荡培养摇床购于武汉科学仪器厂;电子天平购于北京赛多利斯天平有限公司;凝胶电泳槽、电泳仪等购于美国Bio-Rad公司;化学发光成像仪购于上海天能公司。
1.3 原代神经元培养取24 h内新生SD乳鼠(购于斯贝福生物技术有限公司,许可证号:SCXK(京)2019-0010),用75%酒精消毒后断头,取出大脑,在预冷的D-Hanks液中漂洗后,去除中脑和海马,剩余皮层部分,小心剔除脑膜后,将脑组织剪成约1 mm3的组织块,用1~2 mL组织消化裂解液在37 ℃作用15 min后,加入DMEM高糖培养基终止消化,并吹打成单个细胞悬液,然后用70 μm网筛过滤收集悬液,离心5 min(1 000 r·min-1),弃上清,用DMEM高糖培养基吹打重悬细胞,并计算母液细胞密度。调整合适细胞密度种板。接种后4 h将DMEM高糖培养基全部换成Neurobasal培养基(添加有2% B27),随后每隔2~3 d半量更换培养基。体外培养8~10 d用于后续实验。
1.4 大鼠原代皮层神经元氧糖剥夺模型的制备所有细胞培养成熟后分为5组:正常对照组,对照+莫诺苷25 μmol·L-1组,OGD模型组,OGD+莫诺苷12.5 μmol·L-1组,OGD+莫诺苷25 μmol·L-1组。OGD模型制备时弃去各细胞原培养基,除正常对照及对照+莫诺苷组细胞更换新的Neurobasal外,其余各组替换为含5 mmol·L-1Na2S2O4(氧剥夺)的 Neurobasal无糖培养基(糖剥夺),在37 ℃,5% CO2培养箱孵育1 h建立OGD模型,后换为Neurobasal培养基,同时各给药组分别加入终浓度为25、50 μmol·L-1的莫诺苷,正常对照组给予相应同体积Neurobasal,对照+莫诺苷组细胞给予含50 μmol·L-1莫诺苷的同体积Neurobasal。于培养箱中正常培养12 h或24 h后进行后续检测。
1.5 CCK-8法检测细胞存活率采用CCK-8试剂检测细胞存活率。上述细胞处理24 h后,将各组细胞原有培养基除去,按100 μL/孔加入含10%(体积分数)CCK-8的新鲜neurobasal,37 ℃孵育2 h后测定450 nm处吸光度(OD值)。以不含细胞的空白培养基组吸光度为基准调零,各组取平均值后按下式计算细胞相对存活率:细胞相对存活率/ % =(实验组OD值/对照组OD值)×100%。
1.6 线粒体膜电位检测采用JC-1法检测神经元内线粒体膜电位(mitochondrial membrane potential,MMP)的变化。上述细胞处理12 h后,除去原有培养基,PBS洗2遍,加入适量1×JC-1试剂,于37 ℃反应30 min,之后再用PBS洗2遍,在倒置荧光显微镜下观察并拍照。使用Image-Pro Plus软件定量分析图像中红色及绿色荧光强度,各组MMP的变化以红/绿荧光强度比值显示。
1.7 钙离子浓度检测采用Fluo-4 AM法检测神经元内钙离子浓度的变化。上述细胞处理12 h后,除去原有培养基,PBS洗2遍,加入适量1 μmol·L-1Fluo-4 AM工作液,于37 ℃反应30 min,之后再用PBS洗2遍,继续于37 ℃培养箱孵育约20~30 min后,在倒置荧光显微镜下观察并拍照。使用Image-Pro Plus软件定量分析图像中绿色荧光强度。
1.8 Western blot法检测蛋白表达上述细胞处理12 h后,用细胞裂解液(RIPA ∶蛋白磷酸酶抑制剂 ∶PMSF=100 ∶2 ∶1)裂解收集;BCA法定量后变性;取相同质量蛋白进行SDS-PAGE电泳分离,湿转法转膜,5% BSA封闭后,孵育上述适当浓度的一抗,4 ℃过夜;TBST 洗膜3次,加入相应的二抗室温下孵育1 h;弃去二抗,TBST洗膜3次;加ECL化学发光试剂曝光,保存适宜条带图像,使用GelPro 3.1定量分析图像中目的蛋白丰度。

2 结果
2.1 莫诺苷对大鼠原代皮层神经元氧糖剥夺(OGD)模型细胞存活率的影响本研究采用CCK-8法检测OGD损伤后各组神经元存活率。结果显示,OGD损伤明显抑制细胞活性,模型组皮层神经元细胞存活率与对照组相比明显降低(P<0.01);莫诺苷(3.125、6.25、12.5、25 μmol·L-1)孵育24 h能够明显增高OGD细胞的存活率(P<0.05,P<0.01;Fig 1)。由于莫诺苷在12.5、25 μmol·L-1浓度时药效最佳,因此后续实验采用这两个浓度进行作用机制研究。
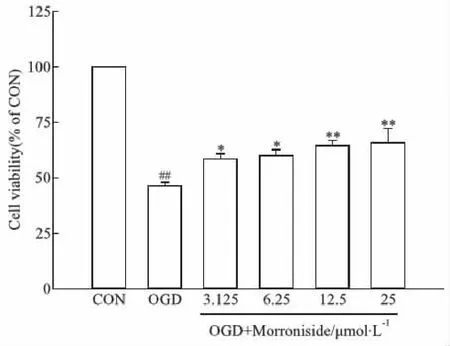
Fig 1 Effects of morroniside on cell viability in OGD model of rat primary cortical Cells were incubated with serial concentrations of morroniside for 24 h after OGD damage. Cell viability was measured by CCK-8 assay. The cell viability in the control group was set as 100%.##P<0.01 vs CON group;*P<0.05,**P<0.01 vs OGD group.OGD, oxygen-glucose deprivation; CON: control group.
2.2 莫诺苷对大鼠原代皮层神经元OGD模型线粒体损伤的影响本研究采用JC-1荧光染色法检测神经元MMP。结果显示,正常对照组中红色荧光较强,绿色荧光较弱,红/绿荧光比值为4.41±0.46,而OGD损伤使得模型组中红色荧光强度明显降低,绿色荧光强度明显增强,红/绿荧光比值明显降低至1.68±0.32(P<0.01),表明模型组细胞MMP明显下降。12.5、25 μmol·L-1莫诺苷孵育12 h可分别使OGD细胞的红/绿荧光比值明显增高至3.49±0.31、3.96±0.52(P<0.01;Fig 2),表明MMP明显增高。
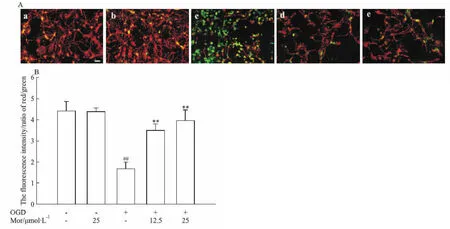
Fig 2 Effects of morroniside on mitochondrial membrane potential in OGD model of rat primary cortical 25 μmol·L-1;c:OGD;d:OGD+Mor 12.5 μmol·L-1;e:OGD+Mor 25 μmol·L-1.Cells were incubated with morroniside for 12 h after OGD damage.(A) Representative images of JC-1-labeled mitochondrial membrane potential staining. Scale bar=50 μm.(B) Quantitative analysis of mitochondrial membrane potential(the fluorescent intensity ratio of red/green).##P<0.01 vs CON group;**P<0.01 vs OGD group.OGD:oxygen-glucose deprivation;CON:control group; Mor: morroniside.
此外,采用Fluo-4 AM检测神经元细胞内钙浓度变化。结果显示,与对照组相比,OGD模型组荧光强度明显增强(P<0.05),表明细胞内钙浓度明显增高。莫诺苷(12.5、25 μmol·L-1)孵育12 h使OGD细胞的荧光强度明显降低(P<0.05,P<0.01;Fig 3),表明细胞内钙浓度明显下降。
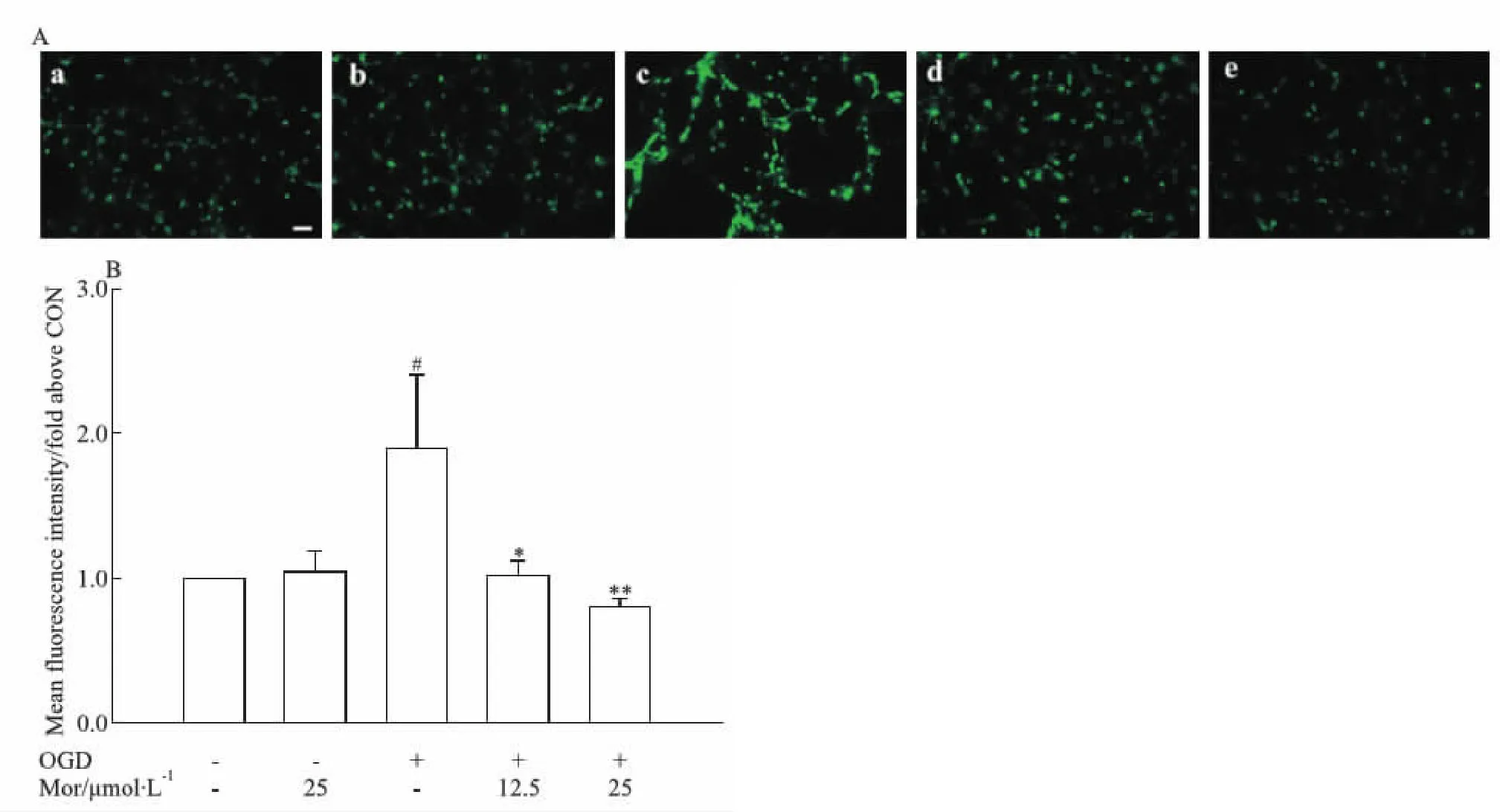
Fig 3 Effects of morroniside on intracellular calcium ion concentration in OGD model of rat primary cortical 25 μmol·L-1;c:OGD;d:OGD+Mor 12.5 μmol·L-1;e:OGD+Mor 25 μmol·L-1.A:Representative images of Fluo 4-AM fluorescence for intracellular calcium ion. Scale bar=50 μm.B:Quantitative analysis of fluorescence intensity of intracellular calcium ion. The fluorescence intensity in the control group was set as 1.0.#P<0.05 vs CON group;*P<0.05,**P<0.01 vs OGD group. OGD: oxygen-glucose deprivation; CON: control; Mor: morroniside.
2.3 莫诺苷对大鼠原代皮层神经元OGD模型线粒体质量控制体系的影响线粒体MQC主要包含线粒体自噬及分裂、融合等调控线粒体稳态的过程。本研究采用Western blot方法检测MQC相关蛋白的表达。结果显示,与对照组相比,OGD模型组神经元内线粒体自噬受体蛋白Nix及线粒体裂变因子MFF的表达明显下降(P<0.05,P<0.01),自噬底物标志蛋白p62明显增加(P<0.01),表明线粒体自噬及分裂过程被抑制,但线粒体融合蛋白OPA的表达无明显变化。莫诺苷孵育12 h使OGD细胞的Nix和MFF表达明显增高(P<0.01,P<0.05),p62表达明显减低(P<0.01,Fig 4),表明莫诺苷能够增强线粒体自噬和分裂。
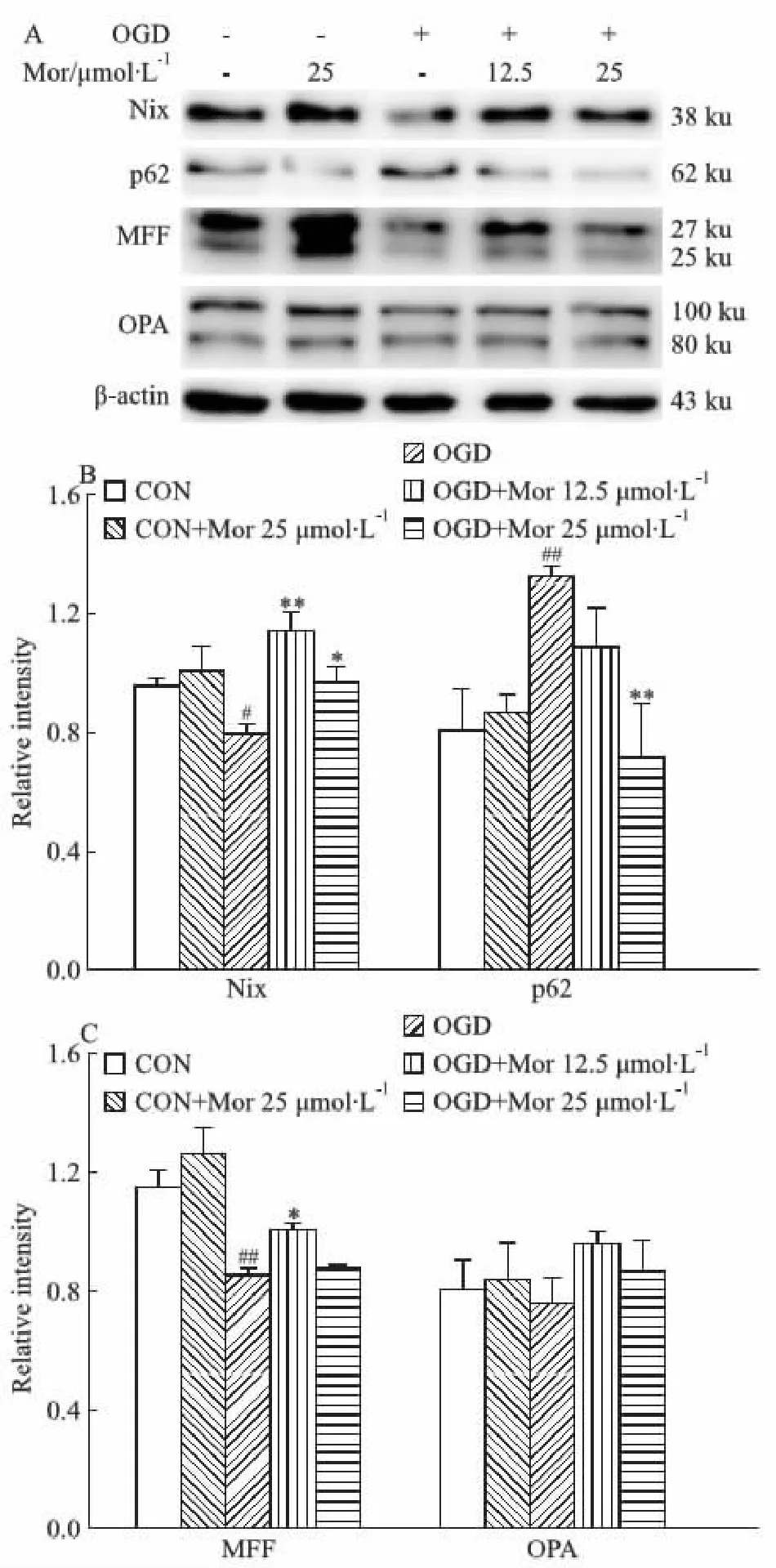
Fig 4 Effects of morroniside on mitochondria quality control in OGD model of rat primary cortical A:Representative images of Western blot for Nix, p62, MFF, and OPA;B:Quantitative analysis of Nix and p62;C:Quantitative analysis of MFF and OPA. β-actin served as an internal loading control.#P<0.05,##P<0.01 vs CON group;*P<0.05,**P<0.01 vs OGD group. OGD: oxygen-glucose deprivation; CON: control; Mor: morroniside.
AMPK-ULK-Beclin通路是调控自噬启动的重要通路。本研究的Western blot结果显示,OGD模型组AMPKα在Thr172位点的磷酸化、ULK1在Ser555位点的磷酸化及Beclin 1的表达均明显降低(P<0.05,P<0.01,P<0.05),表明AMPK/ULK/Beclin 1通路被抑制。莫诺苷孵育能使OGD细胞中AMPKα和ULK1的磷酸化以及Beclin 1的表达水平明显增高(P<0.01,P<0.05;Fig 5),表明莫诺苷可激活AMPK-ULK-Beclin通路。
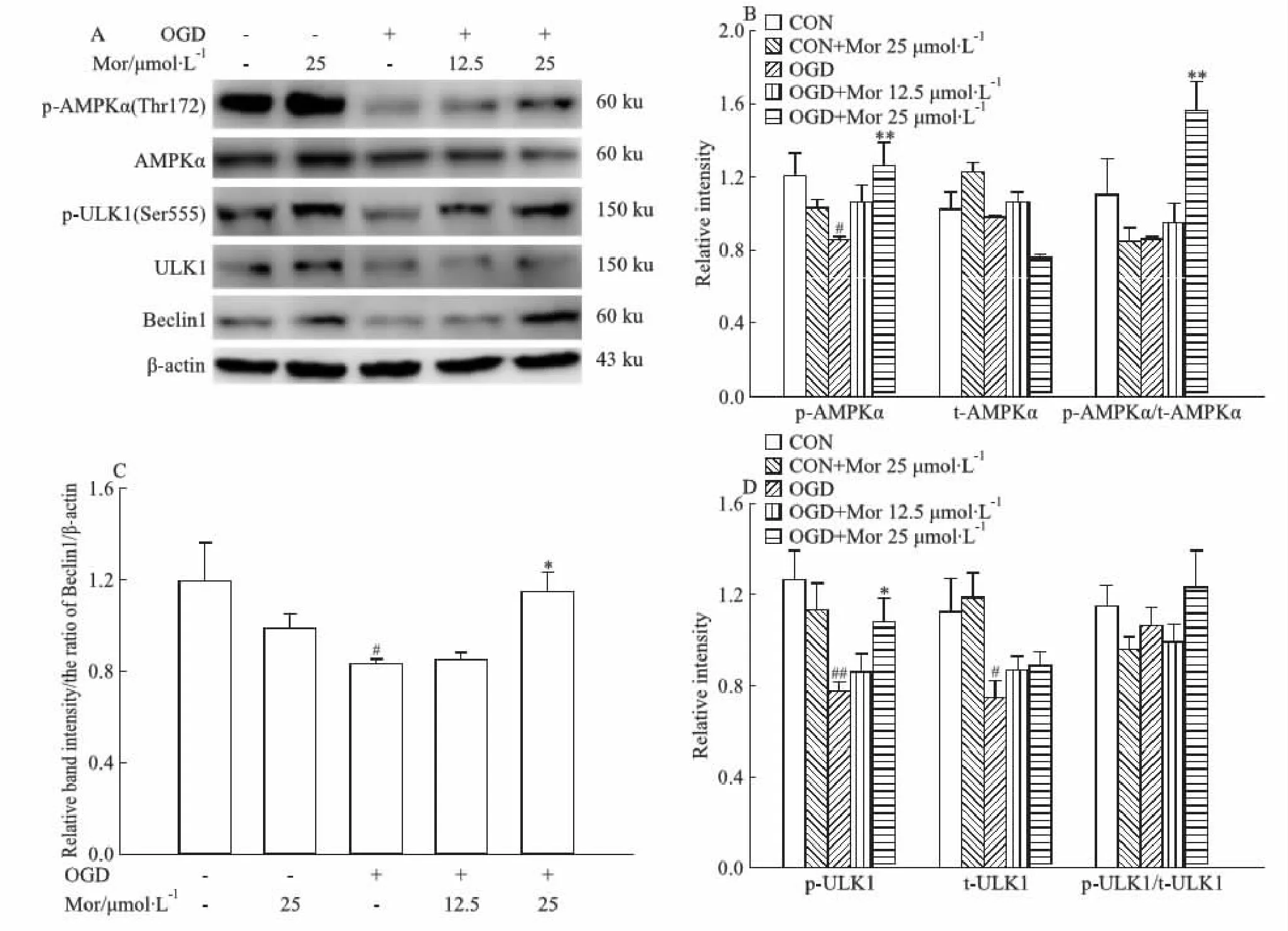
Fig 5 Effects of morroniside on AMPKα/ULK1/Beclin1 pathway in OGD model of rat primary cortical A:Representative images of Western blot for phosphorylated(p-) AMPKα(at Thr172 site),total AMPKα, p-ULK1(at Ser555 site), total ULK1, and Beclin1;B:Quantitative analysis of p-AMPKα(Thr172), AMPKα, andp-AMPKα(Thr172)/AMPKα;C:Quantitative analysis of p-ULK1(Ser555), ULK1, and p-ULK1(Ser555)/ULK1.(D) Quantitative analysis of Beclin1. β-actin served as an internal loading control.#P<0.05,##P<0.01 vs CON group;*P<0.05,**P<0.01 vs OGD group. OGD: oxygen-glucose deprivation; CON: control; Mor: morroniside; AMPK: adenosine monophosphate-activated protein kinase.
3 讨论
脑缺血导致各种损伤的始动因素是细胞或组织缺乏氧及能量的供应。本研究首先在大鼠原代皮层神经元上建立OGD损伤模型,模拟神经元在缺血损伤后的病理改变。结果发现,OGD损伤后加入莫诺苷干预可明显增加神经元细胞存活率,表明莫诺苷可对抗缺氧缺糖损伤,保护神经元。
脑缺血引起神经元损伤的诸多机制学说复杂,各学说之间互为因果,互相关联[10],其中能量代谢障碍是各损伤机制的首发环节。脑缺血发生后,最先影响的是缺血组织的血氧供应下降,持续缺血缺氧状态可严重损害脑氧合状态及线粒体功能,致使大脑细胞能量耗竭,进一步引发系列复杂的级联反应,最终导致细胞死亡及神经功能障碍[2]。线粒体作为细胞的“能量中心”,首当其冲成为脑缺血后受损的首要靶区,其功能状态同时是影响神经元是否可以存活的重要元素[11]。神经元内线粒体在缺血后迅速发生病理变化,其中线粒体膜电位(MMP)下降反映线粒体早期损伤,决定线粒体的功能状态。MMP的改变可进一步诱发细胞离子代谢异常,引起细胞内钙超载等。而过多的钙离子沉积在线粒体上更加重了膜电位的崩解并引起细胞凋亡[11-12]。本研究结果显示,OGD损伤引起神经元MMP下降,细胞内钙离子浓度异常增高;莫诺苷处理能有效恢复MMP及细胞内钙浓度至正常水平,减轻OGD诱导的线粒体损伤。
MQC负责调控细胞内线粒体的形态及功能的完整性,及时处理各种病理生理状态下包括脑缺血后引起的线粒体损伤,维持线粒体稳态[4]。本研究基于MQC理论,进一步探讨莫诺苷减轻线粒体损伤的作用机制,检测了各过程的标记蛋白─线粒体自噬相关蛋白Nix、线粒体分裂因子MFF、线粒体融合蛋白OPA等的表达变化情况。Nix是定位于线粒体外膜的线粒体膜表面结合蛋白,主要负责调控缺氧或饥饿状态下的线粒体自噬[13]。p62是自噬底物标志物。当细胞内自噬过程正常进行时,p62在自噬体与溶酶体快速结合后即被降解;而当自噬过程被抑制,自噬体的过多积累,使得p62不能被及时降解,其表达水平升高。因此,可以用p62的蛋白表达水平作为自噬能力变化的指征[14]。本研究发现,OGD模型组神经元线粒体自噬相关蛋白Nix表达减低,自噬底物蛋白p62表达增高,提示线粒体自噬受到抑制。莫诺苷能够减轻OGD诱导的Nix表达下降,同时降低自噬底物蛋白p62的表达,提示莫诺苷可激活线粒体自噬,促进受损线粒体的清除。另一方面,OGD损伤对线粒体融合蛋白OPA无明显影响,但减少了负责线粒体分裂过程的MFF表达,阻碍线粒体分裂;而莫诺苷可改善这一变化,增高MFF的表达。
已有研究表明,自噬的启动需要ULK复合物的激活,AMPK-ULK-Beclin通路在其中发挥重要调节作用。AMPK活化后可促进ULK1在Ser555的磷酸化使ULK1激活,活化的ULK1进一步促进Beclin1诱导自噬启动[15-16]。本研究结果显示,OGD损伤导致神经元内AMPK和ULK1的磷酸化水平以及Beclin1的表达降低,提示AMPK-ULK-Beclin通路活性降低,被OGD损伤所抑制。莫诺苷可明显增高OGD细胞AMPKα和ULK1的磷酸化以及Beclin1的表达水平,提示莫诺苷可能通过上调AMPK-ULK-Beclin通路而激活神经元线粒体自噬。
综上所述,本研究在原代神经元OGD模型中发现,莫诺苷能够增高细胞存活率,具有神经保护作用,其作用机制包括通过上调AMPK-ULK-Beclin通路,激活线粒体自噬,促进线粒体分裂,改善MQC,从而减轻线粒体损伤,保护神经元抵抗缺氧缺糖损伤。
