枸杞多糖通过TLR2-NF-κB/p38调控树突状细胞的成熟
2020-10-18张晓羽兰亚如张晓娣杨浩凯李飞龙薛晓楠苏春霞
张晓羽,兰亚如,张晓娣,杨浩凯,李飞龙,薛晓楠,吴 成,王 琦,苏春霞
(宁夏医科大学基础医学院,宁夏 银川 750004)
枸杞是一种传统中草药,枸杞多糖(lycium barbarum polysaccharides,LBP)是其主要生物活性成分[1],由阿拉伯糖、葡萄糖、半乳糖、甘露糖、木糖、鼠李糖6种单糖组成,具有多种生物学和药理学功能,包括抗氧化、抗炎、抗癌和抗辐射活性等[2-5]。已经报道了LBP的许多有益健康的影响,例如免疫调节、抗应激、抗结肠癌、神经保护和抗糖尿病作用[5-8]。一些研究还发现LBP具有心肌保护、眼睛保护、抗辐射损伤和抗衰老作用。在免疫学方面LBP主要调节T细胞、CTL细胞、NK细胞、腹腔巨噬细胞及树突状细胞(dendritic cells,DC)的功能。有研究表明,LBP(100 g·L-1)可增加骨髓来源树突状细胞(bone marrow-derived dendritic cells, BMDCs)中Ⅰ-A/Ⅰ-E和CD11c的共表达以及IL-12 p40的分泌,这表明LBP能够在体外促进小鼠BMDCs的表型和功能成熟[9]。LBP还可以上调CD40、CD80、CD86和MHC Ⅱ类分子,下调DC对抗原的摄取,增强DC的共刺激活性,并诱导IL-12p40和p70产生[2]。然而,LBP发挥作用的分子机制尚未阐明。
目前,一般认为Toll样受体(Toll like receptor,TLR)4/2是多糖的主要受体。 一位日本学者首先报道,红花多糖通过Toll样受体4激活转录因子NF-κB并诱导细胞因子的产生[10]。大量研究表明,几种多糖可显着激活巨噬细胞中TLR4-MAPK信号通路并诱导TNF-α,IL-1β和IFN-α/β的产生[11]。在本研究中,我们探讨了LBP能否通过TLR2-NF-κB调控BMDC。
1 材料与方法
1.1 实验材料SPF级,6~8周C57BL/6小鼠购自北京维通利华实验动物技术有限公司(动物合格证号:SCXK(京)2016-0006)。枸杞多糖(纯度>90%)购自陕西杨凌慈缘生物技术有限公司;脂多糖(纯度≥99%)购自Biotopped公司。GM-CSF和IL-4均购自Peprotech公司;C29购自Ab Mole公司,红细胞裂解液购自Solarbio公司,BI 1640培养基、BI胎牛血清(fetal bottles bovine,FBS)购自BI公司,青霉素-链霉素购自Solarbio公司,凯基全蛋白提取试剂盒、凯基BCA蛋白定量试剂盒、ECL发光液均购自kaiji公司;β-actin、TLR2、NF-κB、p38探针购自美国Thermo Fisher公司;TLR2兔单克隆抗体、NF-κB兔单克隆抗体、p-NF-κB兔单克隆抗体、p38兔单克隆抗体、p-p38兔单克隆抗体均购自美国CST公司;RNA提取试剂盒(离心柱式)购自上海碧云天生物技术有限公司;逆转录试剂盒购自美国Thermo Fisher公司;购自Z383型水平离心机,德国Hermle Labortechnik GmbH公司;多功能酶标仪(Thermo,美国);化学发光成像系统(Amersham Imager 600)。
1.2 细胞培养及给药取6~8周C57BL/6小鼠,无菌取出股骨和胫骨,分离骨髓细胞,用含RPMI 1640、10%胎牛血清、1%青霉素-链霉素的完全培养基培养4 h后,弃去非贴壁细胞,用含20 μg·L-1GM-CSF、20 μg·L-1IL-4的RPMI 1640完全培养基,37° 5% CO2培养箱培养。隔天半量换液。d 7,收集悬浮及半贴壁细胞分别用低浓度(50 mg·L-1)、中浓度(100 mg·L-1)、高浓度(200 mg·L-1)枸杞多糖,脂多糖(100 μg·L-1)(作为阳性对照)、RPMI 1640(作为阴性对照)。
1.3RT-qPCR按上述方法收获用不同处理组的细胞后,严格按照RNA提取试剂盒提出RNA,测浓度,加入20 μL体系进行逆转录,最后用RT-qPCR试剂进行PCR。
1.4Westernblot按上述方法收获用不同处理组的细胞后,严格按照全蛋白提取试剂盒操作。BCA法测蛋白浓度。8% SDS-PAGE凝胶电泳,5%脱脂奶粉封闭90 min;放入一抗工作液,4 ℃孵育过夜;PBST洗膜,10 min×3次;放入相应二抗工作液中,室温90 min;PBST洗膜,10 min×3次;ECL显影,用ImageJ软件对条带进行灰度值检测,结果用计算公式:目的蛋白的相对表达量=目的蛋白光密度值/β-actin光密度值。

2 结果
2.1 LBP对BMDC中TLR2、NF-κB、p38 mRNA的影响qRT-PCR检测结果显示,RPMI 1640组、50 mg·L-1LBP组、100 mg·L-1LBP组和200 mg·L-1LBP组和100 μg·L-1LPS组TLR2 mRNA的相对表达量分别为(6.55±0.20)、(8.83±1.29)、(9.29±2.71)、(11.66±3.67)和(9.71±3.05)(Fig 1A)。与RPMI 1640组比较,200 mg·L-1LBP组(P<0.05)中TLR2的mRNA表达水平明显升高,差异有统计学意义(Fig 1A)。
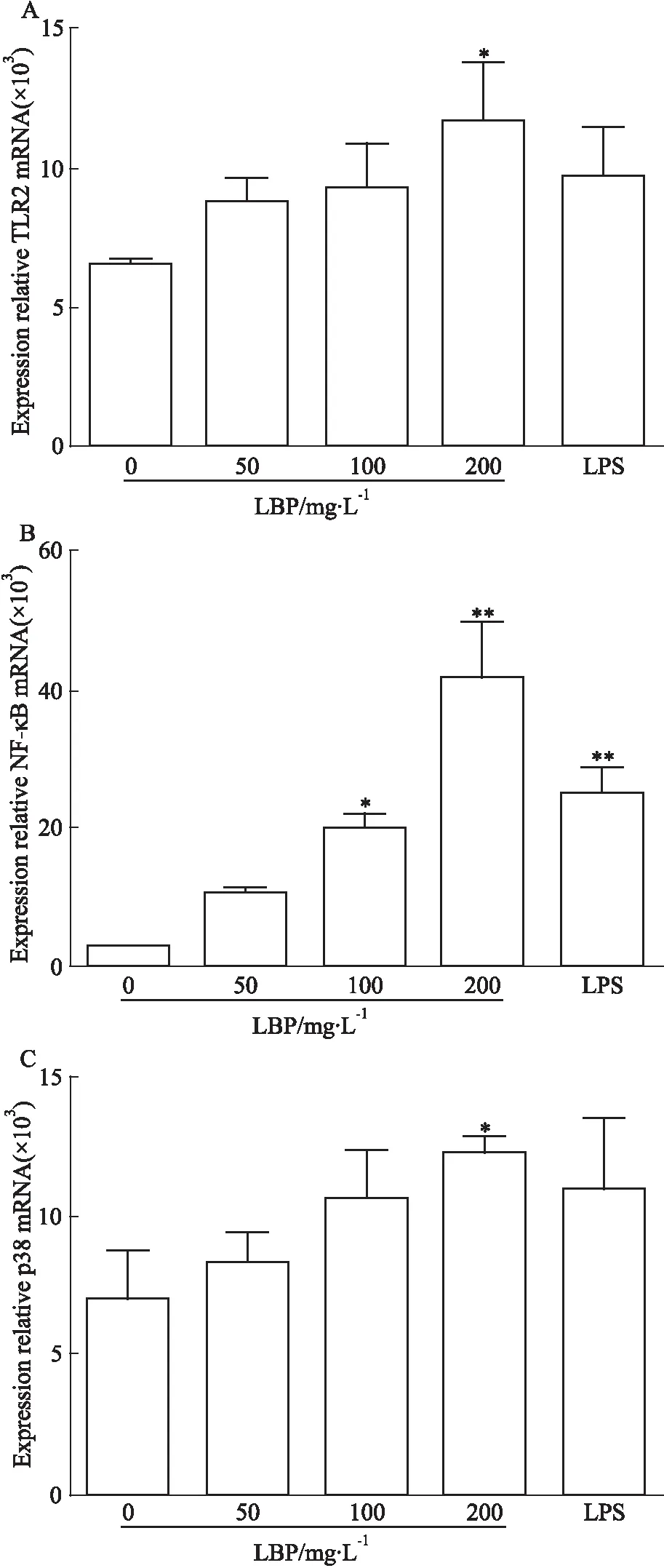
Fig 1 Effect of LBP on TLR2, NF-κB,and p38 mRNA expression in *P<0.05,**P<0.01 vs control
RPMI 1640组、50 mg·L-1LBP、100 mg·L-1LBP组、200 mg·L-1LBP组和100 μg·L-1LPS组NF-κB mRNA的相对表达量分别为(3.27±0.18)、(10.83±0.77)、(20.42±3.07)、(41.61±14.12)和(25.32±5.97)(Fig 1B)。与RPMI 1640组比较,各组NF-κB的mRNA表达水平均明显升高,差异有统计学意义。
RPMI 1640组、50 mg·L-1LBP、100 mg·L-1LBP组、200 mg·L-1LBP组和100 μg·L-1LPS组p38 mRNA的相对表达量分别为(7.06±2.93)、(8.27±1.88)、(10.65±2.94)、(12.27±1.02)(11.01±4.28)(Fig 1C)。与RPMI 1640组比较,200 mg·L-1LBP组(P<0.05)中p38的mRNA表达水平升高,差异有统计学意义。
2.2 LBP对BMDC中TLR2、p-NF-κB、NF-κB 、p-p38及p38蛋白表达水平的影响Western blot检测结果显示,RPMI 1640组、50 mg·L-1LBP、100 mg·L-1LBP组、200 mg·L-1LBP组和100 μg·L-1LPS组TLR2蛋白相对表达量分别为(0.64±0.12)、(0.95±0.12)、(1.08±0.09)、(1.14±0.12)、(1.00±0.26)(Fig 2B)。与RPMI 1640组比较,各组中TLR2蛋白表达水平明显升高,差异有统计学意义(Fig 2B)。
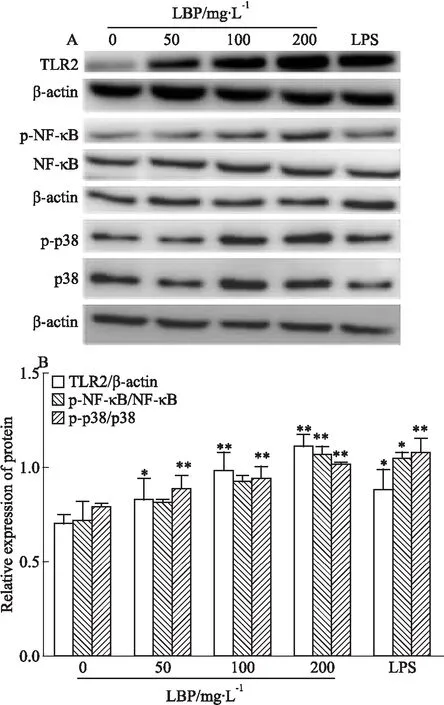
Fig 2 Effect of LBP on TLR2, NF-κB, p-NF-κB,p38, p-p38 protein expression in *P<0.05,**P<0.01 vs control
RPMI 1640组、50 mg·L-1LBP、100 mg·L-1LBP组、200 mg·L-1LBP组和100 μg·L-1LPS组p-NF-κB/NF-κB 蛋白相对表达量分别为(0.68±0.03)、(0.71±0.07)、(0.71±0.01)、(0.85±0.04)、(1.17±0.14)(Fig 2B)。与RPMI 1640组比较,200 mg·L-1LBP组(P<0.01)、100 μg·L-1LPS组(P<0.05)中p-NF-κB/NF-κB蛋白表达水平明显升高,差异有统计学意义(Fig 2B)。
RPMI 1640组、50 mg·L-1LBP、100 mg·L-1LBP组、200 mg·L-1LBP组和100 μg·L-1LPS组p-p38/p38蛋白相对表达量分别为(0.79±0.01)、(0.84±0.01)、(0.91±0.01)、(1.04±0.04)、(1.09±0.002)(Fig 2B)。与RPMI 1640组比较,各组p-p38/p38蛋白表达水平明显升高,差异有统计学意义(Fig 2B)。
2.3 C29(TLR2阻断剂)对 LBP诱导的BMDC中TLR2、NF-κB、p38 mRNA表达水平的影响qRT-PCR检测结果显示,RPMI 1640+C29组、RPMI 1640组,100 μg·L-1LPS+C29组、100 μg·L-1LPS组和200 mg·L-1LBP+C29组、200 mg·L-1LBP TLR2 mRNA的相对表达量分别为(9.83±1.58)、(10.74±1.82)、(9.79±1.05)、(15.02±1.78)、(9.47±0.72)和(14.5±1.45)(Fig 3A);NF-κB mRNA的相对表达量分别为(11.67±3.05)、(13.01±1.05)、(28.67±2.08)、(62.67±8.78)、(25.02±7.21)、(48.35±6.14)(Fig 3B)。p38 mRNA的相对表达量分别为(11.93±0.14)、(11.02±2.48)、(11.01±0.23)、(18.70±2.25)、(13.38±0.13)、(17.19±3.18)(Fig 3C)。与200 mg·L-1LBP组比较,200 mg·L-1LBP+C29组TLR2(P<0.01),NF-κB(P<0.01)的mRNA表达水平均明显降低,差异有统计学意义(Fig 3A,B),p38(P=0.565)的mRNA表达量有减少的趋势,但差异无统计学意义(Fig 3C)。
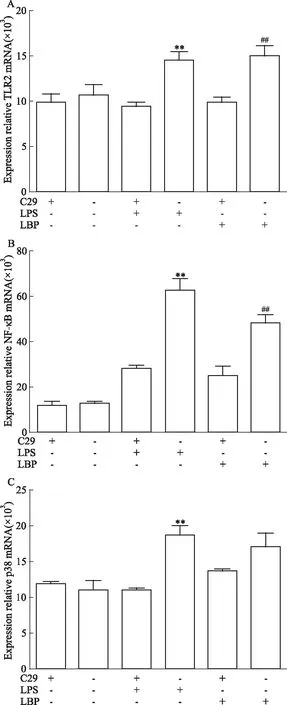
Fig 3 Effect of C29 on TLR2, NF-κB, p38 mRNA expression in BMDCs induced by **P<0.01 vs LPS+C29;##P<0.01 vs LBP+C29
2.4 C29(TLR2阻断剂)对 LBP诱导的BMDC中TLR2、NF-κB、p38蛋白表达水平的影响Western blot检测结果显示,RPMI 1640+C29组、RPMI 1640组,100 μg·L-1LPS+C29组、100 μg·L-1LPS组和200 mg·L-1LBP+C29组、200 mg·L-1LBP TLR2 蛋白相对表达量分别为(0.60±0.01)、(0.69±0.02)、(0.96±0.03)、(1.41±0.05)(1.03±0.06)、(1.66±0.07);pNF-κB蛋白相对表达量分别为(0.72±0.01)、(0.76±0.02)、(0.88±0.01)、(0.95±0.02)、(0.94±0.03)、(0.99±0.01);p-p38蛋白相对表达量分别为(0.46±0.01)、(0.45±0.01)、(0.84±0.02)、(0.86±0.02)、(1.11±0.01)、(1.16±0.02)。见Fig 4。与200 mg·L-1LBP组比较,200 mg·L-1LBP+C29组TLR2(P<0.01),p-NF-κB(P<0.05),p-p38(P<0.01)的蛋白表达水平均明显降低,差异有统计学意义,见Fig 4B。
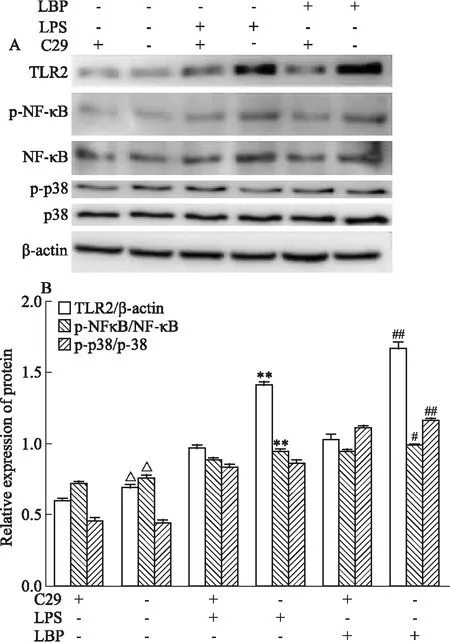
Fig 4 Effect of C29 on TLR2, NF-κB, p-NF-κB, p38, p-p38 protein expression in BMDCs induced by △P<0.05 vs 1640+C29;**P<0.01 vs LPS+C29;#P<0.05,##P<0.01 vs LBP+C29
3 讨论
近年来,人们对枸杞多糖的研究不断深入,作为免疫调节剂不仅可以增强机体免疫、降血脂、抗衰老、抗肿瘤作用,并且来源广泛,毒副作用小[12]。LBP作为新型的免疫调节剂其发挥免疫调节作用的主要靶细胞为巨噬细胞、淋巴细胞、NK细胞、DC。有研究发现,枸杞多糖蛋白复合物(polysaccharide-protein complex from L. barbarum,LBP3p) 显著增强巨噬细胞的吞噬作用并抑制可移植肉瘤S180的生长[13]。此外,从枸杞果实中分离得到的LBP可以抑制HeLa细胞的增殖[14],刺激小鼠腹膜巨噬细胞产生TNF-α和IL-1β,并以TLR4依赖性方式促进淋巴细胞的增殖[11]。
DC最作为有效的抗原呈递细胞之一,是固有免疫和适应性免疫之间的桥梁,是免疫应答的发起者和调节者。最近研究显示,LBP在体内外均可上调DC表面分子MHCII、CD40、CD80、CD86的表达,并促进DC分泌IFN-γ、 TNF-α 、IL-4 和 IL-6,诱导DC表型和功能的成熟,但其是否通过TLR2调控BMDC的分子机制尚未阐明。
TLRs是一类在宿主免疫系统中具有重要作用的模式识别受体,其通过信号转导活化NF-κB/ MAPK诱导各种细胞因子的释放参与机体炎症反应、免疫应答及组织修复等过程。其中TLR2是介导炎症反应的TLRs-NF-κB/ MAPK信号通路上的重要成员[15]。本研究在转录水平发现200 mg·L-1LBP可以明显上调BMDC中TLR2、p38 mRNA表达水平,50、100、200 mg·L-1LBP以浓度依赖的方式诱导BMDC中NF-κB mRNA的表达;Western blot结果显示,在翻译水平LBP可以促进TLR2、p-NF-κB、p-p38蛋白的表达,提示LBP可以诱导TLR2、NF-κB、p38基因翻译为有功能的蛋白而发挥作用。为了进一步研究LBP是否通过TLR2-NF-κB/MAPK p38通路调控DC,TLR2抑制剂C29阻断DC中TLR2后,分别从mRNA和蛋白水平检测下游分子NF-κB、 p38的表达。阻断实验发现,阻断TLR2后DC中NF-κB 和p38磷酸化蛋白的表达均明显减少,提示LBP通过TLR2-NF-κB/MAPK p38通路调控DC。另外,C29对DC中p38 mRNA表达的影响还有待进一步探讨。
综上所述,本研究发现LBP可能通过诱导BMDC表面TLR2的表达促进下游NF-κB/p38的活化,从而促进BMDC的成熟,为进一步研究LBP作为免疫调节剂调控BMDC的分子机制提供理论依据。
