河南郑州地区奶牛源安氏隐孢子虫虫种鉴定及多位点序列分型研究
2020-10-14郑双健李东方陈远才曹乐天王璐阳黄建营刘东海张龙现
郑双健,李东方,陈远才,曹乐天,王璐阳,黄建营,刘东海,李 豪,张龙现*
(1.河南农业大学 牧医工程学院 河南省人兽共患病国际联合实验室,河南 郑州 450046;2.河南省奶牛生产性能测定有限公司,河南 郑州 450046)
1971年PANCIER等[1]首次报道牛隐孢子虫(Cryptosporidiumandersoni,C.andersoni)病,引起世界各地广泛关注[2]。目前,隐孢子虫有37个有效种被鉴定出来[3-5],以牛为自然宿主的隐孢子虫主要包括:微小隐孢子虫(C.parvum)、牛隐孢子虫(C.bovis)、瑞氏隐孢子虫(C.ryanae)和安氏隐孢子虫(C.andersoni),其中微小隐孢子虫(C.parvum)主要感染断奶前犊牛;牛隐孢子虫(C.bovis)和瑞氏隐孢子虫(C.ryanae)主要感染断奶后犊牛;而安氏隐孢子虫(C.andersoni)主要感染青年牛和成年牛。因上海浦东地区某医院腹泻病人和江苏某门诊病人体内的暴发[6-7],C.andersoni引起人们关注。
然而,由于C.andersoni与鼠隐孢子虫(C.muris)在形态上非常相似,直至2000年,C.andersoni才被LINDSAY等[8]通过对其传播研究及分子生物学研究命名为一新物种。C.andersoni的准确鉴定仍然依赖于分子手段。本研究通过对郑州地区奶牛隐孢子虫进行显微镜检测及C.andersoni不同亚型分子鉴定,以期了解郑州地区奶牛隐孢子虫的感染情况及C.andersoni的亚型分布情况。
1 材料与方法
1.1 样品采集于2017年12月28日—2018年1月18日,分多次对河南省郑州地区3个奶牛场不同年龄段奶牛进行直肠采样,共收集新鲜粪便样品973份,其中包括:奶牛场A共采集685份(0~2月龄169份、3~6月龄4份、7~13月龄161份、14月龄产犊前116份、泌乳牛235份),奶牛场B和奶牛场C分别采集49份和239份(均为泌乳牛)。每份样品约20 g,分别装入洁净的一次性手套内并记录基本信息,如:牛号、养殖方式、年龄、临床症状、厂区防疫等,并于当天带回实验室保存在4℃冰箱中,48 h内进行显微镜检测。
1.2 显微镜检测采用离心沉淀法和饱和蔗糖溶液漂浮法对样品进行处理,然后使用显微镜对隐孢子虫卵囊进行形态学鉴定[9]。
1.3 DNA提取称取200 mg粪便样品,严格按照粪便DNA提取试剂盒(E.Z.N.A.Stool DNA Kit,D4015-02)说明进行操作,试剂盒购自郑州科贸生物技术有限公司,提取DNA保存于-20℃保存。
1.4 PCR扩增分别基于SSU rRNA[10-11]、Actin[12]、HSP70[13]和COWP[14]基因位点对隐孢子虫进行虫种鉴定,再分别基于CM-MS1、CM-MS2、CM-MS3和CM-MS16[15]基因位点对隐孢子虫进行亚型鉴定。不同基因位点PCR引物序列、退火温度和目的片段大小见表1,除使用ExTaq酶对COWP基因以及使用KOD-Plus酶对HSP70基因进行共计1轮PCR扩增外,其他基因位点均使用KOD-Plus酶进行巢氏PCR扩增。引物由生工生物工程(上海)股份有限公司合成,KOD-plus酶(日本TOYOBO公司)和ExTaq酶(日本TaKaRa公司)购自郑州科贸生物技术有限公司。
1.5 测序PCR产物测序由郑州擎诚生物科技有限公司进行双端测序,将得到测序结果根据测序图谱进行碱基序列校正,拼接完成后在GenBank上进行同源序列搜索,使用软件Clustal X 2.13(http://www.clustal.org/)进行比对分析,以对隐孢子虫虫种进行鉴定,再根据FENG等[15]和WANG等[16]的重复序列进行MLST亚型鉴定。
1.6 种系发育关系分析使用Mega7.0(https://www.megasoftware.net)软件对进化树进行构建,采用邻接法(Neighbour-joining)对其进行种系发育分析,设置1 000个重复,所需基因序列下载自GenBank。
1.7C.andersoni卵囊测定依次采用离心沉淀法、蔗糖密度梯度离心法[17]和氯化铯密度梯度离心法[18]对阳性样品进行卵囊纯化处理,使用微分干涉显微镜进行拍照及测定卵囊的长、宽和卵囊指数(长/宽)。
1.8 统计学分析采用χ2检验分别对不同年龄段和不同采样地点奶牛隐孢子虫感染情况差异显著性进行分析,再采用单因素方差分析对C.andersoni不同MLST亚型卵囊的长、宽和卵囊指数(长/宽)差异显著性进行分析,P<0.05差异显著。

表1 引物的序列及退火温度
2 结果
2.1 河南郑州地区奶牛隐孢子虫感染情况隐孢子虫总感染率为2.77%(27/973)。不同年龄段之间隐孢子虫感染率差异显著(P<0.05),且以断奶前犊牛感染率最高7.10%(12/169),其他年龄段均处于较低感染水平,如:育成牛0.62%(1/161)、青年牛3.45%(4/116)、泌乳牛1.91%(10/523),而在断奶后犊牛未发现隐孢子虫感染。此外,3个奶牛场之间隐孢子虫感染率差异不显著(P>0.05),仅在奶牛场A和C发现隐孢子虫感染,感染率分别为2.77%(19/685)和3.35%(8/239),而在奶牛场B未发现隐孢子虫感染(表2)。
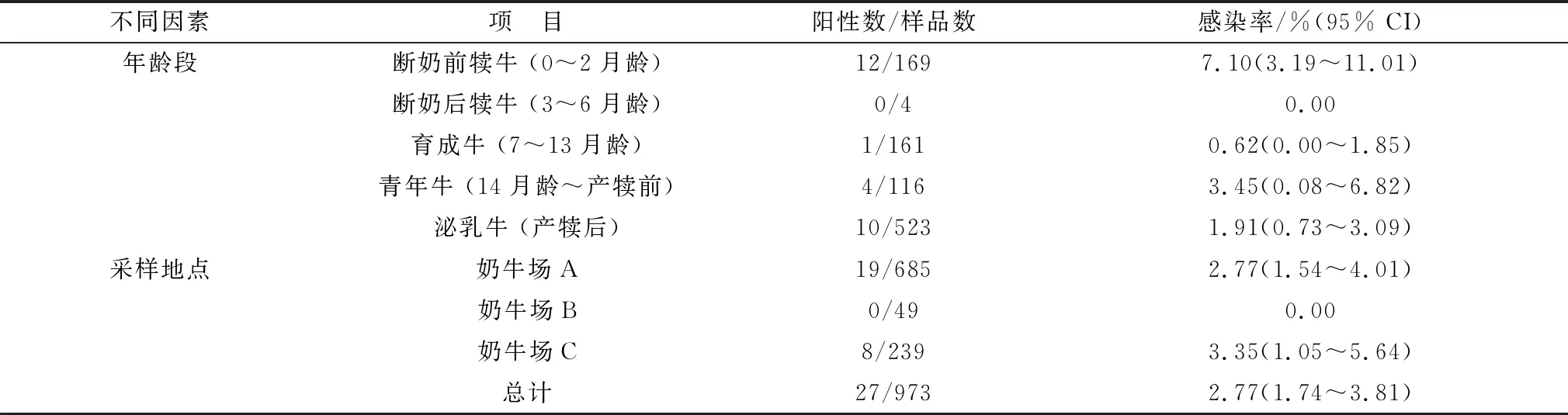
表2 河南郑州地区奶牛隐孢子虫感染情况
2.2 隐孢子虫的虫种鉴定经显微镜形态学鉴定为C.andersoni的8份泌乳牛粪便样品分别基于隐孢子虫SSU rRNA、Actin、HSP70和COWP基因进行PCR扩增,均成功扩增出目的片段,大小分别约为840,818,494,500 bp(图1)。8份样品在各个位点均被成功测序,拼接后序列比对结果均显示为C.andersoni阳性,仅在HSP70基因位点存在1个碱基差异。
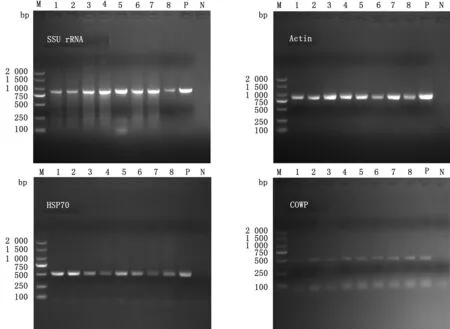
图1 隐孢子虫SSU rRNA、Actin、HSP70和COWP基因PCR扩增结果 M.DL2000 DNA Marker;1~8.样品;P.阳性对照;N.阴性对照
2.3C.andersoni的MLST亚型鉴定经分子鉴定为C.andersoni的8份DNA样品分别基于CM-MS1、CM-MS2、CM-MS3和CM-MS16 4个位点进行PCR扩增,均成功扩增出目的片段,目的片段大小分别约为550,457,536,597 bp(图2)。8份样品在各个位点均被成功测序,拼接后序列比对结果显示均被成功分型,分别在CM-MS1、CM-MS2、CM-MS3和CM-MS16 4个基因位点分别鉴定出3,2,2,1个亚型,共形成4个MLST亚型,其中A4、A4、A4和A1为优势MLST亚型,分布于3头奶牛中;A6、A4、A2和A1为新MLST亚型,分布于2头奶牛中;A4、A5、A4和A1分布于2头奶牛中以及A2、A4、A2和A1分布于1头奶牛中。进化树分析结果与序列比对分析结果一致(图3)。
2.4C.andersoni不同MLST亚型的卵囊测定卵囊测定结果显示:卵囊呈圆形或椭圆形,C.andersoni卵囊大小为:(7.40±0.55) μm ×(5.99±0.49) μm,卵囊指数为1.24±0.11。C.andersoni不同MLST亚型卵囊的长、宽和卵囊指数(长/宽)差异显著(P<0.05),不同亚型卵囊大小如下:MLST亚型A4、A4、A4和A1为:(7.46±0.55) μm ×(5.93±0.58) μm,卵囊指数为1.27±0.11;MLST亚型A6、A4、A2和A1为:(7.37±0.52) μm ×(6.06±0.47) μm,卵囊指数为1.22±0.12;MLST亚型A2、A4、A2和A1为:(7.55±0.61) μm ×(6.15±0.35) μm,卵囊指数为1.23±0.12;MLST亚型A4、A5、A4和A1为:(7.26±0.53) μm ×(5.94±0.36) μm,卵囊指数为1.23±0.10(表3),不同分离株部分卵囊见图4。
图2 C.andersoni 4个基因位点部分PCR扩增结果 M.DL2000 DNA Marker;1~4.CM-MS1位点;5~8.CM-MS2位点;9~12.CM-MS3位点;13~16.CM-MS16位点;P1~P4.阳性对照;N1~N4.阴性对照

图3 基于CM-MS1、CM-MS2、CM-MS3和CM-MS16 4个基因序列构建的邻接进化树

表3 C.andersoni虫分离株的卵囊测定 μm
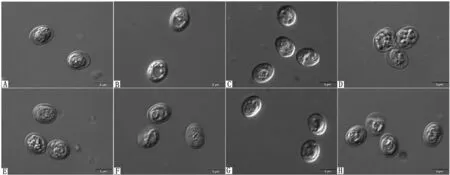
图4 部分C.andersoni的卵囊 A.1066样品;B.3023样品;C.3037样品;D.1067样品;E.2006样品;F.3056样品;G.9038样品;H.722样品
3 讨论
本次对河南郑州地区奶牛隐孢子虫调查发现,总体处于较低感染水平,总感染率为2.77%(27/973),低于广东(4.38%,63/1 440)[19]、广西(8.16%,35/429)[20]、上海(13.65%,67/491)[21]、江苏(19.09%,251/1 315)[21]以及台湾(37.61%,173/460)[22],但是高于甘肃(1.85%,42/2 276)[23]地区。此外,本研究也与WANG等[24]发现隐孢子虫感染率随着奶牛年龄的增长而呈现下降的结论基本一致。研究发现,在我国奶牛中存在多种不同隐孢子虫混合感染组合现象[25],如:C.parvum+C.bovis、C.parvum+C.ryanae、C.parvum+C.andersoni以及C.bovis+C.ryanae,然而在本研究中未检测出混合感染现象。不同地区奶牛隐孢子虫感染情况存在差异的原因很多,可能与不同的检测手段、地理环境、养殖模式等因素有关。
基因gp60作为对隐孢子虫亚型鉴定的常见位点,主要集中于微小隐孢子虫(C.parvum)和人隐孢子虫(C.hominis)的群体遗传结构的分析,却无法对C.andersoni进行亚型鉴定。自2011年ENG等[15]基于C.muris基因组数据建立C.andersoni4个基因位点CM-MS1、CM-MS2、CM-MS3和CM-MS16的MLST分型工具之后,目前研究表明国内奶牛源C.andersoni共发现20种MLST亚型结构:A1、A2、A4、A1,A1、A4、A2、A1,A1、A4、A4、A1,A2、A1、A2、A1,A2、A1、A3、A1,A2、A4、A2、A1,A2、A4、A4、A1,A2、A5、A2、A1,A2、A6、A2、A1, A2、A7、A4、A1,A3、A4、A4、A1,A4、A4、A2、A1,A4、A4、A4、A1,A4、A4、A5、A1,A4、A5、A2、A1,A4、A5、A4、A1,A4、A8、A4、A1,A4、A9、A4、A1,A5、A4、A4、A1和A7、A4、A4、A1,其中多数研究表明A4、A4、A4和A1在奶牛源C.andersoni中分布广泛,为优势亚型[16,19,26-30],与本研究中A4、A4、A4和A1为优势亚型结果一致。但是在一些报道中也存在一定的差异,如:ZHAO等[29]发现陕西省奶牛源C.andersoniMLST优势亚型为A1、A4、A4和A1,而在国外,如美国常见亚型为:A2、A3、A2、A1,A2、A3、A1、A1和A2、A3、A4、A1;加拿大则常见亚型为:A2、A3、A4和A1;捷克共和国则常见亚型为:A2、A3、A4、A1和A1、A3、A4、A1[15]。国内外C.andersoni亚型分布的不同也直接证明了中国奶牛源C.andersoni的流行并不是由于从国外引进奶牛所导致的。此外,与已报道C.andersoniMLST亚型相比较,本研究发现的MLST亚型A6、A4、A2和A1为新亚型。结果表明C.andersoni的遗传特性差异可能与C.parvum和C.hominis一样,存在地理隔离特征。
目前,C.andersoni卵囊形态鉴定仅限于虫种的鉴定,并未涉及到不同亚型的对比研究。LINDSAY等[8]测定发现C.andersoniVS1742分离株卵囊大小为:(8.4±0.3) μm ×(6.2±0.2) μm(8.0~9.2 μm×5.8~6.4 μm,n=20),卵囊指数为1.35(1.25~1.59);C.andersoniKSU-3分离株卵囊大小为:(7.7±0.3) μm ×(5.9±0.3) μm(7.2~8.2 μm×5.6~6.4 μm,n=20),卵囊指数为1.32(1.13~1.46);C.andersoniVMTRC49分离株卵囊大小为:8.0 μm ×6.2 μm(7.4~8.8 μm×5.8~6.6 μm,n=20),卵囊指数为1.28(1.19~1.40)。齐萌等[31]对河南地区不同C.andersoni分离株测定结果显示,卵囊平均大小为:7.8 μm ×6.4 μm(5.3~8.1 μm×4.2~6.6 μm,n=100),卵囊指数为1.22。在未来的研究中,不同地区、不同宿主、不同亚型的C.andersoni卵囊形态学鉴定仍将成为研究重点,以帮助对C.andersoni及其不同亚型卵囊进行准确鉴定。
本研究显示郑州地区奶牛隐孢子虫感染总体处于较低感染水平,但仍然具有人兽共患传播风险,应引起养殖场和畜牧相关管理部门的重视,以降低公共卫生安全威胁。此外,C.andersoni不同亚型的形态学和分子鉴定,为郑州地区奶牛隐孢子虫病的精准防控及人兽共患传播风险的准确评估提供数据支持。
