微小隐孢子虫在HCT-8细胞内的培养
2016-12-01朱惠丽刘利敏王臣荣张素梅张龙现王荣军
朱惠丽,刘利敏,王臣荣,张素梅,张龙现,王荣军
微小隐孢子虫在HCT-8细胞内的培养
朱惠丽1,2,刘利敏1,王臣荣1,张素梅1,张龙现1,王荣军1
目的 将人回盲肠癌(HCT-8)细胞作为微小隐孢子虫IId亚型体外感染对象,观察虫体在细胞中的生长发育过程。方法 将纯化的隐孢子虫IId亚型感染HCT-8细胞,通过Giemsa染色法观察微小隐孢子虫IId亚型在HCT-8细胞中发育过程,运用PCR方法对不同感染时间点的细胞样品DNA进行检测。结果 在感染后72 h内,隐孢子虫出现连续发育阶段,包括脱囊、子孢子、滋养体、裂殖体、配子体、合子和卵囊;PCR的检测结果显示,在感染细胞96 h仍能检测到虫体DNA。结论 通过HCT-8细胞,观察到微小隐孢子虫IId亚型的完整的生长发育过程,为抗隐孢子虫药物的筛选提供理论基础,亦可成为微小隐孢子虫IId亚型卵囊体外扩增的方法。
微小隐孢子虫;感染模型;HCT-8细胞;培养
Invitroculture ofCryptosporidiumparvumin HCT-8
隐孢子虫(Cryptosporidium)是一种引起人兽共患病的机会性原虫,其严重威胁免疫功能低下及免疫功能缺陷者的生命安全,特别是艾滋病患者[1]。隐孢子虫可以感染包括人和其他哺乳动物、鸟类、爬行类、两栖类和鱼类的240多种动物[2],造成重大经济影响和社会影响。同时,隐孢子虫病也是一种重要的食源/水源性疾病, 从2004年至2010年12月,全球有记录的水源性隐孢子虫病暴发共120起,与饮用水和娱乐水相关的暴发占46%和54%[3]。在我国的水体系统中,隐孢子虫的分布也极其广泛,在河水、水库和饮用原水中均检测到有隐孢子虫。隐孢子虫已被我国列为城市用水和饮用水的监测指标之一。
尽管相关的隐孢子虫的研究报道有很多,但对该病的致病机制仍不明晰,亦无有效的药物或疫苗治疗这种原虫病[1]。近年来,体外培养作为研究隐孢子虫生活史、感染机制和药物筛选的手段已取得了一定的进展[4-10]。但是这些研究方法通常需要借助免疫荧光、激光共聚焦和电镜等技术,这些方法试验周期长,时常存在假阳性等缺陷。因此,建立一种简便快捷和易于观察的隐孢子虫体外培养方法势在必行。
微小隐孢子虫(Cryptosporidiumparvum)作为人类隐孢子虫病的重要病原种类,具有感染谱广,致病性严重,具有重要的公共卫生意义。HCT-8细胞可作为多种隐孢子虫体外培养的宿主细胞,可观察到其各个发育阶段形态特征[11-13]。另外,HCT-8细胞比其他的宿主细胞更有利于C.parvum的培养,因为HCT-8细胞可容许数量较多的C.parvum感染发育,增加感染细胞的数量而有利于观察虫体在细胞的发育过程[14]。
本研究利用HCT-8细胞体外培养C.parvumIId亚型,运用Giemsar染色法观察C.parvumIId亚型在HCT-8细胞中的不同发育阶段特征,对不同感染时间点的细胞样品DNA进行PCR检测,以期为隐孢子虫的药物筛选和致病机制的研究打基础。
1 材料与方法
1.1 虫株和细胞株 通过饱和蔗糖溶液漂浮法从郑州某奶牛场奶牛粪便收集到C.parvumIId亚型卵囊,采用Xiao等方法[15]的方法进行GP60基因扩增测序鉴定为C.parvumIId亚型,用2.5%重铬酸钾4 ℃保存。
HCT-8细胞购自中科院上海细胞库,培养于含10%胎牛血清(FCS)的RPMI1640培养液中,置37 ℃,5% CO2温箱中培养,待细胞生长融合至单细胞层后以胰酶消化,计数,分装6孔板,并观察96 h内HCT-8细胞的生长情况,为虫体感染做准备。
1.2 主要试剂与仪器 RPMI 1640液体培养液购自Giboco公司(4 ℃,避光保存),胎牛血清购自杭州四季青公司,Giemsa染料试剂盒,牛黄胆酸盐和HEPES购自Sigma公司,基因组DNA提取试剂盒和PCR检测试剂盒购自TOYOBO公司,CO2培养箱购自Thermo公司,低温高速离心机Sigma公司,倒置显微镜购自LEICA公司。
细胞接种C.parvumIId亚型卵囊后,应更换为维持培养液,其成分为每100 mL培养基中含0.03 g/L L-谷氨酰胺、0.3 g/L碳酸氢钠、0.02 g/L牛黄胆酸盐、0.1 g葡萄糖、25 μg叶酸,100 μg对氨基苯甲酸、50 μg泛酸钙、875 μg叶酸、2%FCS、15-20 mmol/L HEPES缓冲液、100单位/mL青霉素和0.01 g/mL链霉素,37 ℃,5%CO2培养箱中培养。
1.3 实验方法
1.3.1C.pavumⅡd亚型卵囊大量收集与纯化 从郑州某奶牛场奶牛粪便收集到C.parvumIId亚型卵囊,通过未食初乳的4日龄犊牛进行卵囊的传代扩增,收集排卵囊期间的犊牛粪便溶于蒸馏水,经80目铜筛过滤,滤液3 500 r/min离心10 min,弃上清,加入等体积的乙醚去除粪便中的脂肪,3 500 r/min离心10 min用清水洗3遍,去上清,沉淀加入饱和蔗糖溶液,充分混匀,3 500 r/min离心10 min,用金属吊环收取上层卵囊,加入10倍稀释的蒸馏水混匀,3 500 r/min离心10 min,弃上清,用适量蒸馏水混匀。
卵囊纯化:取50 mL离心管,加入25 mL 1∶1蔗糖溶液30 mL,在蔗糖溶液上层小心加入上述收取卵囊液5 mL,3 600 r/min离心15 min,吸取卵囊带于烧杯中;每次吸取的卵囊带用一定量的蒸馏水稀释并充分混匀之后,离心留沉淀,用适量蒸馏水均匀;根据Arrowood等[16]方法,配制氯化铯(CsCl)工作液,采用离心的方法收取卵囊带去除杂质对卵囊作进一步的纯化;然后纯化的卵囊用5%次氯酸钠4 ℃作用10 min进行无菌化处理,蒸馏水清洗5次,去除残留的次氯酸钠。最后卵囊沉淀用含2% FCS的RPMI 1640维持培养液重悬,用于感染细胞。1.3.2C.pavumIId亚型在细胞中的发育过程观察 将无菌化处理的20 mm盖玻片置6孔板中,在每个盖玻片上中加入10%FCS的RP MI1640培养液,内含有1×105个HCT-8细胞,置37 ℃、5%CO2温箱中培养。待细胞生长融合至85%时,弃掉培养液, 以无菌PBS洗涤2次,每个玻片上接种2×105个处理后的卵囊培养液。2.5 h后弃去未结合细胞的卵囊,换上维持培养液(2% FCS)。分别取感染后2 h、5 h、12 h、18 h、24 h、36 h、48 h、60 h、72 h、96 h、108 h玻片样品,以无菌PBS缓冲液洗涤2次,各个时间点共6份玻片样品,取其中3份样品用微分干涉显微镜观察虫体形态,另外3份样品用甲醇固定后,用Giemsa染色试剂盒进行染色,观察虫体发育情况并照相。同时设空白对照。
1.3.3 用PCR法检测不同时间点细胞样品DNA的GP60基因
1.3.3.1C.pavumIId亚型的细胞培养 细胞培养及卵囊感染同1.3.2,孔板中不加盖玻片。待培养6 h、12 h、24 h、48 h、72 h、96 h后收集上清与细胞后,上清沉淀物保存于-20 ℃用于制备模板DNA,每个时间点设3次重复,同时加空白对照。
每个时间点设3次重复,同时加空白对照。
1.3.3.2 基于GP60基因的PCR检测GP60基因是隐孢子虫基因组中最具多态性的标记基因,是应用最广泛的隐孢子虫亚型靶基因。根据GenBank发表的C.pavumGP60基因序列,应用Primer 5.0生物信息软件设计一对巢式PCR引物,扩增片段为832 bp。引物序列:gp60-F1,5′-ATA GTC TCC GCT GTA TTC-3′,gp60-R1,5′-GGA AGG AAC GAT GTA TCT-3′,gp60-F2,5′-TCC GCT GTA TTC TCA GCC-3′,gp60-R2,5′-GCA GAG GAA CCA GCA TC-3′,由北京鼎国昌盛生物技术有限责任公司合成。
样品DNA提取方法参照Mag Extractor基因组提取试剂盒说明书进行,提取DNA后,-20 ℃保存备用。以上述制备的DNA为模板,用kold plus酶扩增GP60基因,PCR产物经1%琼脂糖电泳后,在凝胶成像系统下观察结果,拍摄照片保存。
3 结 果
3.1 Giemsa染色法观察细胞 隐孢子虫感染HCT-8细胞,经Giemsa染色,见HCT-8细胞呈红色或紫红色,各发育阶段隐孢子虫呈蓝色或蓝紫色。隐孢子虫感染细胞2 h~12 h,大部分的隐孢子虫脱囊,释放出子孢子(图1B,1b);感染12 h~24 h,子孢子侵入HCT-8细胞,发育为滋养体(图1C,1c);感染36 h,可见HCT-8细胞内含有6个裂殖子的裂殖体(图1D,1d);感染48 h,HCT-8细胞内见小配子及其残渣(图1E,1e)、配子体(图1F,1f)和合子(图1G,1g);感染60 h,HCT-8细胞内见卵囊(图1H,1h),收集的细胞培养上清中,除见到大量的游离卵囊,还有大量细胞碎片。
A-H:微分干涉显微镜;a-h:吉姆萨染色;A、a:未感染虫体的细胞对照;B、b:隐孢子虫脱囊阶段;C、c:滋养体阶段;D、d:裂殖体阶段;E、e:大配子阶段;F、f:小配子阶段;G、g:合子阶段;H、h:卵囊阶段
A-H: differential interference microscope, a-h: Giemsa staining. A,a: uninfected cell control; B,b: Cryptosporidium excystation; C,c: trophozoites; D,d: schizont; E,e: megagametophyte; F,f: microgametocyte; G,g: zygote; H,h: oocyst
图1 微小隐孢子虫IId亚型在HCT-8细胞中各发育阶段虫体的形态观察(×1000)
Fig.1 Observation of various development stage ofCryptosporidiumparvumIId in HCT-8 cells (×1000)
3.2 不同时间点HCT-8细胞DNA的PCR检测
将提取的不同时间点的上清与细胞样品DNA,分别进行GP60基因的PCR扩增反应。电泳结果显示:细胞上清DNA样品在6 h、12 h、24 h、48 h未能扩增出832 bp特异型性片段,而在72 h和96 h扩增出832 bp的特异性片段,细胞样品在不同时间点的细胞样品中均能扩增出832 bp的特异性片段。详见图2,图3。
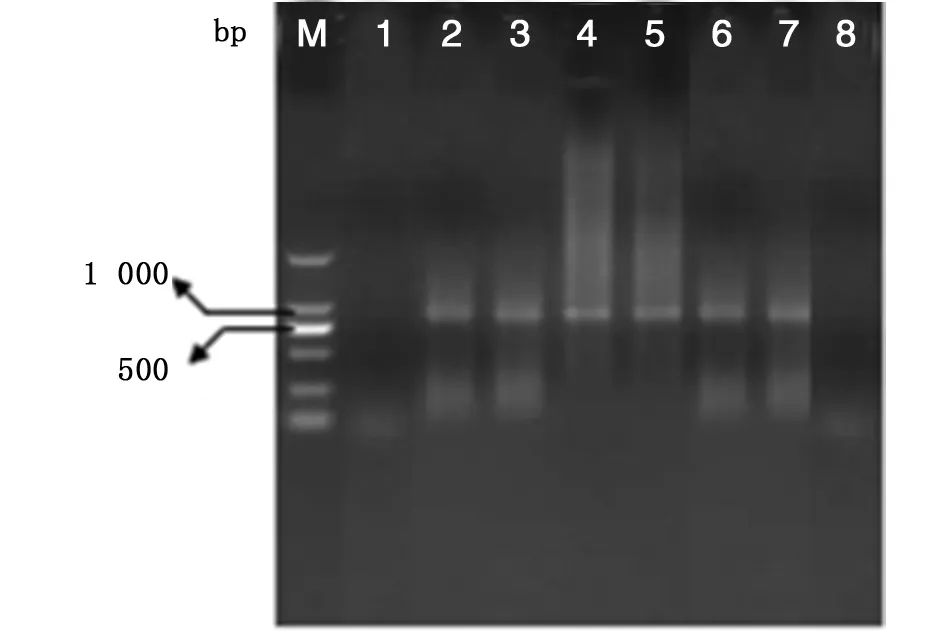
M:DL2000 分子marker;1:空白细胞对照,2-7:卵囊接种6 h,12 h,24 h,48 h,72 h,96 h的细胞样品,8:阴性对照(无菌蒸馏水)M: DL 2000 molecular marker; 1: blank cell control, 2-7: cell samples post inoculated hours 6, 12, 24, 48, 72, and 96, 8: negtive control(distilled water)图2 微小隐孢子虫IId亚型在HCT-8细胞不同时间点细胞中卵囊DNA检测Fig.2 Detection of C. parvum IId DNA at different times in HCT-8 cell

M:DL2000 分子marker;1:空白细胞对照,2-7:卵囊接种6 h,12 h,24 h,48 h,72 h,96 h的细胞上清样品,8:阴性对照(无菌蒸馏水)M: DL 2000 molecular marker; 1: blank cell control, 2-7: cell supernatant post inoculated hours 6, 12, 24, 48, 72, and 96, 8: negtive control(distilled water)图3 微小隐孢子虫IId亚型在HCT-8细胞不同时间点细胞上清中卵囊DNA检测Fig.3 Detection of C. parvum IId DNA at different times in HCT-8 cell supernatant
4 讨 论
纯化隐孢子虫卵囊主要用于体外培养、抗原制备和隐孢子虫DNA提取研究。本实验采用1∶1的蔗糖溶液纯化隐孢子虫卵囊,收到的卵囊量大而且较为纯净,此时的卵囊可用于提取隐孢子虫DNA。由于本文的卵囊的用途是感染细胞,要求细胞纯净,无杂质,所以要对卵囊作进一步的纯化。文献报道,对于卵囊的纯化,一般采用Percoll密度梯度离心和CsCl密度梯度离心和免疫磁性分离法(IMS)等。Hadfield等[17]用IMS和CsCl的密度梯度离心对比试验显示IMS法适用于小量的卵囊纯化,而CsCl密度梯度离心法适用于量大样品的纯化。陈甫等[18]用Percoll密度梯度离心和CsCl密度梯度离心法处理卵囊的对比实验表明,两者虽都存在卵囊丢失,但是CsCl密度梯度离心卵囊丢失率低,且纯化的卵囊纯度明显高于Percoll密度梯度离心,而且不用做任何灭菌处理,直接可以感染细胞。由于本实验细胞感染需要大量的卵囊,因此使用CsCl密度梯度离心的方法纯化卵囊,而Arrowood[16]的方法简便,可操作性强,回收率高。本实验根据Arrowood等[16]的试验方法进行纯化卵囊,做了些改动,即离心机的转速和时间与文献报道不太一致,我们采取的离心机转速与时间比文献报道要高,否则的话,形成的卵囊带少,容易造成卵囊的大量丢失。
研究表明,用于感染细胞的卵囊必须是新鲜的,一般是3个月以内的卵囊,越早越好。在感染之前要用次氯酸钠处理以除去卵囊液中的病原微生物,而且采用次氯酸钠处理可使卵囊壁变薄(特别是新鲜卵囊壁更容易变薄),有助于子孢子的溢出又可以防止微生物污染[7]。加之细胞培养基内含有定量的牛黄胆酸盐的刺激,更有利于子孢子的溢出。因此本研究中的卵囊在感染前并未进行脱囊而直接感染细胞。
采用PCR方法从分子方面确认了C.parvumⅡd亚型在HCT-8细胞中生长发育过程以及遗传稳定性。细胞样品在不同的感染时间点均能扩增出832 bp的GP60基因片段,测序结果分析显示均为C.parvumIId亚型。而细胞上清样品在6 h、12 h、24 h、48 h未能检测出C.parvumIId亚型虫体DNA,却在72 h和96 h检测出C.parvumIId亚型虫体DNA。说明感染早期,卵囊在细胞中进行生长发育,在上清中检测不到虫体DNA,但在感染后期(72 h后),随着细胞的不断崩解,导致C.parvumIId亚型卵囊脱离细胞,游离于上清中,因而细胞上清中能够检测到虫体DNA。因此,通过HCT-8细胞体外培养C.parvumIId亚型卵囊时,我们还需对细胞的培养条件、特别是细胞感染后血清浓度、感染虫体数量和细胞数量的比例以及培养环境等方面的问题需要进一步的摸索,为建立微小隐孢子的体外培养模型奠定基础。
[1] Karanis P, Aldeyarbi HM. Evolution ofCryptosporidiuminvitroculture[J]. Int J Parasitol, 2011, 41(12): 1231-1242.
[2] Plutzer J, Karanis P. Genetic polymorphism inCryptosporidiumspecies: an update[J]. Vet Parasitol, 2009, 165: 187-199.
[3] Baldersson S, Karanis P. Waterborne transmission of protozoan parasites: review of worldwide outbreaks-an update 2004-2010[J]. Water research, 2011, 45(20): 6603-6614.
[4] Morada M, Lee S, Gunther-Cummins L, et al. Continuous culture ofCryptosporidiumparvumusing hollow fiber technology[J]. Int J Parasitol, 2016, 46(1): 21-29.
[5] Aldeyarbi HM, Karanis P. Electron microscopic observation of the early stages ofCryptosporidiumparvumasexual multiplication and development ininvitroaxenic culture[J]. Eur J Protistol, 2015, 52: 36-44.
[6] Jenkins MC, O'Brien CN, Santin M, et al. Changes in the levels of Cryspovirus duringinvitrodevelopment ofCryptosporidiumparvum[J]. Parasitol Res, 2015, 114(6): 2063-2068.
[7] Dibao-Dina A, Follet J, Ibrahim M, et al. Electrical impedance sensor for quantitative monitoring of infection processes on HCT-8 cells by the waterborne parasiteCryptosporidium[J]. Biosens Bioelectron, 2015, 66: 69-76.
[8] Schupfner M, Greif G, Lendner M, et al. Evaluation of putative anti-cryptosporidial drugs in aninvitroculture system[J].Parasitol Res, 2013, 112(Suppl 1): 149-162.
[9] Castellanos-Gonzalez A, Cabada MM, Nichols J, et al. Human primary intestinal epithelial cells as an improvedinvitromodel forCryptosporidiumparvuminfection[J]. Infect Immun, 2013, 81(6): 1996-2001.
[10] Yang R, Elankumaran Y, Hijjawi N, et al. Validation of cell-free culture using scanning electron microscopy (SEM) and gene expression studies[J]. Exp Parasitol, 2015, 153: 55-62.
[11] Morada M, Pendyala L, Wu G, et al.Cryptosporidiumparvuminduces an endoplasmic stress response in the intestinal adenocarcinoma HCT-8 cell line[J]. J Biol Chem, 2013, 288(42): 30356-30364.
[12] Johnson AM, Giovanni GD, Rochelle PA. Comparison of assays for sensitive and reproducible detection of cell culture-infectiousCryptosporidiumparvumandCryptosporidiumhominisin drinking water[J]. Appl Environ Microbiol, 2012, 78(1):156-162.
[13] Wu L, Jiang XG, Shen YJ, et al. Efficacy of ginkgolic acids againstCryptosporidiumandersoni in cell culture[J]. Parasitol Res, 2011, 109(5): 1475-1479.
[14] Hijjawi N.Cryptosporidium: new developments in cell culture[J]. Exp Parasitol, 2010, 124(1): 54-60.
[15] Xiao L, Fayer R, Ryan U, et al.Cryptosporidiumtaxonomy: recent advances and implications for public health[J]. Clin Microbiol Rev, 2004, 17: 72-97.
[16] Arrowood MJ, Donaldson K. Improved purification methods for calf-derivedCryptosporidiumparvumoocysts using discontinuous sucrose and cesium chloride gradients[J]. J Eukaryot Microbiol, 1996, 43(5): 89S.
[17] Hadfield SJ, Pachebat JA, Swain MT, et al. Generation of whole genome sequences of newCryptosporidiumhominisandCryptosporidiumparvumisolates directly from stool samples[J]. BMC Genomics, 2015, 16: 650.
[18] Chen P, Huang KH. Study on methods for isolation and purification ofCryptosporidiumparvum oocysts in feces from mouse feces[J]. China Journal of Parasitology and Parasitic Diseases, 2006, 24(3): 219-222.(in Chinese)
陈甫,黄克和.从鼠粪中分离纯化微小隐孢子虫卵囊方法的研究[J]. 中国寄生虫学与寄生虫病杂志, 2006, 24(3): 219-222.
ZHU Hui-li1,2, LIU Li-min1, WANG Cheng-rong1, ZHANG Su-mei1,ZHANG Long-xian1,WANG Rong-jun1
(1.CollegeofAnimalScienceandVeterinaryScience,HenanAgriculturalUniversity,Zhengzhou450002,China;2.CollegeofAnimalScienceandVeterinaryScience,HenanInstituteofScience
andTechnology,Xinxiang453003,China)
In order to developinvitroinfected model forCryptosporidiumparvumand to observe its developmental stages in the cells, the human ileocecal cancer (HCT-8) cells were selected to culture the parasite. The purified oocysts ofC.parvumIId subtype infected HCT-8 cellsinvitro, the developmental processes ofC.parvumIId subtype in HCT-8 cells were observed using Giemsa staining, and the DNA ofC.parvumIId subtype from different time points of infection were detected by Polymerase Chain Reaction (PCR). Following 72 h co-culture, excystation, sporozoites, trophozoites, meronts, microgametocytes, macrogametocytes, zygote and oocyst appeared orderly. Furthermore, the DNA ofC.parvumIId subtype in cells were still detected at 96 h post-infection. The complete developmental processes ofC.parvumIId subtype can be observed in HCT-8 cells, which provides a theoretical basis for the screening of anti-Cryptosporidiumdrugs and becomes a method forC.parvumIId oocyst amplification byinvitroculture.
Cryptosporidiumparvum; infection model; HCT-8 cell; culture
国家自然科学基金重点项目(No.31330079)、国家自然科学基金青年项目(No.31302079)和河南省高校科技创新人联合资助
王荣军,email:wrj-1978@163.com
1.河南农业大学牧医工程学院,郑州 450002;
2.河南科技学院动物科学学院,新乡 453003
10.3969/j.issn.1002-2694.2016.08.005
R382
A
1002-2694(2016)08-0706-05
2016-01-20;
2016-01-20
Supported by the National Natural Science Foundation of China (No. 31330079) and (Grant No.31302079) and Science and technology innovation talents in Colleges and Universities in Henan Province(No.16HASTIT018)
