TGF-β2调控血管平滑肌细胞表型转化在静脉血栓管壁重塑中的作用及其机制
2020-10-14王旭辉王鹏辉潘艺青王琼殷敏毅
王旭辉,王鹏辉,潘艺青,王琼*,殷敏毅*
1上海交通大学医学院附属第九人民医院血管外科/上海交通大学血管病诊治中心,上海 200011;2上海交通大学基础医学院组织胚胎学与遗传发育学系,上海 200025
深静脉血栓形成后综合征(post-thrombotic syndrome,PTS)是由急性深静脉血栓(deep venous thrombosis,DVT)发展而来的慢性静脉功能不全性疾病。DVT抗凝溶栓存在一定的适应证和禁忌证,弹力袜对PTS的预防作用尚存在争议,支架治疗法具有侵入性且存在并发症[1-2]。因此,了解DVT发展成PTS的发病机制,可为PTS的预防提供新的思路。已知DVT后受损静脉管壁中膜平滑肌细胞(smooth muscle cell,SMC)向合成型转化时,可分泌大量细胞外基质(extracellular matrix,ECM),且管壁增厚变硬导致静脉高压而出现临床症状[3-5]。SMC作为血管(包括静脉)中膜的主要细胞成分,主要存在收缩型和合成型两种表型。生理状态下,SMC主要表现为收缩型从而维持和调节静脉壁张力,控制血液从外周返流回心脏。在病理条件如损伤、炎症、理化等因素刺激下,SMC可由收缩型向合成型转化,主要表现为α-平滑肌肌动蛋白(α-SMA)、弹力蛋白(Elastin)等收缩型标志物表达降低,伴随ECM分泌增多[6-7]。目前已经发现哺乳动物中存在三种转化生长因子β(transforming growth factor β,TGF-β)异构体(TGF-β1、β2、β3),在血管疾病中均发挥着重要的调节功能[8]。其中,TGF-β1可通过促进SMC凋亡和迁移,参与螺旋动脉重塑,进而维持正常妊娠[9-10];TGF-β3可通过抑制Wnt16-Notch信号通路,促进SMC向软骨细胞转化[9,11];TGF-β2对SMC的增殖、迁移和基质沉积具有重要的调节功能,但其在PTS管壁SMC表型转化中的作用尚不明确[12]。本研究探讨静脉血栓后管壁重塑过程中TGF-β2调控SMC表型转化的作用及其机制,以期为临床PTS的治疗和预防提供理论依据。
1 材料与方法
1.1 细胞实验
1.1.2 细胞培养 采用完全培养基(含10% FBS、1%青/链霉素)置于37 ℃、5% CO2培养箱中培养HVSMC,当细胞密度达80%~90%时,按1:2的比例传代培养。将HVSMC以2×105个/孔的密度接种在6孔板上,置于37 ℃、5% CO2培养箱中培养24 h。处理细胞前更换完全培养基为无血清培养基并培养16~18 h。
1.1.3 实验分组和处理 设置空白对照,并按TGF-β2浓度梯度(0、1、10、20 ng/ml)进行分组,刺激HVSMC 24 h后提取RNA。设置空白对照,以10 ng/ml TGF-β2刺激HVSMC 0、2、6、24 h后提取RNA。
1.1.4 实时荧光定量PCR(reverse transcriptionpolymerase chain reaction,RT-PCR)检测HVSMCs表型标志物mRNA的表达 使用1 ml Trizol裂解6孔板各孔HVSMCs,用200 ml氯仿提取RNA,12 000 r/min 离心15 min,上清液用等量异丙醇沉淀,再用1 ml 75%和100%乙醇各洗涤1次,风干,加20 ml去RNA酶的水,溶解,测浓度。以1000 ng RNA在42 ℃、45 min和85 ℃、15 s的条件下进行反转录合成cDNA。选择目的基因的特异性引物,通过RT-PCR进行扩增。引物由上海生工生物技术有限公司合成,引物序列见表1。
1.2 动物实验
1.2.1 实验动物 清洁级雄性SD大鼠19只,4~6周龄,体重(200±50) g,购自上海交通大学医学院实验动物中心。本研究获得上海交通大学医学院动物伦理委员会审批(批准文号:A-2019-057)。
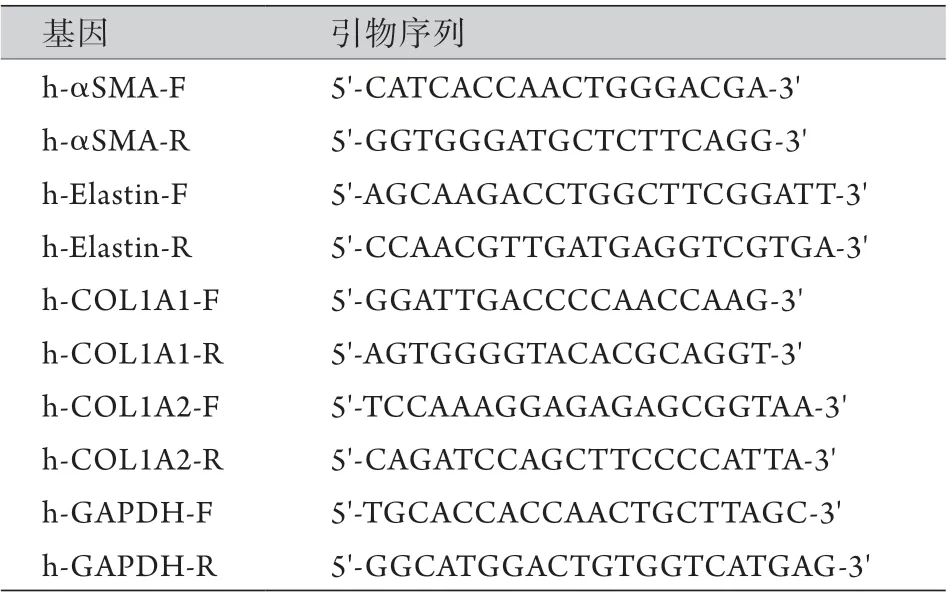
表1 HVSMCs表型标志物RT-PCR引物序列Tab.1 RT-PCR primer sequences of HVSMCs phenotype markers
1.2.2 大鼠下腔静脉血栓模型建立与验证 按照文献[13]的方法建立大鼠下腔静脉血栓模型。在新环境下适应性喂养大鼠1周后,给予0.6%戊巴比妥钠腹腔注射麻醉,在显微镜下打开腹腔,游离腹主动脉、下腔静脉及输尿管,使用无齿镊在左肾静脉和下腔静脉汇合处向远心端依次钳夹5次后,用6-0细线分别穿过下腔静脉和腹主动脉以及下腔静脉和输尿管之间的间隙,在紧邻钳夹部位近心端完全结扎下腔静脉后即可关腹。血栓造模术后第4天,HE和Masson染色观察下腔静脉管腔内急性期血栓形成;第7天,HE和Masson染色观察下腔静脉慢性期血栓机化再通,以证实大鼠下腔静脉血栓造模成功。第14天,RT-PCR检测血栓段静脉管壁和正常静脉管壁SMC表型标志物的表达水平,验证血栓后管壁SMC表型的转化。
1.2.3 实验分组及处理 下腔静脉血栓造模成功的SD大鼠随机分为血栓组(n=9)与TGF-β2实验组(n=5),同时设置假手术组(n=5)作为阴性对照。血栓造模术后第14天,大鼠给予0.6%戊巴比妥钠麻醉后再次打开腹腔,游离下腔静脉结扎线远心端和后腹膜间的腔隙后,分别将含TGF-β2(TGF-β2实验组,10 ng/只)和未含TGF-β2(血栓组)的水凝胶注射在此腔隙,2~4 min凝胶凝固后关腹。24 h后,在紧邻下腔静脉结扎线近心端和右侧分支分出部位近心端之间取材。假手术组仅打开腹腔但不结扎下腔静脉或仅游离下腔静脉和后腹膜间腔隙但不注入水 凝胶。
对照组患者早上空腹口服藏药二十五味珍珠丸(1粒/次)、早上餐后口服二十味沉香丸(1粒/次)、晚上餐后服用八味沉香散(1 g/次),治疗时间为1周;观察组将白石英1 g、小茴香2 g及肉豆蔻2 g研磨成末放入纱布中,为了便于操作以及避免烫伤,将小木棍插入纱布中间,将其包扎成小包后扎紧,将酥油或香油30 g放入小茶缸中加热,把小药包浸入其中,确定酥油均渗入到药包中,将药包取出,分别在患者机体各穴位涂抹剩余酥油,2次/d,以7 d为一疗程。
1.2.4 RT-PCR检测大鼠下腔静脉管壁SMC表型标志物mRNA的表达 将大鼠下腔静脉血管剪碎,加入Trizol冰上碾磨并裂解,提取RNA,步骤详见1.1.4。选择目的基因的特异性引物,通过RT-PCR进行扩增。引物由上海生工生物技术有限公司合成,引物序列见表2。
1.2.5 下腔静脉病理学观察 下腔静脉取材后,用4%多聚甲醛室温固定16~18 h,PBS清洗,75%乙醇过夜,按照85%(1 h)-95% Ⅰ(1 h)-95% Ⅱ(1 h)-100% Ⅰ(30 min)-100% Ⅱ(15 min)梯度乙醇脱水,随后二甲苯Ⅰ(30 min)-Ⅱ(15 min)中透明,然后浸入石蜡Ⅰ(1.5 h)-Ⅱ(1.5 h),最后将血管组织放入模具进行包埋,包埋时结扎线端血管组织切面向下,使用竖立法完成包埋,切片机上制作5 μm厚度的切片。

表2 SMC表型标志物RT-PCR引物序列Tab.2 RT-PCR primer sequences of SMC phenotype markers
1.2.5.1 HE染色 二甲苯Ⅰ(15 min)-Ⅱ(15 min)脱蜡;梯度乙醇100% Ⅰ(2 min)-100% Ⅱ(2 min)-95% Ⅰ(2 min)-95% Ⅱ(2 min)洗脱;苏木精染色5 min,蒸馏水洗2 min;1%盐酸乙醇2~5 s,蒸馏水洗5~7 min;1%伊红染色2~4 min,蒸馏水洗1 min。100% Ⅰ(2 min)-100% Ⅱ(2 min)梯度乙醇脱水,二甲苯Ⅰ(2 min)-Ⅱ(2 min)透明;切片风干,中性树胶封片,显微镜下观察并拍照。
1.2.5.2 Masson染色 切片常规脱蜡同1.2.5.1。蒸馏水洗后用Weigert苏木精液染色5~10 min,1%盐酸乙醇水化,蒸馏水清洗后,丽春红-酸性品红液浸染5~10 min,蒸馏水洗后1%磷钼酸水溶液处理5 min,直接用苯胺蓝液或绿液复染5 min,1%冰醋酸处理1 min,最后乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察并拍照。
1.3 统计学处理 采用GraphPad Prism 8软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TGF-β2对HVSMC表型标志物mRNA表达的影响
2.1.1 不同浓度TGF-β2对HVSMC表型标志物mRNA表达的影响 RT-PCR检测结果显示,不同浓度(0、1、10、20 ng/ml)TGF-β2处理后,HVSMC收缩型标志物α-SMA、Elastin和合成型标志物Col1A1的mR NA表达均明显增加,且呈剂量依赖关系(P<0.05),而合成型标志物Col1A2 mRNA的表达水平差异无统计学意义(P>0.05,图1)。在10 ng/ml和20 ng/ml TGF-β2刺激24 h条件下,HVSMC收缩型和合成型标志物mRNA的表达均出现明显改变,但为了避免高浓度刺激可能引起的非特异性作用,故采用10 ng/ml作用条件进行后续实验。
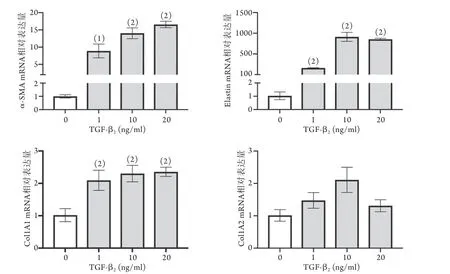
图1 不同浓度TGF-β2对HVSMC表型标志物mRNA表达的影响(n=3~4)Fig.1 Effects of different concentrations of TGF-β2 on the expressions of HVSMC phenotypic markers mRNA (n=3-4)
2.1.2 固定浓度TGF-β2对HVSMC表型标志物mRNA表达的影响 以10 ng/ml TGF-β2分别刺激HVSMC 0、2、6、24 h后,HVSMC收缩型标志物α-SMA、Elastin和合成型标志物Col1A1的mRNA表达随时间延长逐步增加(P<0.05),呈现时间依赖性。处理24 h后,收缩型标志物α-SMA和Elastin mRNA的表达分别上调20倍和250倍;合成型标志物Col1A1 mRNA的表达上调4倍(P<0.05)。Col1A2 mRNA的表达变化在各时间组差异无统计学意义(P>0.05,图2)。
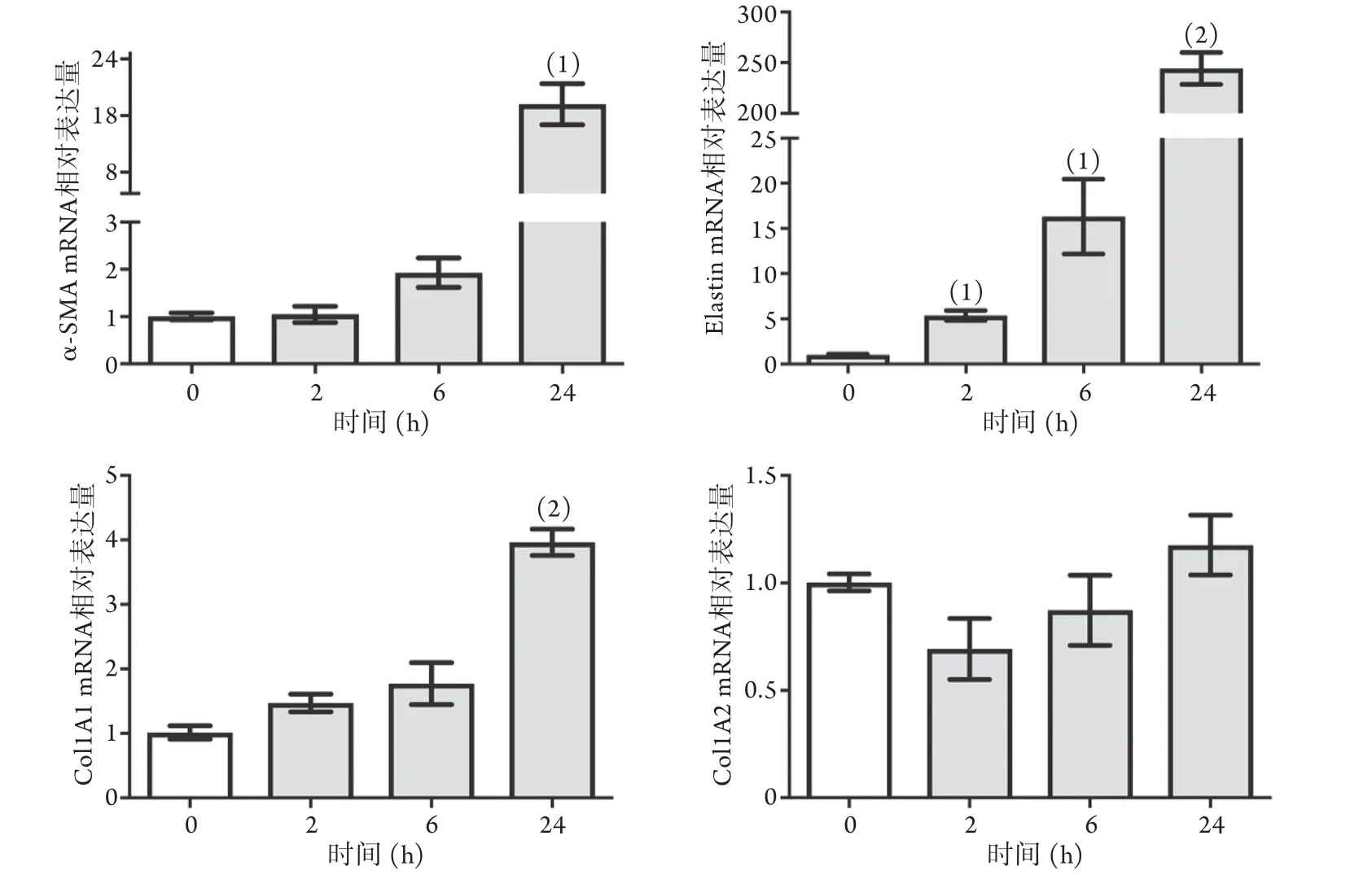
图2 固定浓度TGF-β2对HVSMC表型标志物mRNA表达的影响(n=4)Fig.2 Effects of fixed concentration TGF-β2 on the expressions of HVSMC phenotypic markers mRNA (n=4)
2.2 大鼠下腔静脉血栓模型建立与验证结果
2.2.1 下腔静脉血栓模型的建立及下腔静脉病理学变化 造模后第4天,下腔静脉取材前后,肉眼观察到下腔静脉管腔内局部呈暗黑色,管腔充盈,提示内部可能被实性血栓填充(图3A、B,绿色箭头);HE和Masson染色结果显示,下腔静脉管壁局部扩张明显,管腔内大量血栓形成,血栓边缘可见炎性细胞浸润,提示急性期血栓形成(图3C、D)。造模后第7天,下腔静脉取材前后,肉眼观察到下腔静脉管腔内局部呈暗红色,管腔内局部“充盈缺损”,提示血栓部分溶解(图3E、F,绿色箭头);HE和Masson染色结果显示,血栓与静脉管壁的间隙增大,提示血栓机化皱缩,并且血栓内有新生的毛细血管,开始部分溶解再通(图3G、H)。以上结果表明大鼠下腔静脉血栓造模成功,并且第7天血栓已经皱缩,内有新生毛细血管形成,提示慢性期血栓开始机化再通。
2.2.2 大鼠下腔静脉血栓形成后管壁SMC表型标志物mRNA的表达情况 RT-PCR检测结果显示,与假手术组相比,血栓组静脉管壁SMC收缩型标志物(α-SMA,Elastin) mRNA表达明显下降(P<0.05),合成型标志物(Col1A1,Col1A2)mRNA表达明显增加(P<0.01,图4)。
2.3 TGF-β2作用下大鼠下腔静脉血栓形成后静脉管壁SMC表型标志物表达和管壁厚度改变情况 RT-PCR检测结果显示,与血栓组比较,TGF-β2实验组下腔静脉管壁收缩型标志物(α-SMA、Elastin)mRNA表达上调,合成型标志物仅Col1A2 mRNA表达上调(P<0.05,图5)。
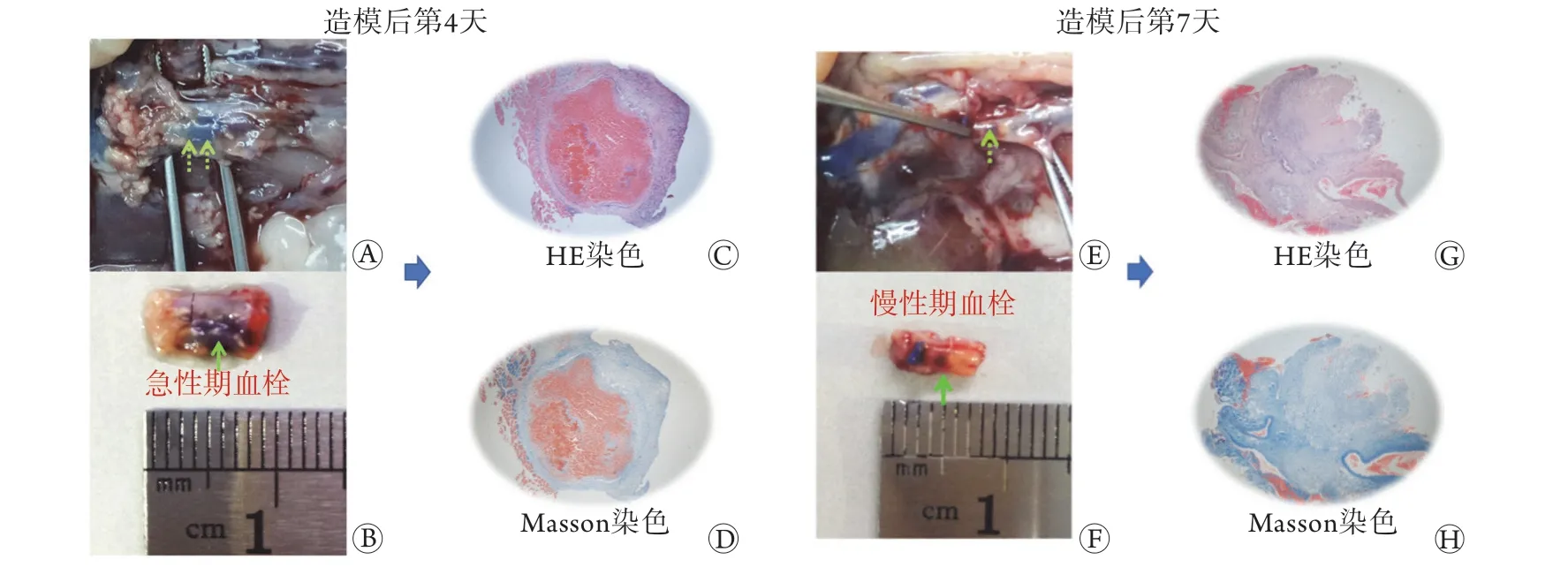
图3 造模后第4天急性期血栓形成及第7天慢性期血栓机化再通(HE和Masson染色,×40)Fig.3 Acute thrombosis on 4 days after surgery and chronic organized thrombus and recanalization on 7 days after surgery (HE and Masson staining, ×40)
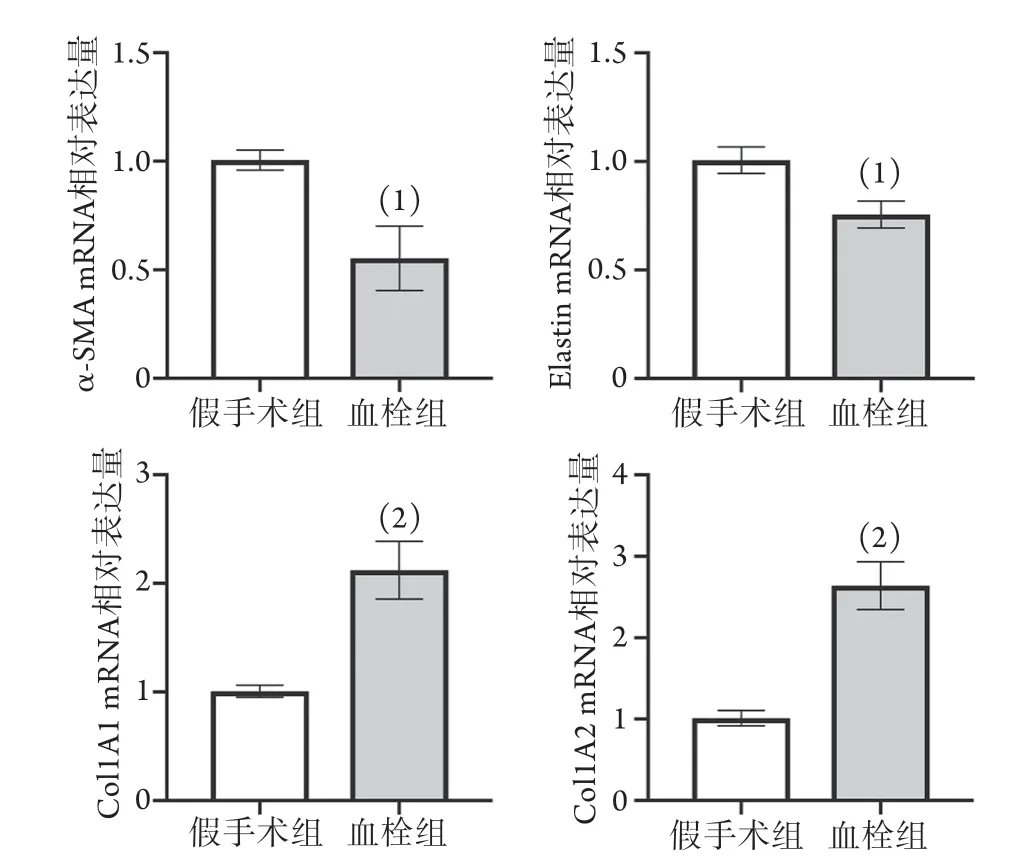
图4 大鼠下腔静脉血栓形成后管壁SMC表型标志物mRNA的表达(n=4~6)Fig.4 Expression of SMC phenotypic markers mRNA in the wall of rat inferior vena cava thrombus (n=4-6)
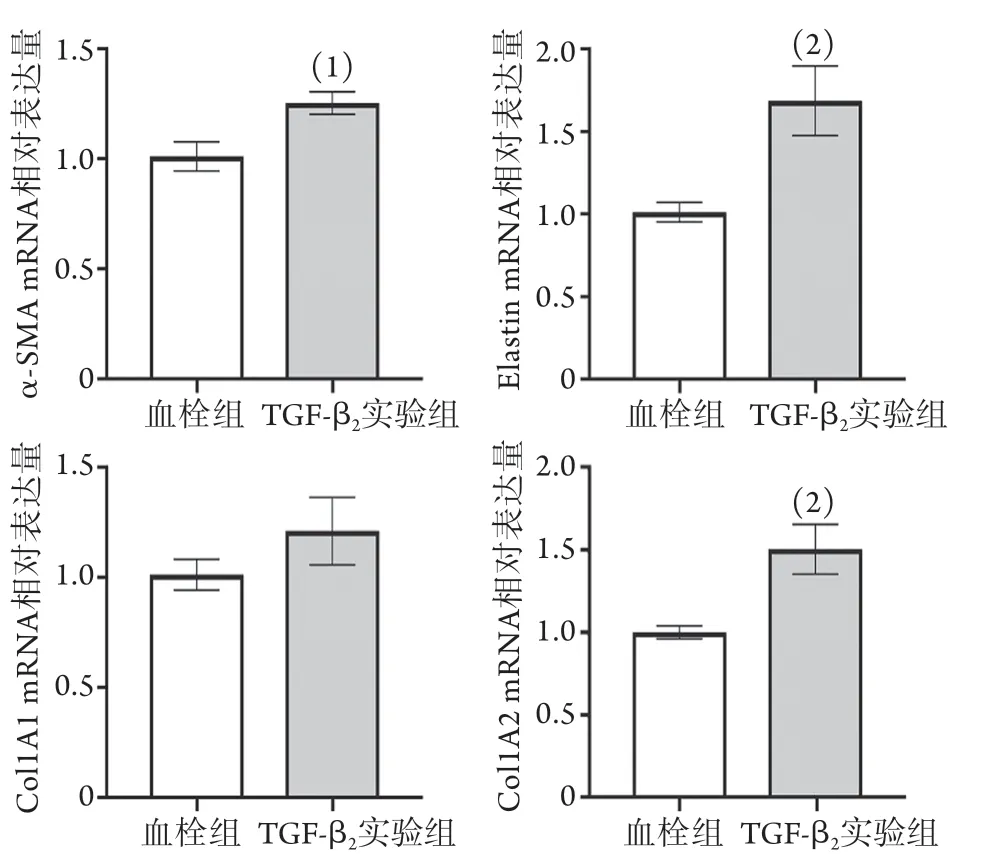
图5 TGF-β2作用下大鼠下腔静脉血栓形成后静脉管壁SMC表型标志物mRNA的表达(n=3~4)Fig.5 Under TGF-β2 action, the expression of SMC phenotypic markers mRNA in the wall of rat inferior vena cava thrombus (n=3-4)
HE和Masson染色结果显示,假手术组下腔静脉管壁呈不规则状,且内中膜较薄;与假手术组比较,血栓组静脉管壁内中膜厚度增加;TGF-β2实验组管壁内中膜厚度较血栓组下降。提示局部使用TGF-β2能够减少静脉血栓后管壁厚度(图6)。
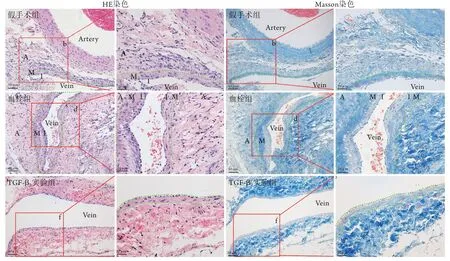
图6 下腔静脉管壁病理学变化Fig.6 Pathological changes of the wall of inferior vena cava
3 讨 论
目前,临床上对DVT患者主要应用抗凝药物预防血栓的蔓延、栓塞和复发,以降低PTS发生率,但缺乏针对PTS的有效药物[14]。既往研究表明,在DVT形成后受损静脉管壁中存在SMC表型转化的病理表现[3,5,15-16]。因此,本研究主要从SMC表型转化的角度研究PTS的管壁重塑,探讨TGF-β2在PTS管壁重塑中的作用,为临床干预PTS的进展提供理论依据。
哺乳动物中存在3种TGF-β异构体(TGF-β1、β2、β3),其中TGF-β1在血管内膜高表达,TGF-β2主要表达于血管中膜,而TGF-β3在整个血管壁均有表达[8]。TGF-β信号通路在免疫反应、炎症反应、肿瘤和纤维化,以及维持血管和造血稳态中发挥着重要作用[8,17]。已有研究表明,TGF-β2是一种多效细胞因子,可调节不同的细胞过程,包括细胞周期、细胞分化、细胞生长、细胞死亡以及ECM沉积等[11,18]。本研究发现,TGF-β2对HVSMC收缩型和合成型标志物的影响均呈现时间和剂量依赖性,但TGF-β2主要刺激收缩型标志物mRNA的表达上调,对合成型标志物的影响较小,提示TGF-β2对血管SMC收缩功能的调节作用更加明显;此外,TGF-β2对于合成型标志物有一定的上调作用,推测可能与SMC胚胎起源的异质性有关[8]。
下腔静脉血栓模型广泛应用于研究血栓和血栓后管壁重塑,主要包括狭窄(部分结扎)模型和瘀滞(完全结扎)模型[19-20]。其中狭窄模型主要用于影响血栓形成方面的研究,而瘀滞模型的血栓形成率高达95%~100%,且血栓形成大小较均一,其应用更广泛,包括预防血栓形成、血栓溶解以及血栓形成后静脉管壁重塑等方面的研究[19-20]。因此,本研究采用大鼠下腔静脉瘀滞模型来探讨TGF-β2对血栓形成后静脉管壁重塑的作用。血栓根据疾病进程可分为急性期、亚急性期和慢性期。大鼠新陈代谢速度比人类快,一般认为≤3 d的大鼠静脉血栓是急性的,血栓自然溶解可长达28 d[19]。因此,本研究在大鼠下腔静脉血栓造模后第4天、第7天取材,通过HE染色和Masson染色检测下腔静脉管腔内急性期血栓形成,以及血栓部分溶解和机化再通进入慢性期,从而证实下腔静脉血栓模型构建成功。造模后第14天,血栓组下腔静脉管壁中SMC收缩型标志物表达下调,而合成型标志物表达上调,进一步证实血栓后静脉管壁存在收缩型SMC向合成型转变的病理学基础。
水凝胶具有低毒性和良好的生物相容性,载药局部处理可以减轻全身给药引起的不良反应。本研究使用水凝胶载TGF-β2局部处理下腔静脉管壁[21], 结果显示,处理24 h后,静脉管壁SMC的收缩型和合成型标志物mRNA表达均增加,其中收缩型标志物mRNA表达增加更为明显,表明TGF-β2有利于维持血栓形成后静脉管壁SMC的收缩表型。这与TGF-β2在HVSMC中的作用结果基本一致,提示TGF-β2主要刺激收缩型标志物的表达。既往研究报道,在下腔静脉血栓动物模型中,血栓段静脉管壁增厚[22-23]。本研究采用Masson染色法测量内中膜厚度发现,与假手术组比较,血栓组静脉壁内中膜厚度明显增加;与血栓组比较,TGF-β2实验组静脉管壁内中膜厚度明显下降。提示TGF-β2可减轻静脉管壁的增厚程度。
综上所述,在体外和动物体内实验中,TGF-β2主要刺激血管SMC收缩型标志物的表达。当静脉血栓形成后,大鼠血栓段静脉管壁中收缩型SMC向合成型转化。局部使用TGF-β2可上调SMC收缩型标志物的表达,有利于维持血栓段静脉管壁SMC的收缩表型,为临床干预PTS的进展提供了理论依据和新的治疗方案。
