干细胞白血病基因药物对糖尿病膀胱病豚鼠膀胱Cajal间质细胞表面c-kit蛋白表达的影响*
2020-10-11李朋徐浩申茂磊赵国立钱彪王勤章
李朋,徐浩,申茂磊,赵国立,钱彪,王勤章
(1.石河子大学医学院第一附属医院泌尿外科,新疆石河子 832000;2.解放军69235部队卫生队,新疆奎屯 833200)
糖尿病是一种以胰岛素分泌障碍和生物效应受损为特征的代谢障碍性疾病,其具体病因至今仍不完全明确。据调查中国成年人糖尿病患病率约为11.6%,且呈逐年升高的趋势[1-2]。糖尿病膀胱病(diabetic cystopathy,DCP)是一种常见的糖尿病相关并发症,在糖尿病人群中的发病率20%~80%[3],主要临床表现为膀胱敏感性下降、膀胱收缩功能障碍、最大膀胱容量增加、残余尿量增多等,可伴尿急、尿失禁及反复尿路感染[4-5],严重影响患者的工作和生活,越来越引起人们的重视。DCP的发病是一个复杂的、多因素的和时间依赖的过程[6],其中肌源性、神经源性和尿路上皮变化是DCP形成的主要原因[7-8]。豚鼠膀胱内有一种形态结构类似于胃肠道Cajal间质细胞(interstitial cells of Cajal,ICCs),被称为膀胱ICCs[9-10]。多项研究表明,膀胱ICCs可能是影响膀胱逼尿肌收缩活动的起搏器。前期研究证明高糖环境下膀胱ICCs膜上酪氨酸蛋白激酶(c-kit)受体表达降低,可导致ICCs数量减少和功能受损[11-12]。本研究通过以慢病毒为载体构建含干细胞白血病(stem cell leukemia,SCL)基因药物的重组慢病毒,实现将SCL基因药物成功导入豚鼠DCP膀胱,通过观察SCL基因药物导入后ICCs表面c-kit受体的表达,初步研究SCL基因药物对豚鼠DCP膀胱ICCs的影响,旨在为临床DCP的治疗开辟一条新思路。
1 材料与方法
1.1动物 普通级荷兰种健康雄性豚鼠60只,4~6个月龄,体质量200~300 g,普通环境饲养,环境温度控制18~25 ℃,日温差 ≤4 ℃,相对湿度40%~70%,工作照度≥200 lx,所有实验动物均由新疆医科大学动物实验中心提供,实验动物生产许可证号:SCXK(新)2018-0003,本研究全部内容已经石河子大学医学院第一附属医院动物实验伦理委员会审核批准。
1.2药品与试剂 链脲佐菌素(streptozotocin,STZ,Solarbio公司,批号:615K0327),SCL基因重组慢病毒载体药物(上海吉凯恩公司),荧光标记的羊抗小鼠IgG(武汉博士德生物工程有限公司,批号:BA1031),鼠单抗c-kit(Santa公司,批号:sc-365504),羊抗小鼠二抗(武汉博士德生物工程有限公司,批号:BA1051),Western blotting试剂盒(上海恒斐生物科技有限公司,批号:L00205C-1)。
1.3仪器与设备 RM2016轮转式切片机(德国Leica公司),TCSSP5激光共聚焦显微镜(德国Leica公司),GX51光学倒置显微镜(日本Olympus公司),DYCZ-24DN垂直电泳槽(北京六一仪器厂),DYCZ-40电转仪(北京六一仪器厂)。
1.4模型制备 60只健康雄性豚鼠适应性喂养1周后,禁食12 h,按照200 mg·kg-1单次腹腔注射1% STZ溶液(将STZ溶于0.1 mol·L-1、pH值4.4新鲜枸橼酸缓冲液配成)。常规饲养6周后剪耳法检测随机血糖,以连续4周随机血糖≥16.7 mmol·L-1为标准筛选出糖尿病豚鼠。诱导成功动物模型继续饲养2周后,>88.89%糖尿病豚鼠出现失代偿期糖尿病膀胱病症状,即认为豚鼠DCP模型建立成功[13]。
1.5动物分组及给药 将造模成功27只DCP豚鼠随机数字表法分为3组:实验组、阳性对照组和空白对照组,每组各9只。实验前禁食禁水6 h,腹腔注射100 mg·mL-1水合氯醛200 mg·kg-1行麻醉,麻醉后将豚鼠四肢固定于操作台上,充分暴露阴茎,消毒后铺一次性洞巾,插入自制导尿管,排空膀胱及输尿管尿液。实验组经尿道灌注的SCL基因重组慢病毒药物(MOI为2×107U)0.2 mL;阳性对照组灌注不含SCL基因的慢病毒+磷酸盐缓冲液(PBS)0.2 mL;空白对照组灌注PBS 0.2 mL。灌注后结扎尿管,使灌注液于膀胱中保存2 h。2 h后将豚鼠放回笼中常规饲养。
1.6培养ICCs 分别于灌注结束后第7,14,28 天,每次每组麻醉处死豚鼠3只,剖腹后迅速剪取膀胱,排尽残余尿液,置于冰上PBS(含0.01 mol·L-1双抗)培养皿中浸泡10 min;用PBS冲洗3次后,置于0.01 mol·L-1的PBS溶液中将其剪成碎块1 mm3;将剪碎的膀胱放入10 mL离心管中用胰蛋白酶消融15~30 min,加入胶原酶V后继续消融40 min;观察膀胱组织不再是团块状后加入等剂量胎牛血清(FBS)终止消融;1000 r·min-1离心2 min后滤过收取滤液,继续以1500 r·min-1离心5 min;离心后缓慢倒去上层悬液,留取下层白色团液,再加入新鲜DMEM,吹打单细胞悬液,并接种于共聚焦专用培养皿中;在37 ℃、5%二氧化碳(CO2)的培养箱内培养24 h。倒置显微镜下观察细胞形态。更换培养基,将未贴壁的平滑肌细胞吸出,加入新鲜培养基继续培养至72 h后即可得到ICCs。
1.7ICCs鉴定 在6孔培养板各孔中放置无菌消毒的载玻片,用移液器将ICC悬液滴至载玻片中间位置,加入培养基1 mL,接种8 h,再加入培养基1 mL培养48 h后,取出细胞爬片,稀释一抗和二抗(荧光素标记),使工作浓度达1:100;1%PBS漂洗3次,每次15 min;室温条件下用100%丙酮溶液固定15 min,风干后用PBS漂洗3次;采用0.03%过氧化氢(H2O2)溶液处理内源性过氧化物酶; PBS溶液漂洗3次;孵化30 min;缓慢吸取孵化液,与经过稀释的一抗融合,湿盒内室温孵育2 h后置于-4 ℃冰箱继续孵育48 h;PBS溶液漂洗3次;室温下与二抗(荧光羊抗小鼠抗体)避光孵育60 min; PBS溶液漂洗3次;滴加50%甘油溶液于细胞爬片,用盖玻片封闭,吸去渗出的甘油,风干后在激光共聚焦显微镜下观察ICCs数量及分布特点。
1.8Western blotting检测c-kit蛋白的表达 倒掉培养液,干燥培养瓶,每瓶细胞加入于4 ℃预冷的PBS液(0.01 mol·L-1,pH值7.2~7.3)3 mL。洗涤细胞并弃去洗液。重复2次以洗去培养液。弃净PBS后把培养瓶置于冰上。加PMSF后摇匀置于冰上。加含PMSF的裂解液后于冰上裂解30 min,裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧,然后移至1.5 mL离心管中。4 ℃下12 000 r·min-1离心5 min,将离心上清液转移到0.5 mL的离心管中,置于-20 ℃环境下保存。蛋白含量测定,电泳,转膜,免疫反应,化学发光,显影,定影,凝胶图像分析。
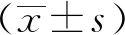
2 结果
2.1成功建立豚鼠DCP模型 60只豚鼠经单次腹腔注射STZ,饲养过程中死亡3只。常规饲养6周后以随机血糖≥16.7 mmol·L-1为标准共筛选出52只糖尿病豚鼠,继续饲养2周后,行尿动力学检测豚鼠膀胱残余尿量,以残余尿量>10%膀胱容量为豚鼠DCP诊断标准,最终成功建立48个DCP豚鼠模型。
2.2ICCs形态观察 体外分离的膀胱组织采用酶消融法培养72 h后,倒置显微镜下可发现生长状态良好ICCs,细胞呈梭型,胞核大,两端发出轴丝2~4 条,镜下可见单聚体与二聚体两种形态的ICCs(图1),本研究以二聚体ICCs作为研究对象。
A 单倍体;B 二倍体
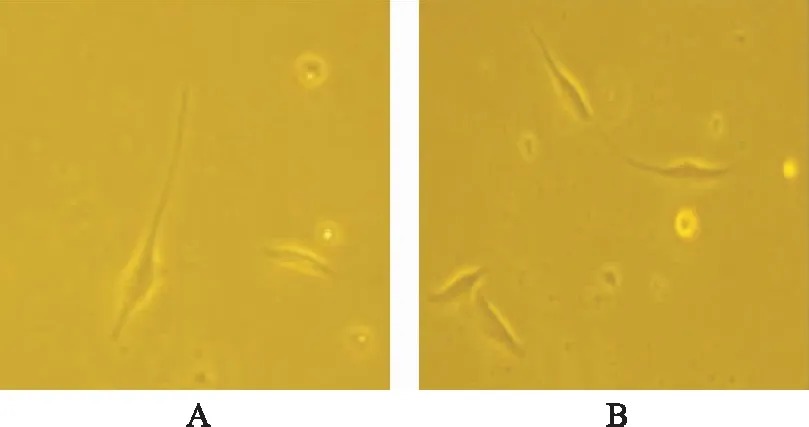
2.3免疫荧光 激光扫描共聚焦显微镜下可见标记的c-kit蛋白呈现绿色荧光,主要表达在ICCs细胞膜上。实验组ICCs细胞荧光强度较其他两组明显增强,见图2。
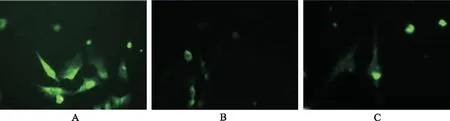
2.4c-kit蛋白表达结果 在7,14,28 d时实验组c-kit蛋白表达较阳性对照组和空白对照组明显增加(P<0.05),阳性对照组较空白对照组c-kit蛋白表达差异无统计学意义(P>0.05)。14 d时实验组c-kit表达较7 d时明显升高(P<0.05),随后在28 d时稍有下降(P<0.05)。其他两组在3个时间段c-kit表达组间组内对比均差异无统计学意义(P>0.05)(图3)。
3 讨论
通过单次腹腔注射足量STZ的方式损伤豚鼠胰岛β细胞,使胰岛素合成和分泌减少,形成糖代谢紊乱,参照文献[14]中方法筛选出所需DCP豚鼠模型。通过构建重组慢病毒将SCL基因药物转染入DCP膀胱,于转染后第7,14和28天取膀胱组织用于培养ICCs细胞。倒置显微镜下观察发现单倍体ICCs和二聚体ICCs两种细胞形态,二聚体ICCs特有的二聚体结构是高兴奋性钙波形成的结构基础,与自律性较低的单倍体相比,二聚体ICCs更易在膀胱组织中发挥起搏及兴奋传递作用[15],且二聚体ICCs能特异性表达c-kit,可能是激发逼尿肌兴奋活动的始动者,起着起搏作用[16],因此在本研究中以二聚体ICCs作为研究对象。
A.实验组;B.阳性对照组;C.空白对照组。
①与实验组比较,P<0.05。
c-kit蛋白是ICCs细胞膜表面的特异性标志,是原癌基因c-kit所编码的跨膜酪氨酸激酶受体蛋白,位于人染色体4q12-13处[17]。c-kit受体和细胞外环境中的干细胞因子(stem cell factor,SCF)结合后SCF/c-kit信号通路被激活[18],通过启动细胞内Ras、Raf、丝裂原活化的蛋白激酶和磷脂酰肌Ⅲ激酶等信号转导通路,将信号传入胞核,从而调控多种基因的表达,对ICCs的发育、分化及表型维持具有重要意义[19]。前期研究表明导致DCP形成的一个主要原因是高糖环境下ICCs不断萎缩或数量减少,细胞表面c-kit蛋白和mRNA表达下降,造成SCF/c-kit信号通路传输功能受损,进而导致膀胱敏感性下降、排尿阶段逼尿肌收缩性减弱、膀胱容量升高、膀胱残余尿量变多等[20-21]。SCL基因是c-kit上游重要的调控基因,可作用于c-kit基因的启动子,极强地促进c-kit的表达,并使其对SCF反应性恢复正常,有助受损的SCF/c-kit信号通路恢复[22-23]。据此推测:以慢病毒为载体,构建SCL基因重组慢病毒药物,以转染的方式将SCL基因经尿道导入豚鼠DCP膀胱中,SCL基因药物使DCP膀胱受损ICCs表面c-kit的表达升高,同时SCF/c-kit信号通路被修复,最终可使ICCs细胞功能得到恢复。
在本实验中,SCL基因药物经重组慢病毒转染入实验组豚鼠DCP膀胱,分别于转染后第7,14,28天,在激光共聚焦显微镜下观察3组ICCs细胞c-kit受体的表达,结果表明实验组ICCs荧光强度较其他两组明显增强,阳性对照组和空白对照组ICCs荧光强度对比无明显差异。Western blotting检测结果显示第14天时SCL重组慢病毒药物转染效果较好,实验组c-kit表达与其他两组相比明显增高,阳性对照组和空白对照组c-kit表达对比差异无统计学意义。实验结果与我们之前的推测基本一致。
综上所述,SCL基因药物导入豚鼠DCP膀胱中,能够上调受损ICCs细胞c-kit受体的表达,进而使SCF/c-kit信号通路得到修复,有利于ICCs细胞起搏功能的恢复,也为临床DCP的治疗提供一个新思路。
