线粒体糖尿病患者三例及其家系的临床及基因检测分析
2020-10-10张娜娜黄有烨王祺章秋胡红琳
张娜娜,黄有烨,王祺,章秋,胡红琳*
线粒体糖尿病(mitochondrial diabetes mellitus,MDM)是一组因线粒体基因(mitochondrial DNA,mtDNA)缺陷导致组织能量代谢障碍所引起的异质性疾病,因其遗传特点表现为严格的母系遗传且多伴有神经性耳聋,故又称为母系遗传糖尿病伴耳聋(maternally inherited diabetes and deafness,MIDD)。因早期临床表现不典型,多数MDM患者表现类似于2型糖尿病(type 2 diabetes mellitus,T2DM),少数患者因发病年龄较小而常被诊断为1型糖尿病(type 1 diabetes mellitus,T1DM),因此MDM常容易误诊,不能得到规范诊治且影响患者预后的判断。已报道的与MDM发生相关的mtDNA突变位点达几十种,其中最常见的是线粒体tRNA Leu(UUR)3243A→G点突变,约占85%[1]。本研究对3例临床疑诊为MDM的患者行线粒体疾病基因检测,并根据检测结果及相关文献报道指导患者治疗。
1 对象与方法
1.1 研究对象 选取2017—2019年在安徽医科大学第一附属医院及六安市人民医院内分泌科疑诊为MDM的3例患者,均为女性,发病年龄17~27岁。将3例先证者及其7名家系成员纳入研究,并行mtDNA测序。本研究已通过安徽医科大学第一附属医院伦理委员会审批,研究对象均签署知情同意书。
1.2 研究方法 本研究基于现有资料,采用真实世界研究方法收集研究对象临床资料,按照标准方法测量身高、体质量、腰围、臀围,并以体质量(以kg为单位)除以身高(以m为单位)的平方计算体质指数(body mass index,BMI)、以腰围(以cm为单位)除以臀围(以cm为单位)计算腰臀比(waistto-hip ratio,WHR)。隔夜空腹8 h后抽取研究对象肘静脉血10 ml用于检测糖化血红蛋白(glycated hemoglobin,HbA1c)、糖尿病相关抗体及进行基因测序,同时先证者及明确糖尿病诊断者行馒头餐试验,未确诊者行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),分别于0、30、120 min抽取其肘静脉血3 ml。采用全自动生化分析仪(HITACHI 7170S Japan)测定血糖(blood glucose,BG),采用化学发光法(ChemiLuminescence)测定C肽(C peptide,CP),采用高效液相色谱法(high-performance liquid chromatography,BIO-RAD)测定HbA1c,采用免疫印迹法(Western blotting,SIEMENS)测定糖尿病相关抗体。采用血液基因组柱式中量提取试剂盒(天根)提取基因组DNA,用Qubit 2.0型荧光计及0.8%琼脂糖凝胶电泳对DNA样本进行质检,通过Illumina公司NovaSeq 6000系列测序仪进行高通量测序(PE150),目标序列测序覆盖度不低于99%。线粒体3243位点的测序或mtDNA的测序由北京智因东方转化医学研究中心完成。
2 结果
2.1 先证者一般资料 3例先证者一般资料见表1。
2.2 先证者临床特点 患者1,女,34岁,27岁诊断为糖尿病,29岁出现听力减退。目前使用胰岛素治疗。母亲、姨娘、哥哥有糖尿病病史,父母非近亲结婚。BMI 18.3 kg/m2,WHR 0.86。馒头餐结果示0、30、120 min BG分别为12.06、16.26、25.14 mmol/L,CP 分别为0.39、0.47、0.85 μg/L。HbA1c为10.1%。糖尿病相关抗体阴性。该家系4代共15人,其中接受调查的共6人〔Ⅱ-2,Ⅱ-4,Ⅱ-5,Ⅲ-1,Ⅲ-3(患者1),Ⅳ-2〕,其余亲属拒绝接受调查(见图1)。
患者2,女,27岁,26岁诊断为糖尿病,27岁出现听力减退。目前使用胰岛素治疗。家族史不详。BMI 14.8 kg/m2,WHR 0.81。馒头餐结果示0、30、120 min BG分别为5.10、7.97、22.78 mmol/L,CP分 别 为 0.18、0.30、1.53 μg/L。HbA1c为13.8%。糖尿病相关抗体阴性。患者2自幼被领养,故未分析家系成员。
患者3,女,19岁,18岁诊断为糖尿病,暂无听力减退。目前使用胰岛素治疗。母亲、两个姨娘、妹妹有糖尿病病史,父母非近亲结婚。BMI 14.4 kg/m2,WHR 0.80。馒头餐结果示0、30、120 min BG分别为4.27、5.25、11.21 mmol/L,CP分别为0.36、0.60、2.85 μg/L。HbA1c为5.3%。糖尿病相关抗体阴性。该家系3代共11人,其中接受调查的共3人〔Ⅱ-4,Ⅲ-1(患者3),Ⅲ-2〕,仅患者3接受基因检测,其余亲属拒绝接受调查(见图2)。
2.3 先证者1家系成员一般资料及生化指标 先证者1家系成员一般资料及生化指标见表2、3。
2.4 先证者3家系成员一般资料及生化指标 先证者3家系成员一般资料及生化指标见表4、5。
2.5 基因测序结果 对先证者及其家系成员共8人进行基因测序,共6人存在tRNA 3243A→G点突变,分别为家系1中先证者1、Ⅱ-4、Ⅲ-1、Ⅳ-2及先证者2、先证者3。先证者1及其家系成员基因测序结果见图3。
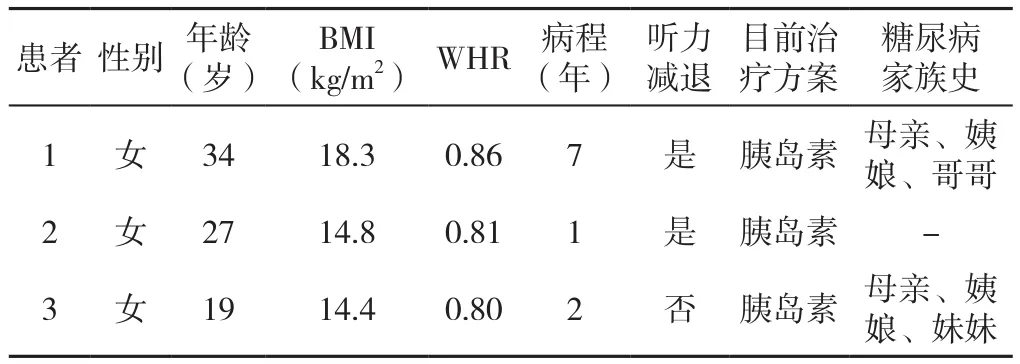
表1 3例先证者一般资料Table 1 General information of 3 cases of proband
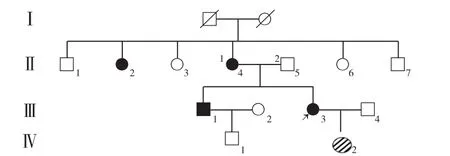
图1 先证者1家系图Figure 1 Family chart of proband 1
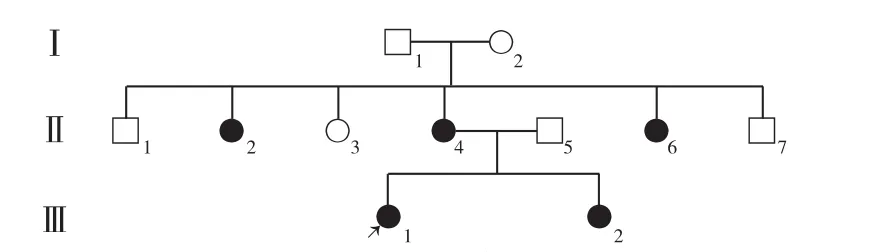
图2 先证者3家系图Figure 2 Family chart of proband 3
3 讨论
线粒体是除细胞核外唯一携带遗传物质的细胞器,而mtDNA由37个基因组成,包含2个rRNA基因、13个多肽编码基因和22个tRNA基因。因mtDNA缺少组蛋白保护及有效的自我修复机制,故易发生基因突变,在糖尿病患者中mtDNA的突变率约为1.5%,其中又以tRNA Leu(UUR)3243A→G点突变最为常见[2],而在有糖尿病家族史、发病年龄早(≤45岁)、非肥胖体型、使用胰岛素治疗的人群中突变率增至2.5%~11.1%[3-4]。1992年,VAN DEN OUWELAND等[5]报道了首例mtDNA tRNA 3243A→G突变引起的MDM的家系。1995年,项坤三等[6]首次在我国报道了tRNA 3243A→G点突变引起的MDM。自此研究者们开始重视对MDM的研究。
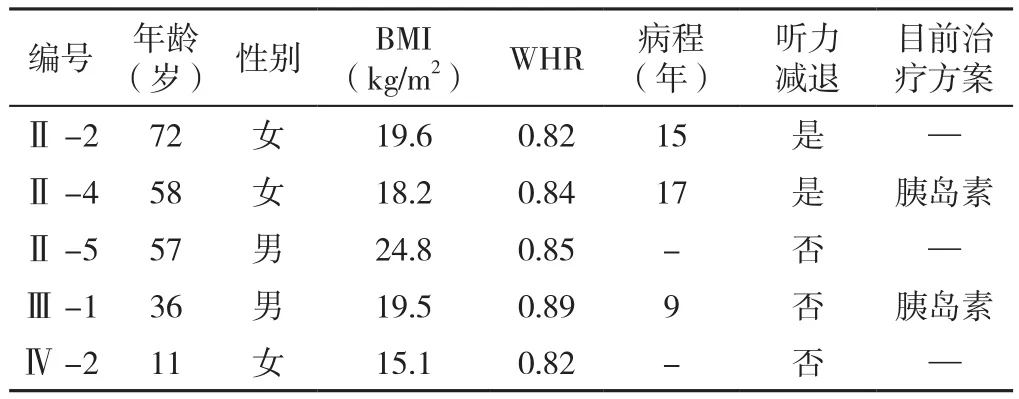
表2 先证者1家系成员一般资料Table 2 General information of the family members of proband 1
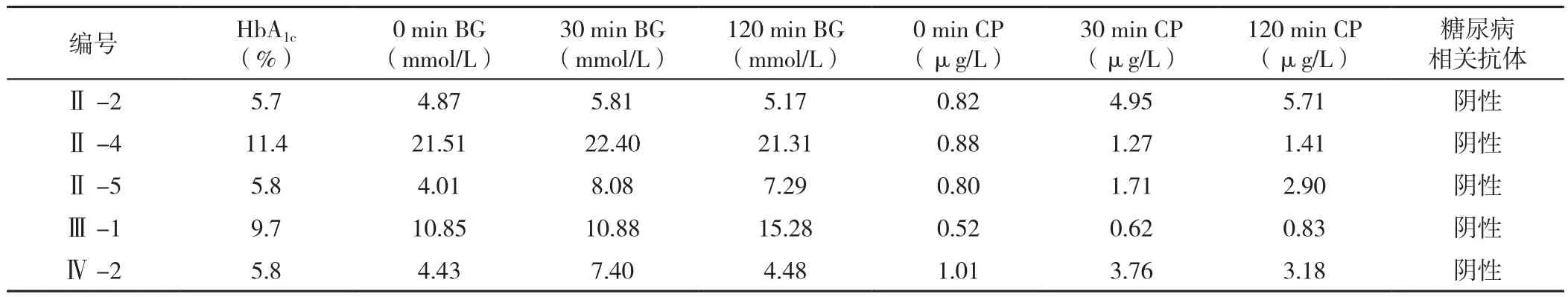
表3 先证者1家系成员生化指标Table 3 Biochemical parameters of the family members of proband 1
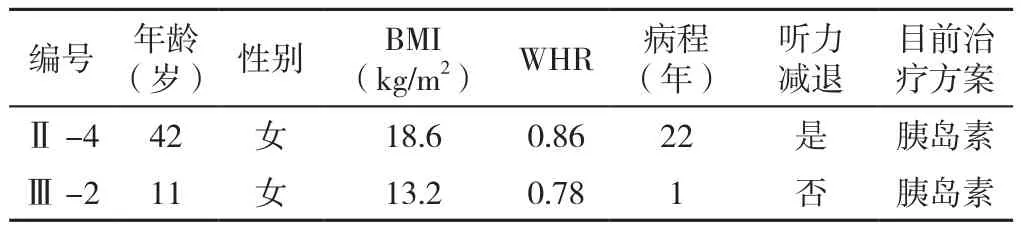
表4 先证者3家系成员一般资料Table 4 General information of the family members of proband 3
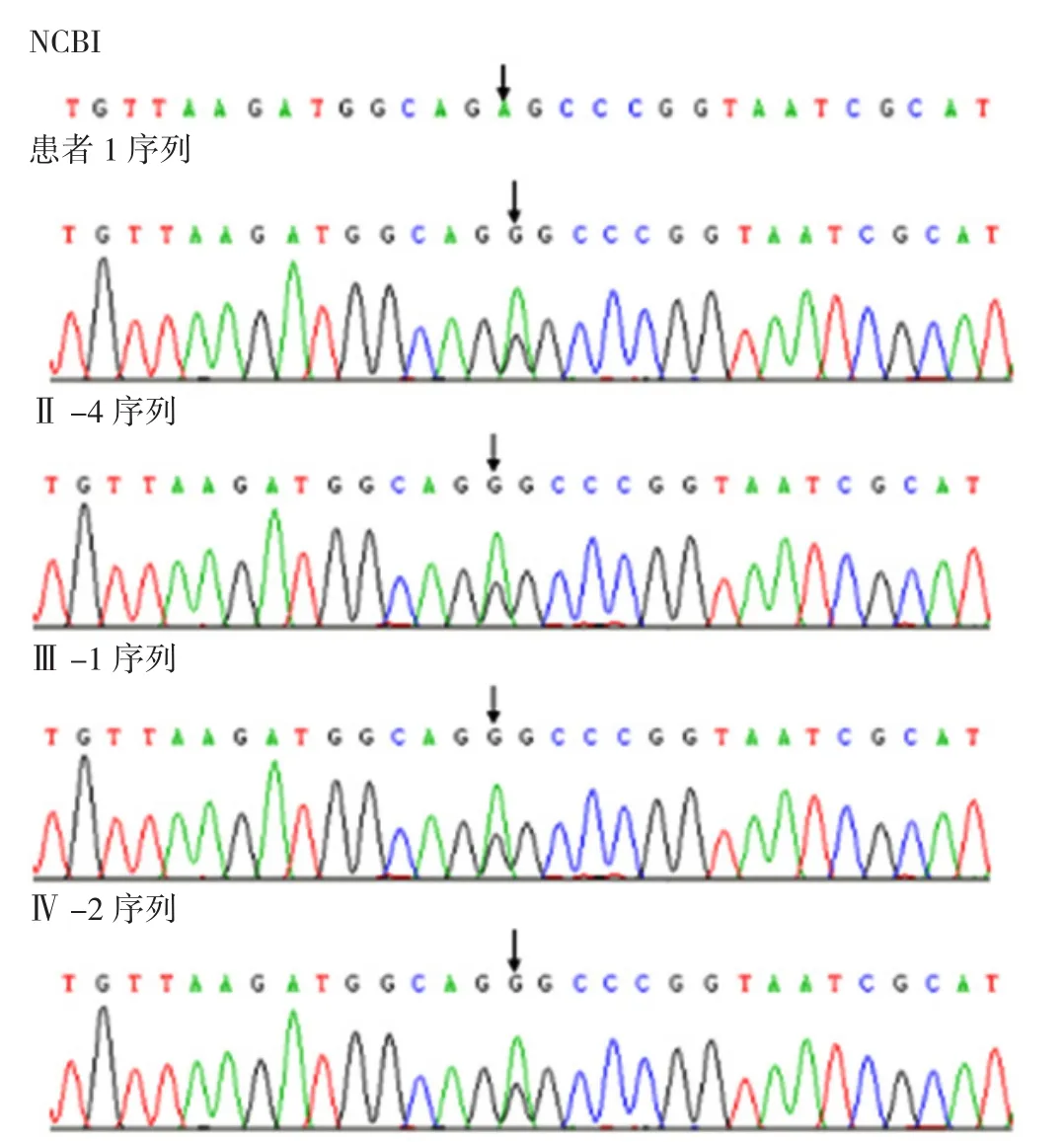
图3 先证者1及其家系成员基因测序结果Figure 3 Pedigree gene sequence of proband 1 and her family members

表5 先证者3家系成员生化指标Table 5 Biochemical parameters of the family members of proband 3
本研究3例患者发病年龄较低,均为非肥胖体型,均存在胰岛β细胞功能障碍,胰岛素相关抗体检测均阴性,患者1、患者2早期即出现听力减退。研究发现,MDM患者易出现听力障碍,且男性听力受损程度更重,进展更快[7]。耳蜗是MDM患者听力受损的主要部位,OLMOS等[8]研究发现,tRNA Leu(UUR)3243A→G突变可使内耳血管边缘细胞腺苷三磷酸减少,并致使柯蒂氏器外毛细胞放大声波所需能量较少,故而导致听力受损。RAUT等[9]通过植入人工耳蜗治愈了MDM患者的听力障碍,也侧面印证了损伤部位在耳蜗。本研究3例先证者由于发病年龄较低(<30岁)且体型偏瘦、血糖控制较差,血清空腹CP水平低而一直诊断为T1DM,但经仔细询问病史及伴随症状、认真体检后发现其早期即表现为听力减退,且第一例先证者有明确家族史、家系成员亦伴听力障碍而拟诊为MDM,再进一步完善基因检测后明确3例患者均携带tRNA 3243突变基因。先证者1有明显的母系遗传特点,先证者1兄妹两人及其母亲均为糖尿病患者,父亲无糖尿病病史;对该家系中共6人行基因检测,共发现4人携带tRNA 3243突变基因,其中3例已表现为糖尿病,2例伴有听力减退,先证者1女儿(Ⅳ-2)携带tRNA 3243突变基因但暂未表现为糖尿病及无听力下降,因其母亲(Ⅲ-3)亦携带tRNA 3243突变基因,因此需定期监测其血糖及听力,以早期做出诊断。先证者3亦有明显的母系遗传特点,先证者3姐妹两人、母亲及两个姨娘均为糖尿病患者,发病年龄均约为20岁,其母亲及姨娘均伴有听力减退。虽先证者3及其妹妹暂未表现为听力减退,但因先证者3检出tRNA 3243突变基因,故需定期监测先证者3姐妹两人的听力。
因MDM的主要发病机制为胰岛β细胞分泌胰岛素障碍,且mtDNA突变会加重β细胞凋亡[10],故MDM一经确诊,应早期予以胰岛素治疗。对于药物治疗,虽然二甲双胍为糖尿病的首选及一线用药,但因其会抑制线粒体的氧化还原作用,加重乳酸酸中毒风险,故MDM患者不宜使用[11];此外,NINOMIYA等[12]研究表明,吡格列酮在MDM患者中也有一定作用,其原因可能与提高血浆脂联素水平从而改善脂肪组织功能障碍相关,这为MDM患者的药物治疗提供了另一个方向。另外,一些改善线粒体能量代谢的药物也可以作为MDM的辅助用药,包括辅酶Q10[13]、硫辛酸[14]等,但是基因治疗才是根本治疗。TACHIBANA等[15]已成功通过基因移植在猴子模型中成功进行了基因治疗,而TONIN等[16]设计的特殊的RNA分子导入培养人体细胞的线粒体后成功降低了DNA突变率,提示了基因治疗将来可能用于治疗MDM,但目前尚未应用于临床,仍需进一步探索。
综上所述,对于发病年龄低、非肥胖体型、胰岛β细胞功能障碍、母系遗传、伴有听力下降的糖尿病患者需提高警惕,应仔细询问其伴随症状及家族史,考虑MDM的可能,必要时完善听力专科检测,并尽早完善基因检测,以便及时确诊,规范治疗。tRNA 3243A→G点突变的MDM常表现为听力障碍,而对于确诊的MDM患者应早期予以胰岛素治疗,避免使用双胍类药物,基因治疗有望成为未来治疗MDM的重要手段。应尽量动员MDM先证者家系成员筛查血糖、听力,必要时完善基因检测,以便早期诊断,改善预后,同时期待产前诊断和治疗技术的发展,从而通过早期干预而最终改善其结局。
作者贡献:胡红琳、章秋、王祺进行文章的构思与设计,研究的实施与可行性分析;张娜娜、黄有烨进行数据收集及整理;张娜娜进行统计学处理,结果的分析与解释,撰写论文;胡红琳进行论文的修订,负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
