冠菌素对低温胁迫下棉花幼苗AsA-GSH 循环的调控效应研究
2020-10-10李进翟梦华于春欣王莉张军高周小云梁晶段留生雷斌
李进,翟梦华,于春欣,王莉,张军高,周小云,梁晶,段留生*,雷斌*
(1. 新疆农业科学院核技术生物技术研究所/ 农业部荒漠绿洲作物生理生态与耕作重点实验室,乌鲁木齐830091;2. 新疆农业大学农学院,乌鲁木齐830052;3. 中国农业大学农学院/ 植物生长调节剂教育部工程研究中心,北京100193)
棉花(Gossypium hirsutum L.)是新疆重要的经济作物,2019 年种植面积为254.05 万hm2,总产为500.20 万t, 分别占全国棉花种植面积和总产的76.0%和84.9%,已然形成了“世界棉花看中国,中国棉花看新疆”的格局。 新疆棉花规模化、机械化和集约化发展的同时面临诸多问题,尤其是苗期“倒春寒”和低温冷害造成的死苗问题亟待解决[1-3]。 因此,探索棉花苗期防灾减灾和抗低温技术手段是现阶段新疆棉花提质增效研究中必不可少的内容,也对新疆棉花产业高质量持续健康发展具有理论指导和实践意义。
低温胁迫下植物体内产生大量活性氧(Reactive oxygen species,ROS), 引起膜脂过氧化程度增加,造成膜系统损伤,导致植物生理生化代谢紊乱,严重抑制植物生长发育[4-6]。抗坏血酸-谷胱甘肽(Ascorbate-glutathione, AsA-GSH)循环系统是植物体内清除活性氧的重要途径,抗氧化物质和酶类共同参与植物细胞中ROS 清除[7-9]。 已有研究表明, 低温胁迫下2, 4- 表油菜素内酯(2,4-Epibrassinolide, EBR) 和5- 氨 基 乙 酰 丙 酸(5-Aminolevulinic acid,ALA)能显著提高辣椒幼苗保护酶活性和非酶抗氧化物质含量[10-11],水杨酸(Salicylic acid,SA)也可以诱导枇杷[12]和甜瓜[13]组织内抗氧化酶活性升高,激活组织中AsA-GSH循环系统,提高植株耐低温性能,缓解低温胁迫对植株造成的伤害,但研究主要集中在果蔬等特色小宗经济作物上。
冠菌素(Coronatine, COR)是丁香假单胞菌分泌的1 种代谢产物,其化学结构和性质与茉莉酸类(Jasmonic acid, JA)相似,且生物活性是JA的100~10 000 倍, 具有调控作物生长和提高作物抗逆性的作用[14-16]。 研究表明,冠菌素可以增强冬小麦耐旱性和抗高温性[17-18],提高水稻抗旱性[19]和玉米抗冷性[20],缓解棉花苗期盐胁迫[21-23]。 然而现阶段研究缓解棉花幼苗低温胁迫的植物生长调节剂主要集中在EBR 和SA 上,研究内容多为幼苗生长、光合荧光特性、酶活性和渗透调节物质等方面[24-26],外源植物生长调节剂调控低温胁迫下棉花幼苗AsA-GSH 循环代谢研究较少,尤其是根、茎、叶中同时研究的更少见。 基于此,本研究以新陆早57 号为试验材料, 冠菌素为供试植物生长调节剂,4 ℃/4 ℃(昼/ 夜)为低温胁迫温度,25 ℃/25 ℃(昼/ 夜)为对照温度,研究冠菌素对低温胁迫下棉花幼苗根、 茎和叶AsA-GSH 循环中抗氧化物质含量、 氧化还原状态和抗氧化酶活性的变化规律, 揭示冠菌素对低温胁迫下棉花幼苗的调控效应, 丰富棉花耐低温机理和高产栽培理论。
1 材料与方法
1.1 试验材料
供试棉花品种为新陆早57 号, 由新疆农业科学院经济作物研究所提供;供试植物生长调节剂为冠菌素,由中国农业大学植物生长调节剂教育部工程研究中心提供; 基质为丹麦品氏基质(PINDSTRUP),营养钵为育苗营养钵(规格:下底直径×上口直径×高度:6 cm×8.5 cm×10 cm),基质和营养钵购于新疆明珠花卉市场。
1.2 试验设计
试验于2019 年2—10 月在农业部荒漠绿洲作物生理生态与耕作重点实验室 (乌鲁木齐)进行。 挑选籽粒饱满、大小均匀的棉花种子,75%酒精消毒120 s,无菌水冲洗3 次,将棉种播于装满基质的育苗营养钵中, 每钵9 粒种子, 共计100钵。 幼苗顶土前用农用地膜封口,置于光照培养箱中培养(光照强度:100 μmol·m-2·s-1,光暗周期为14 h/10 h, 温度:28 ℃/22 ℃, 相对湿度:70%~75%),子叶平展时每钵定苗4 株,每天补充适量蒸馏水,长至2 叶期舍弃长势较差且不整齐的营养钵,筛选长势较好且整齐一致的幼苗进行处理。 本试验共设计4 个处理:喷施清水常温处理(CK),喷施冠菌素常温处理(COR),喷施清水低温处理(LT)和喷施冠菌素低温处理(LT+COR),其中低温处理为4 ℃/4 ℃(昼/ 夜),常温处理为25 ℃/25 ℃(昼/ 夜), 冠菌素浓度参考Xie 等[21-23]在棉花中确定的最适浓度(0.01 μmol·L-1)。 CK 和LT 处理喷施等体积清水,喷施时保证雾滴在叶片正反表面均匀分布,且不超过流失点, 每个处理重复3 次。 喷施结束后将CK 和COR 处理置于1 个培养箱(温度:25 ℃/25 ℃),LT 和LT+COR 处理置于另1 个同款培养箱(温度:4 ℃/4 ℃)。处理1 d 后采集4 个处理根、茎和叶样品,测定生理指标。 试验期间每个处理其他环境条件及培养措施均一致。
1.3 测定指标与方法
取各处理2 叶期棉花幼苗植株,自来水冲洗表面残留基质等杂质后再用蒸馏水迅速清洗3次,滤纸吸干表面水渍,用剪刀从每株棉花幼苗子叶节处剪开(根选取子叶节以下部位,茎选取子叶节以上主干部位,叶片选取第2 片真叶)。 各处理根、茎或叶采集样品均为15 株混合样,每处理约1.0 g,重复3 次,合计约3.0 g。 锡箔纸包好标记后迅速放入装有液氮的泡沫箱中,经液氮速冻后保存于-80 ℃冰箱中用于测定还原型抗坏血酸(Reduced ascorbic acid,AsA)、氧化型抗坏血酸 (Dehydroascorbate,DHA)、 还原型谷胱甘肽(Reduced glutathione, GSH) 和氧化型谷胱甘肽(Oxidized glutathione, GSSG)含量,计算抗坏血酸含量、还原型和氧化型抗坏血酸的含量比(本文用AsA/DHA 表示)、谷胱甘肽含量、还原型和氧化型谷光甘肽的含量比(本文用GSH/GSSG 表示);测定蛋白质质量浓度、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、单脱氢抗坏血酸还原 酶 (Monodehydroascorbate reductase, MDHAR)、 脱氢抗坏血酸还原酶(Dehydroascorbate reductase, DHAR)、 谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX) 和谷胱甘肽还原酶(Glutathione reductase,GR)活性。
准确称取4 个处理根、 茎和叶样品各0.1 g,采用苏州科铭生物技术有限公司研发的各指标试剂盒提取样品的上清液,置于冰盒内待测。 W为鲜样本质量(g),Cpr为上清液蛋白质质量浓度(mg·mL-1)。
1.3.1 AsA 含量。 按照AsA 测定试剂盒(货号:AsA-1-W) 说明书配制空白管和测定管待测液,静置20 min 后吸取200 μL 加入96 孔板中,酶标仪在420 nm 处测定吸光值A测和A空,△A=A测-A空。 计算公式:AsA 含量(μmol·g-1)=227.27×(△A+0.018)÷W。
1.3.2 DHA 含量。 按照DHA 测定试剂盒(货号:DHA-1-W) 说明书配制空白管和测定管待测液,迅速混匀后在265 nm 处测定10 s 和130 s 吸光值A空1、A空2和A测1、A测2,△A空=A空2-A空1,△A测=A测2-A测1。 计 算 公 式:DHA 含 量(μmol·g-1)=100×△A测÷△A空÷W。
1.3.3 GSH 含量。 按照GSH 测定试剂盒(货号:GSH-1-W) 说明书配制空白管和测定管待测液。混匀静置2 min 后在412 nm 处测定吸光值A空和A测。 计 算 公 式:GSH 含 量 (nmol·g-1)=1.334×(A测-A空)÷W。
1.3.4 GSSG 含量。 按照GSSG 测定试剂盒(货号:GSSG-1-W)说明书配制待测混合液。 混匀后在412 nm 处测定30 s 和150 s 吸光值A1和A2,△A=A2-A1。计算公式:GSSG 含量(nmol·g-1)=72.46×(△A+0.001 1)÷W。
1.3.5 蛋白质质量浓度。 按照蛋白质测定试剂盒(货号:BCAP-1-W)说明书配制空白管、标准管和测定管待测液,60 ℃保温30 min 后加入96 孔板在562 nm 处测定吸光值A,分别记为A空、A标和A测。 计算公式:Cpr(mg·mL-1)=0.5×(A测-A空)÷(A标-A空)。
1.3.6 APX 活性。 按照APX 测定试剂盒(货号:APX-1-W) 说明书配制待测液, 迅速混匀后在290 nm 处 测 定10 s 和130 s 吸 光 值A1和A2,△A=A1-A2。 计算公式:APX 活性(μmol·min-1·mg-1)=3.58×△A÷Cpr。 以25 ℃中每毫克蛋白每分钟氧化1 μmol AsA 为1 个酶活单位。
1.3.7 MDHAR 活性。按照MDHAR 测定试剂盒(货号:MDHAR-1-W)说明书配制待测液,迅速混匀后在340 nm 处测定30 s 和150 s 吸光值A1和A2,△A =A1-A2。 计 算 公 式:MDHAR 活 性(nmol·min-1·mg-1)=1 608×△A÷Cpr。 以25 ℃中每毫克蛋白每分钟氧化1 nmol NADH 为1 个酶活单位。
1.3.8 DHAR 活性。按照DHAR 测定试剂盒(货号:DHAR-1-W)说明书配制待测液,迅速混匀后在265 nm 处测定30 s 和150 s 吸光值A1和A2,△A=A2-A1。 计算公式:DHAR 活性 (nmol·min-1·mg-1)=184×△A÷Cpr。 以25 ℃中每毫克蛋白每分钟还原生成1 nmol AsA 为1 个酶活单位。
1.3.9 GPX 活性。 按照GPX 测定试剂盒(货号:GPX-1-W) 说明书配制空白管和测定管待测液,迅速混匀后在340 nm 处测定10 s 和190 s 吸光值A空1、A空2和A测1、A测2,△A空=A空1-A空2,△A测=A测1-A测2。计算公式:GPX 活性(nmol·min-1·mg-1)=1 072×(△A测-△A空)÷Cpr。 以25 ℃中每毫克蛋白每分钟催化1 nmol NADPH氧化为1 个酶活单位。
1.3.10 GR 活性。 按照GR 测定试剂盒 (货号:GR-1-W)说明书配制空白管和测定管待测液,迅速混匀后在340 nm 处测定10 s 和190 s 吸光值A空1、A空2和A测1、A测2,△A空=A空1-A空2,△A测=A测1-A测2。 计算公式:GR 活性(nmol·min-1·mg-1)=1 072×(△A测-△A空)÷Cpr。 以25 ℃和pH 8.0 条件下每毫克蛋白每分钟催化1 nmol NADPH 氧化为1 个酶活单位。
1.4 数据处理与分析
用Microsoft Excel 2010 进行数据计算,SPSS Statistics 25.0 软 件 进 行 方 差 分 析 (P <0.05), 邓肯氏法进行多重比较检验,GraphPad Prism 7.0 软件进行绘图。
2 结果与分析
2.1 冠菌素对低温胁迫下棉花幼苗抗坏血酸代谢酶活性的影响
图1A 显示,喷施冠菌素常温处理(COR)与喷施清水常温处理 (CK) 相比, 棉花幼苗根中APX 活性无显著性差异, 茎中APX 活性显著高于CK,叶中APX 活性与CK 差异不显著。 喷施清水低温处理(LT)后棉花幼苗根中APX 活性与CK 无显著性差异,茎和叶中APX 活性较CK 显著降低8.93%和5.67%。 喷施冠菌素低温处理(LT+COR)后棉花幼苗根中APX 活性较LT 无显著性差异,茎中APX 活性显著高于LT,而叶中APX 活性较LT 有所升高,但差异不显著。 说明低温胁迫抑制了棉花幼苗茎和叶中APX 活性,喷施COR 可提高茎和叶中APX 活性。
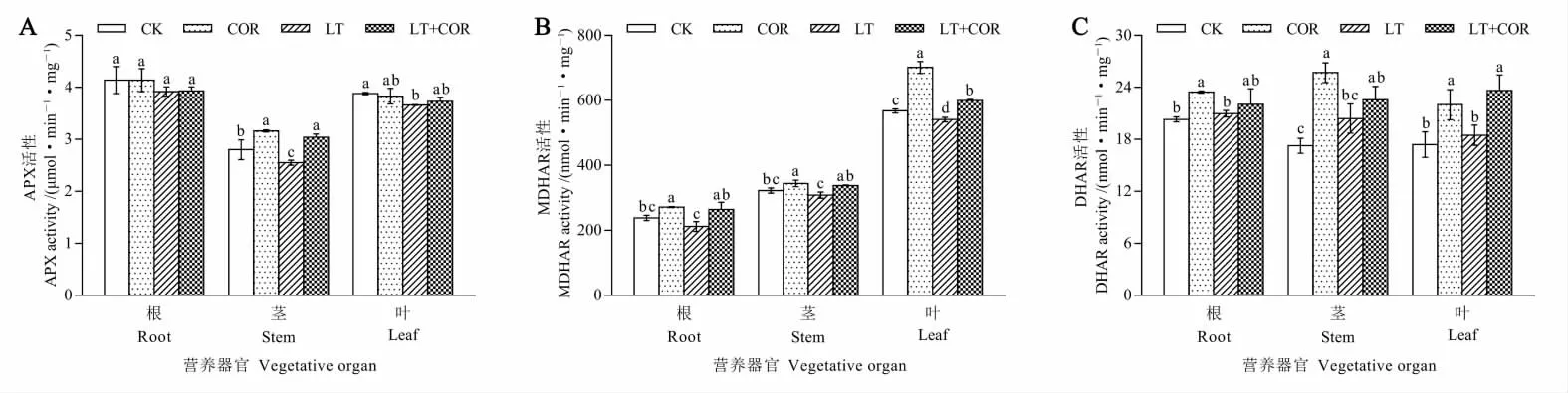
图1 冠菌素对低温胁迫下棉花幼苗营养器官APX、MDHAR 和DHAR 活性的影响Fig. 1 Effects of coronatine on APX, MDHAR and DHAR activities in the vegetative organ of cotton seedling under low temperature stress
由图1B 可以看出, 喷施冠菌素常温处理(COR)后棉花幼苗根、茎和叶中MDHAR 活性显著高于喷施清水常温处理(CK);喷施清水低温处理(LT)后根和茎中MDHAR 活性较CK 差异不显著, 叶中MDHAR 活性较CK 显著降低4.69%;而喷施冠菌素低温处理(LT+COR)后根、茎和叶中MDHAR 活性较LT 显著升高24.71%、9.50%和10.87%,且COR 和(LT+COR)处理后棉花幼苗根和茎中MDHAR 活性差异不显著,叶中MDHAR 活性差异显著。说明低温抑制了棉花幼苗根、茎和叶中MDHAR 活性,喷施COR 后可提高根、茎和叶中MDHAR 活性。
图1C 表明,喷施冠菌素常温处理(COR)后棉花幼苗根、茎和叶中DHAR 活性显著高于喷施清水常温处理(CK);喷施清水低温处理(LT)后棉花幼苗根、茎和叶中DHAR 活性与CK 差异不显著;喷施冠菌素低温处理(LT+COR)后棉花幼苗根和茎中DHAR 活性较LT 升高不显著,仅叶中DHAR 活性较LT 显著升高28.05%。 说明低温对棉花幼苗根、 茎和叶中DHAR 活性影响较小,但喷施COR 可显著提高根、茎和叶中DHAR活性。
2.2 冠菌素对低温胁迫下棉花幼苗抗坏血酸含量的影响
图2A 显示,棉花幼苗根中AsA 含量在喷施冠菌素常温处理(COR)、喷施清水低温处理(LT)和喷施冠菌素低温处理(LT+COR)之间无显著差异,三者均与喷施清水常温处理(CK)有显著差异,分别增加27.35%、20.63%和27.80%;COR、LT 和(LT+COR)处理下棉花幼苗茎中AsA 含量较CK 分别增加103.08%、84.62%和114.23%,(LT+COR)处理显著高于LT,与COR 处理差异不显著; 棉花幼苗叶中AsA 含量在COR、LT 和(LT+COR) 处理后较CK 分别增加216.52%、96.09%和122.17%,各处理之间差异显著。 说明棉花幼苗根、 茎和叶为适应低温胁迫而产生AsA,喷施COR 能进一步积累AsA,叶中AsA 含量变化幅度较大。

图2 冠菌素对低温胁迫下棉花幼苗营养器官AsA、DHA 和抗坏血酸含量的影响Fig. 2 Effects of coronatine on AsA, DHA and ascorbate contents in the vegetative organ of cotton seedling under low temperature stress
图2B 表明, 与喷施清水常温处理 (CK)相比,喷施冠菌素常温处理(COR)和喷施清水低温处理(LT)后棉花幼苗根中DHA 含量均未达到显著性差异,喷施冠菌素低温处理(LT+COR)后根中DHA 含量显著增加24.39%;LT 处理后棉花幼苗茎中DHA 含量较CK 显著减少31.19%,叶中DHA 含量与CK 差异不显著, 仅减少12.11%;(LT+COR)处理下茎和叶中DHA 含量较LT 显著增加44.00%和24.44%。 (LT+COR)处理后茎中DHA 含量显著低于COR,叶中DHA含量与COR 处理间差异不显著。 说明喷施COR可以加速抗坏血酸系统代谢, 增加棉花幼苗根、茎和叶中DHA 含量。
图2C 表明,喷施冠菌素常温处理(COR)、喷施清水低温处理 (LT) 和喷施冠菌素低温处理(LT+COR)后棉花幼苗根、茎和叶中抗坏血酸含量较喷施清水常温处理(CK)显著增加18.18%~27.65%、50.82%~84.51%和39.09%~101.23%,且(LT+COR)处理后茎和叶中抗坏血酸含量显著高于LT。说明低温或COR 均能诱导棉花幼苗根、茎和叶积累抗坏血酸,但COR 诱导作用更显著。
由图2D 可以看出, 喷施冠菌素常温处理(COR)、喷施清水低温处理(LT)和喷施冠菌素低温处理(LT+COR) 后棉花幼苗根中AsA/DHA与喷施清水常温处理(CK)无显著性差异,茎和叶中AsA/DHA 显著增加47.70%~167.36%和104.44%~223.33%,且叶中增幅较大。
2.3 冠菌素对低温胁迫下棉花幼苗谷胱甘肽代谢酶活性的影响
图3A 显示,喷施冠菌素常温处理(COR)、喷施清水低温处理 (LT) 和喷施冠菌素低温处理(LT+COR)后棉花幼苗根中GPX 活性较喷施清水常温处理 (CK) 显著升高10.55%、7.45%和22.37%,COR 和LT 处理间无显著性差异, 且显著低于(LT+COR)处理;LT 处理对棉花幼苗茎中GPX 活性无影响,COR 处理后棉花幼苗茎中GPX 活性与CK 差异不显著, 但较CK 增加4.17%,而(LT+COR)处理后棉花幼苗茎中GPX活性较CK 显著增加7.08%;COR、LT 和 (LT+COR) 处理后棉花幼苗叶中GPX 活性较CK 显著升高10.06%、17.69%和14.13%。说明棉花幼苗根、茎和叶通过升高GPX 活性来适应低温胁迫,喷施COR 可显著提高根、茎和叶中GPX 活性。
由图3B 可知,喷施清水低温处理(LT)后棉花幼苗根、茎和叶中GR 活性与喷施清水常温处理 (CK) 无显著差异; 喷施冠菌素常温处理(COR)和喷施冠菌素低温处理(LT+COR)后棉花幼苗根和茎中GR 活性显著升高, 较CK 分别升高18.68%~22.62%和46.75%~60.45%, 叶中GR 活性较CK 差异不显著。

图3 冠菌素对低温胁迫下棉花幼苗营养器官GPX 和GR 活性的影响Fig. 3 Effects of coronatine on GPX and GR activities in the vegetative organ of cotton seedling under low temperature stress
2.4 冠菌素对低温胁迫下棉花幼苗谷胱甘肽含量的影响
图4A 显示, 与喷施清水常温处理 (CK)相比,喷施冠菌素常温处理(COR)可以增加棉花幼苗根、茎和叶中GSH 含量,只有在茎中差异达到显著水平。喷施清水低温处理(LT)后棉花幼苗根和茎中GSH 含量较CK 显著降低5.53%和16.15%,叶中GSH 含量较CK 降低5.37%,但差异不显著,且喷施冠菌素低温处理(LT+COR)后棉花幼苗根、茎和叶中GSH 含量较LT 显著升高4.55%、7.66%和21.00%;COR 和 (LT+COR)处理后棉花幼苗根和茎中GSH 含量差异显著,叶中GSH 含量差异不显著。 说明低温胁迫抑制了GSH 产生,喷施COR 可增加GSH 含量。
由图4B 可以看出, 喷施冠菌素常温处理(COR)、喷施清水低温处理(LT)和喷施冠菌素低温处理(LT+COR)后棉花幼苗根中GSSG 含量较喷施清水常温处理 (CK) 显著增加15.26%、15.07%和17.03%,茎中GSSG 含量与CK 无显著性差异, 而LT 处理后棉花幼苗叶中GSSG 含量较CK 显著减少36.02%,(LT+COR) 处理后棉花幼苗叶片GSSG 含量较LT 显著升高23.18%,且COR 处理GSSG 含量显著低于(LT+COR)。
图4C 表明,喷施清水低温处理(LT)后棉花幼苗茎中谷胱甘肽含量较喷施清水常温处理(CK)显著下降,根和叶中差异不显著;喷施冠菌素低温处理(LT+COR)后根和叶中谷胱甘肽含量显著高于LT,茎中无显著性差异。 说明低温抑制了棉花幼苗根、 茎和叶中谷胱甘肽的积累,喷施COR 能诱导增加棉花幼苗根、 茎和叶中谷胱甘肽含量。
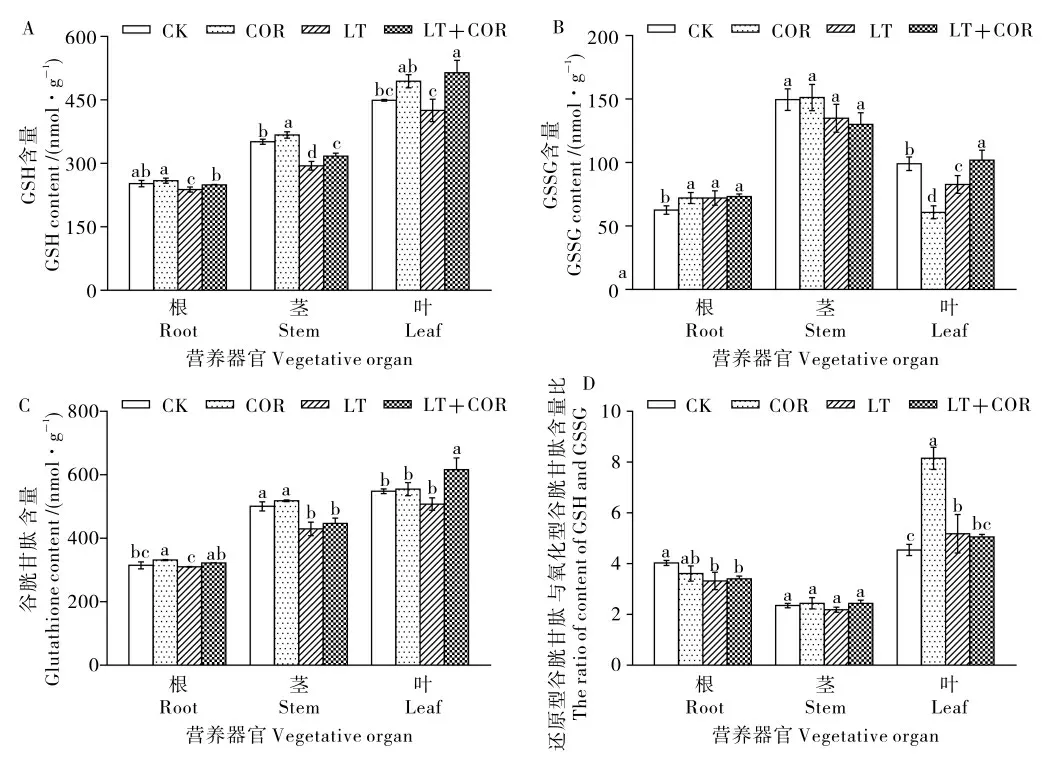
图4 冠菌素对低温胁迫下棉花幼苗营养器官GSH、GSSG 和谷胱甘肽含量的影响Fig. 4 Effects of coronatine on GSH, GSSG and glutathione contents in the vegetative organ of cotton seedling under low temperature stress
由图4D 可知,喷施清水低温处理(LT)和喷施冠菌素低温处理(LT+COR)后棉花幼苗根中GSH/GSSG 较喷施清水常温处理(CK)显著下降17.62%和15.63%, 而喷施冠菌素常温处理(COR) 较CK 差 异 不 显 著; 茎 中 各 处 理 的GSH/GSSG 与CK 无显著性差异;COR 和LT 处理后棉花幼苗叶中GSH/GSSG 比CK 显著增加79.52%和14.10%,而(LT+COR)处理后棉花幼苗叶中GSH/GSSG 较CK 增加不显著, 仅为11.23%。 说明低温胁迫造成棉花幼苗根中GSH/GSSG 下降,叶中GSH/GSSG 增加,对茎无影响, 喷施COR 常温处理对叶中GSH/GSSG 影响较大。
3 讨论
3.1 冠菌素对低温胁迫下棉花幼苗抗坏血酸代谢酶活性及抗氧化物质含量的影响
AsA 是AsA-GSH 循环系统中清除活性氧的重要抗氧化物质,在APX 作用下与H2O2反应生成H2O,从而清除H2O2的毒性。 AsA 被氧化形成MDHA, 部分MDHA 进一步氧化形成DHA,而MDHA 和DHA 分别在MDHAR 和DHAR 的催化下又可以生成AsA[27-28]。 刁倩楠等[13]研究表明,甜瓜幼苗经6 ℃低温胁迫7 d,其叶片中APX 活性升高26.83%, 而DHAR 活性、AsA、DHA 含量及AsA/DHA 显著降低54.54%、68.29%、74.51%和76.37%,喷施1.0 mmol·L-1SA 能明显提高叶片 中 APX 和 DHAR 活 性、AsA 含 量 和AsA/DHA。 相昆等[29]研究表明,核桃幼苗经8 ℃低温胁迫3 d, 其叶片APX、DHAR 活性、AsA 含量及AsA/DHA 下降,DHA 含量升高, 喷施硝普钠(Sodium nitroprusside, SNP)后核桃幼苗叶片APX 活性显著升高,AsA 和DHA 含量增加。Nahar 等[30]研究表明,绿豆幼苗经6 ℃低温胁迫5 d 时生长受到抑制,AsA-GSH 循环中非酶物质和酶类活性比例发生变化, 当喷施亚精胺(Spermidine, Spd) 时AsA 和GSH 含 量、AsA/DHA 和GSH/GSSG 均 增 加,APX、MDHAR、DHAR 和GR 活性也升高,而DHA 和GSSG 含量减少。 本研究表明,4 ℃低温胁迫抑制了棉花幼苗抗氧化酶活性,降低了棉花幼苗根、茎和叶清除活性氧能力, 引起AsA 转化受阻, 造成根、 茎和叶中AsA 含量高于CK,且在DHAR 催化作用下可将DHA 转化为AsA,使得棉花幼苗茎和叶DHA 含量低于CK,从而引起AsA/DHA 增加。喷施COR常温或低温处理均能诱导棉花幼苗根、茎和叶中抗氧化酶活性升高, 增加清除活性氧的能力,提升AsA 转化效率, 同时MDHA 和DHA 分别在MDHAR 和DHAR 的催化作用下转化为AsA,造成根、 茎和叶中AsA 含量高于CK, 根和叶中DHA 转化效率高于茎, 导致茎中DHA 含量增加,且茎中AsA 含量增加幅度大于DHA,茎和叶中AsA/DHA 增加,使根中AsA/DHA 无变化,各指标变化规律与甜瓜、核桃及绿豆上研究结果较一致[13,29-30]。由此可见,喷施COR 可以提高DHAR和MDHAR 活性,从而增加AsA 的产生速率,且维持APX 活性来减少AsA 转化速率, 最终增加棉花幼苗营养器官中AsA 及抗坏血酸含量,提高AsA/DHA,增强棉花幼苗抗低温能力。
3.2 冠菌素对低温胁迫下棉花幼苗谷胱甘肽代谢酶活性及抗氧化物质含量的影响
GSH 作为AsA-GSH 循环中重要的抗氧化剂之一,可维持膜蛋白结构稳定。 GPX 和DHAR 能特异催化GSH 生成GSSG,而GR 可催化GSSG生成GSH, 其活性水平与细胞GSH 库关系密切[31-32]。 黄志明等[12]研究表明,枇杷幼果经低温胁迫后喷施70 mg·L-1SA 可以增加GSH 含量和GSH/GSSG, 降低GSSG 含量, 同时提高GR 和GPX 活性。 Liu 等[33]研究表明,番茄幼苗经8 ℃低温胁迫24 h 时GSH 和GSSG 含量均增加,但GSSG 含量增加较多,使GSH/GSSG 减小,且GR活性降低;当喷施25 mg·L-1ALA 时GSH 含量、GSH/GSSG 及GR 活性均增加,而GSSG 含量减少。 本研究结果显示, 较高活性水平的GPX 和DHAR 能催化GSH 生成GSSG,造成根、茎和叶中GSH 含量下降,使根中GSH 含量增加,但叶中GPX 和DHAR 活性低于根和茎, 导致GSSG含量随之减少, 然而茎中GR 活性高于根和叶,加速了GSSG 的转化速率,导致茎中GSSG 含量无 变 化; 最 终 根 中GSH/GSSG 下 降, 茎 中GSH/GSSG 无变化, 叶中GSH/GSSG 增加,即棉花幼苗根、茎和叶通过升高或维持GPX 和GR活性在正常水平来适应低温环境。 低温胁迫对棉花幼苗根损伤程度较大。 此外,喷施COR 常温处理增加了棉花幼苗根、 茎和叶清除活性氧能力,GPX 和DHAR 活性升高加速了循环代谢, 保证细胞膜的稳定性。 喷施COR 造成棉花幼苗根、茎和叶中GSH 含量增加,喷施COR 常温处理引起根中GSSG 含量增加, 茎中GSSG 含量无变化,叶中GSSG 含量随之减少, 而喷施COR 低温处理引起根和茎中GSSG 含量无变化, 而叶中GSSG 含量增加;喷施COR 引起根中GSH/GSSG下降,茎中GSH/GSSG 无变化,叶中GSH/GSSG增加。 因此,喷施COR 可以提高GPX 和GR 活性, 从而使GSH 含量和GSH/GSSG 维持在较高水平,提高棉花幼苗抗低温能力。
4 结论
棉花幼苗通过抑制APX 和MDHAR 活性、升高GPX 活性、 维持DHAR 和GR 活性来调节根、 茎和叶中抗氧化物质含量和氧化还原状态,以适应低温胁迫。 4 ℃低温胁迫对棉花幼苗根损伤程度最大。 喷施COR 可以激活棉花幼苗营养器官中AsA-GSH 循环代谢,通过提高DHAR 和MDHAR 活性来增加AsA 的产生速率,通过维持APX 活性来减少AsA 转化速率, 最终增加棉花幼苗营养器官中AsA 和抗坏血酸含量, 提高AsA/DHA; 此外, 喷施COR 可以升高GPX 和GR 活性使GSH 含量和GSH/GSSG 维持在较高水平, 用来清除棉花幼苗组织中过多的H2O2,保证细胞膜的稳定性和完整性,提高棉花幼苗抗低温能力。 低温胁迫下喷施COR 对叶片缓解作用最强。
