不同处理梯度污水对细菌群落和酶活性的影响
2020-10-09吴晓斐何源黄治平张丹丹郑宏艳丁健
吴晓斐,何源,黄治平,张丹丹,郑宏艳,丁健
(农业农村部环境保护科研监测所,天津300191)
据《2018年中国水资源公报》[1]显示,2018年我国年用水总量为6 015.5亿m3,其中农业年用水总量占61.4%,随着淡水资源的短缺以及人们环保意识的提高,大家开始寻找其他途径以减少农业淡水用量。因生活污水中含有大量的氮磷等植物生长所必需的营养元素而使得污水灌溉进入大众视野,特别是农村厕所革命后,经三格化粪池、三联式沼气池和双瓮漏斗式等处理系统产生的生活污水,其含重金属等有害物质极少[2],利用此类污水进行灌溉不仅可以缓解用水压力,还可减少农业中化肥的使用量,降低经济成本及其对环境的污染。在生态系统中,土壤微生物在物质循环和能量流动中占有重要地位,微生物的生物活性以及种群组成能够反映土壤肥力及土壤质量,当微生物多样性指数提高时,土壤综合肥力指数随之呈现不同形式的上升趋势[3-4],且土壤微生物还可以预警生态系统的变化[5]。土壤酶参与了土壤中的腐殖质合成分解、有机物的水解和转化以及各种氧化还原反应等,土壤理化性质的变化以及水肥管理措施、耕作措施、种植条件等,都会对土壤酶活性产生影响,研究表明土壤脲酶、蔗糖酶和磷酸酶与土壤养分具有显著正相关关系[6-7],因而土壤酶活性是土壤肥力的指示指标之一[8-9]。正是因为土壤微生物和酶活性对土壤肥力的指示作用,所以肥料的施用会对微生物丰富度、多样性及群落结构和土壤酶活性产生影响[10-11]。研究认为肥料的合理施用对土壤微生物群落结构和土壤酶活性具有积极的影响,Guo等[12]利用小麦-大豆轮作系统研究不同肥料组合对土壤微生物群落结构的影响,结果表明牛粪促进了Deltaproteobacteria和Bacteroidetes的相对丰度;刘佳欢等[13]发现适量施用肥料对土壤微生物数量和土壤酶活性具有显著促进作用;但研究发现在使用再生水灌溉时减少氮肥的使用量更有利于土壤微生物多样性的增加[10]。
农村地区因存在村民居住分散、污水收集管道建设不完善、缺乏资金支持和后续的技术管理人员等问题,所以在污水合理利用、降低生活污水处理成本及保护环境等方面有所不便,在选择农村污水处理技术的同时,研究在不同污水处理梯度下的污水资源化利用,即将污水处理到何种程度进行污水回灌等资源化利用,可解决以上问题。郭魏等[14]利用连续砂滤池工艺的尾水连续5年灌溉番茄,发现蔗糖酶活性有所降低,且在低氮条件下再生水灌溉对细菌群落结构影响较小,在高氮条件下再生水促进细菌生长;杨茜[15]利用生活污水原水、厌氧出水和“厌氧+人工湿地技术”尾水回灌,厌氧出水灌溉对土壤酶活性无显著影响,但对土壤有益菌属具有一定的促进作用。高远等[16]则认为A2O工艺的尾水灌溉对土壤细菌数量和土壤细菌群落多样性具有抑制作用;周媛等[11]利用A/O反硝化生物滤池和臭氧氧化组合工艺的二级出水灌溉番茄,发现污水灌溉对土壤脲酶和淀粉酶活性有促进作用,对土壤蔗糖酶和过氧化氢酶活性有抑制作用,且施氮处理对土壤酶活性具有显著影响。由此可见,在不同污水处理工艺和肥料的共同作用下,不同处理梯度的污水对土壤微生物群落结构和酶活性的影响结果不尽相同,且以往研究选取的污水处理梯度较少,多数仅选取一种或两种污水处理梯度,缺少完整污水处理工艺下的各种污水处理梯度的研究,因此本文依据当地农村实际情况,选择适宜当地的生活污水处理工艺,探讨在各处理梯度污水资源化利用条件下,对土壤微生物群落结构和酶活性负面影响较小或具有正面影响的污水处理梯度,对选取合适的农村污水处理程度等方面具有重要意义。本研究通过小型污水处理装置获取不同处理程度的污水,在不同的施肥条件下,采用室内模拟试验对污水灌溉的茭白-水稻轮作土壤进行分析,探讨不同处理梯度污水对土壤细菌群落结构和酶活性的影响,以期为降低污水处理成本及生活污水水质安全性回灌提供数据支持。
1 材料与方法
1.1 供试土壤和试验用水
试验土壤取自合肥市肥西县紫蓬镇新农村水稻田内,除去地面杂草,收集0~25 cm层土壤。土壤收集后自然风干,去除草根、石粒等杂物,过20目筛备用。供试土壤pH值6.35,有机质12.77 g·kg-1,全氮0.91 g·kg-1,全磷0.46 g·kg-1,速效钾110.44 mg·kg-1,速效磷12.34 mg·kg-1,碱解氮121.36 mg·kg-1。
生活污水原水取自安徽省合肥市蜀山区安徽中棉种业长江有限责任公司污水池内,经小型污水处理试验装置(图1),其污水处理流程为污水池→厌氧→储水池→接触氧化→储水池→土地处理系统→出水。
本研究的试验用水取自上述污水处理试验装置,其中:污水处理梯度(1)为未经处理设施处理,取自污水池的生活污水;污水处理梯度(2)为经厌氧工艺的出水,取自三级厌氧池后的储水池;污水处理梯度(3)为经厌氧+接触氧化工艺的出水,取自接触氧化池后的储水池;污水处理梯度(4)为经厌氧+接触氧化+土地处理系统工艺的出水,取自污水处理装置的最终出水,(5)为清水作为对照,各污水水质见表1。
1.2 试验设计方案
室内模拟试验为盆栽试验,用PVC板做成长40 cm、宽40 cm、高50 cm的试验盆,在试验盆内填土种植水稻和茭白。每个试验盆中填土30.0 kg,施用底肥后将每个盆中用清水浇透,采用茭白-水稻轮作模式进行盆栽试验。其中污水灌溉设5个处理:清水灌溉、处理梯度(1)出水、处理梯度(2)出水、处理梯度(3)出水和处理梯度(4)出水;施肥设两个处理:完全不施肥W(0 kg N·hm-2)、施肥降低20%F(180 kg N·hm-2)。各处理分别用W1:不施肥水平下生活污水灌溉;FW1:施肥水平下生活污水灌溉;W2:不施肥水平下处理梯度(2)出水灌溉;FW2:施肥水平下处理梯度(2)出水灌溉;W3:不施肥水平下处理梯度(3)出水灌溉;FW3:施肥水平下处理梯度(3)出水灌溉;W4:不施肥水平下处理梯度(4)出水灌溉;FW4:施肥水平下处理梯度(4)出水灌溉;CK:不施肥水平下清水灌溉;FCK:施肥水平下清水灌溉表示。因污水中含有氮磷等营养元素,因此选择的施肥量180 kg N·hm-2是本地农田常规用量的80%。该研究共10个处理,每个处理设3次重复。
本试验肥料选用复合肥料(N-P2O5-K2O:15-15-15)作底肥施入盆内,且在水稻分蘖期按75 kg·hm-2的标准追施肥料。选取长势和大小一致的茭白无性繁殖体,确保每盆存活的茭白植株为1株,待所有植物地上部分均正常生长后,开始污水灌溉,加入频次均为每日一次,每次1.0 L,各处理灌溉时间和灌水定额相同;茭白收获后,选取水稻秧苗以10 cm×10 cm的密度进行移栽种植,在分蘖期保持水层1.5 cm,分蘖末期保持水层3.0 cm,其他时期保持平均水层2.5 cm。
1.3 样品采集
水稻成熟后选取0~20 cm土壤层,采用五点法采集土壤,一部分新鲜土壤在0~4℃下保存用于土壤微生物的分离;另一部分新鲜土壤进行风干处理,用带电玻璃棒吸附除去细根,拣去石砾及植物残体,过1 mm和0.25 mm筛,用于土壤脲酶、蔗糖酶和碱性磷酸酶活性的测定。
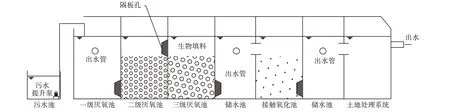
图1污水处理试验装置示意图Figure 1 Schematic diagramof sewage treatment test facility
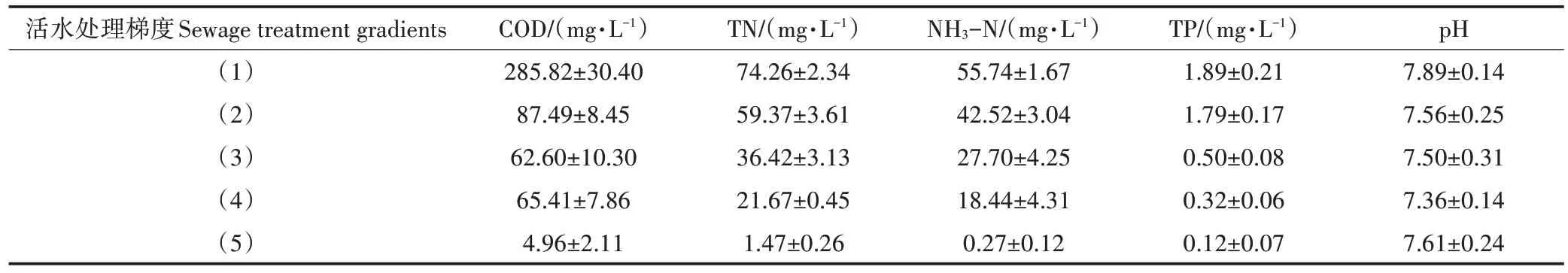
表1试验用水水质Table 1 Test water quality
1.4 土壤酶活性测定方法
土壤脲酶活性采用苯酚钠比色法测定,土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定,土壤蔗糖酶活性采用3,5-二硝基水杨酸比色法测定[17]。
1.5 土壤微生物群落结构分析
1.5.1 DNA提取
DNA提取参照DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒说明书,提取得到的DNA样品用1%琼脂糖凝胶电泳检测,并用分光光度法(260 nm/280 nm光密度比)进行质量检测。
1.5.2 MiSeq测序
微生物多样性检测选取细菌16SrDNA V3~V4区,DNA样本使用Illumina Miseq PE300高通量测序平台测序。细菌16SrDNA V3~V4扩增引物为338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)。PCR反应体系(总体系为25µL):12.5µL KAPA 2G Robust Hot Start Ready Mix、1µL Forward Primer(5µmol·L-1)、1µL Reverse Primer(5µmol·L-1)、5µL DNA(加入的DNA总量为30 ng),最后加5.5µL dd H2O补足至25µL。反应参数:95℃预变性5 min;95℃变性45 s,55℃退火50 s,72℃延伸45 s,28个循环;72℃延伸10 min。测序原始序列上传至NCBI的SRA数据库。
1.6 数据分析与计算方法
在Illumina MiSeq平台进行Paired-end测序,根据barcodes归类各处理组序列信息聚类为用于物种分类的OUT(Operational Taxonomic Units),OTU相似性设置为97%。对比silva数据库,得到每个OTU对应的物种分类信息。利用qiime version v.1.8.0对数据进行抽平处理,并采用0.97的相似度进行分析得到Chao1指数、Simpson指数、Coverage指数和Shannon指数[18-20]。
Chao1指数:指示菌种丰富度,用以评估群落中的OTU数目。其公式为:
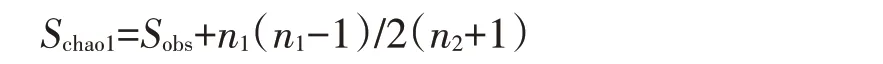
式中:Schao1为估计的OTU数;Sobs为观测到的OTU数;n1为只有一条序列的OTU数目;n2为只有两条序列的OTU数目。
Simpson指数:用来评估群落中的优势种。其公式为:

式中:Ni为某一特定物种的个体的总数;N为发现的个体总数。
Coverage指数:观测深度,用以表征各样本的覆盖率,反映了本次测序结果是否代表了样本中微生物的真实情况。其公式为:

式中:n1为只含一条序列的OTU数目;N为抽样中出现的总的序列数目。
Shannon指数:用以反映群落中物种丰富度。其公式为:
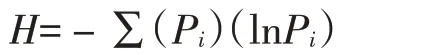
式中:Pi为样品中属于第i种的个体的比例。
经过UniFrac算法利用系统进化的信息来比较样品间物种群落差异,通过SPSS软件对细菌多样性指数和土壤酶活性进行单因素方差分析。
2 结果与分析
2.1 土壤细菌稀释性曲线
稀释性曲线(Rarefaction curve)即从样品中随机选择一定数量的个体,计算个体代表的物种数,利用个体数量和物种数构建曲线,从而比较具有不同数量测序数据的样本中物种丰富度,确定样品中测序数据的数量是否合理[21]。由图2可知,在α=0.03的水平上,随着测序数据量的增加,各处理的曲线均趋向平缓,这说明本次试验测序数据的数量是合理的。
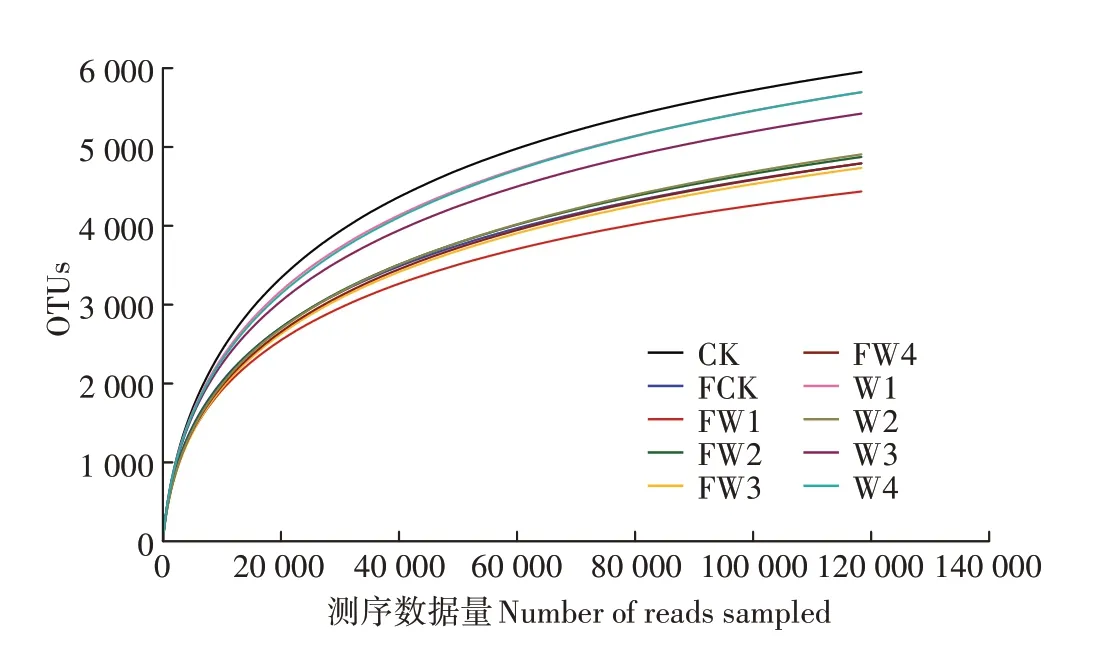
图2不同处理的稀释性曲线(α=0.03)Figure 2 Rarefaction curves of different treatments(α=0.03)
2.2 土壤细菌层次聚类分析
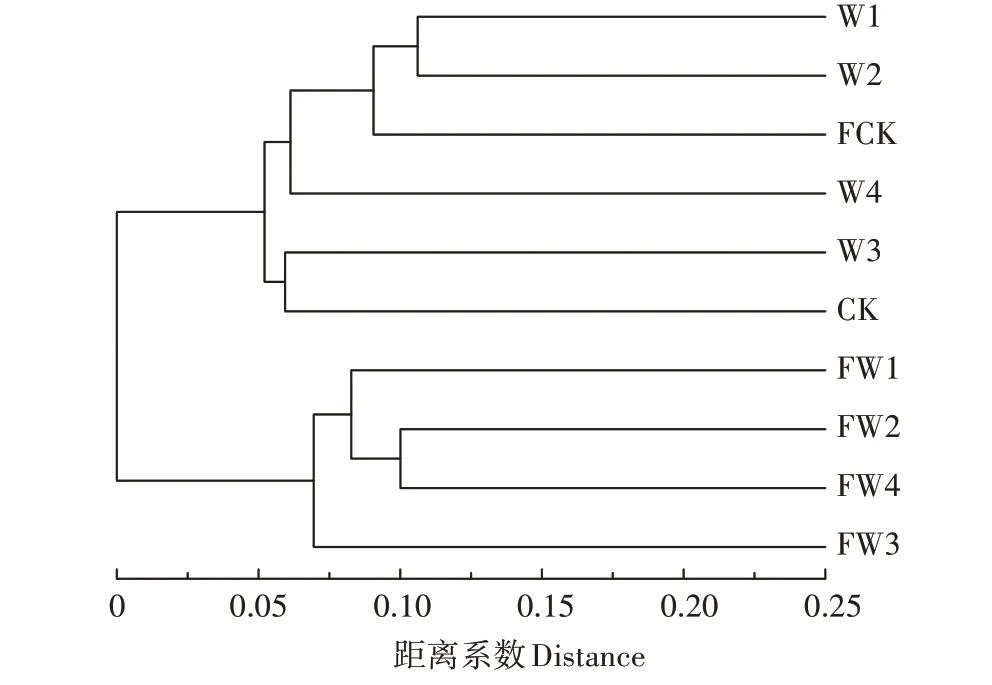
图3基于bray curtis多样本聚类树Figure 3 Multiple copy clustering tree based on bray curtis
在多样本聚类树中,树枝长度代表的是样本之间的距离,当样本相似度越高时,样本越能聚集到一起[22]。如图3所示,横坐标为各处理间的距离系数。以相似性0.8为标准时,样本分为两大类,一类是FW3、FW4、FW2、FW1,另一类是CK、W3、W4、FCK、W2、W1。在施肥条件下,与对照相比,污水灌溉使得细菌群落结构发生明显变化,其中FW2和FW4样本相似度较高;在不施肥条件下,处理梯度较低的污水灌溉与清水灌溉的土壤细菌群落结构变化较大,W1和W2处理的样本相似度高,W3和W4处理的土壤细菌群落结构与对照相差较小;在同一灌溉条件下,施肥土壤和不施肥土壤的细菌群落结构发生明显变化,其中清水灌溉下的两种土壤的细菌群落结构变化小于污水灌溉,处理梯度(3)灌溉下的两种土壤的细菌群落结构变化小于其他处理梯度的污水灌溉处理。
2.3 不同处理梯度污水对细菌群落多样性和群落组成的影响
2.3.1 不同处理梯度污水对土壤细菌多样性指数的影响
Chao1指数和Shannon指数与群落多样性呈正比,Simpson指数与群落多样性呈反比,Coverage指数越高说明样本中序列被检出的概率越高。由表2可知,在不施肥条件下,W2处理的Shannon指数(9.49)显著低于其他处理,Simpson指数(0.008 4)显著高于其他处理(P<0.05);在施肥条件下,不同污水灌溉的土壤细菌群落多样性无显著变化;同时,在相同灌溉条件下,除处理梯度(2),不施肥土壤的Chao1指数和Shannon指数均高于施肥土壤,Coverage指数略低于施肥土壤;处理梯度(1)、处理梯度(3)和处理梯度(4)的土壤中,不施肥的Simpson指数低于施肥土壤,处理梯度(2)和清水灌溉的土壤中,不施肥的Simpson指数高于施肥土壤。
2.3.2 不同处理梯度污水对土壤细菌在门水平上相对丰度的影响
在施肥和未施肥的土壤中共同检测出了12种菌门,包括变形菌门(Proteobacteria)、螺旋体菌门(Saccharibacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、放 线 菌 门(Actinobacteria)、Parcubacteria、芽单胞菌门(Gemmatimonadetes)、蓝藻门(Cyanobacteria)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes),Other为相对丰度低于1%的微生物。
由图4可知,在施肥的条件下,变形菌门(Proteobacteria)相对丰度最高,其次是绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria);与对照相比,随着污水处理强度的增加,变形菌门(Proteobacteria)相对丰度逐渐提高,在FW1处理(24.39%)下最低,低于对照土壤的29.28%;而FW1处理土壤中绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)的相对丰度(27.10%、16.35%)均高于其他处理,与对照相近;污水灌溉对放线菌门(Actinobacteria)有促进作用,FW1和FW4的促进作用较强,相对丰度增幅为95.90%和62.87%,FW2和FW3的促进效果较弱,相对丰度增幅为37.27%和20.11%;污水灌溉对厚壁菌门(Firmicutes)也具有一定的促进作用,且FW2、FW3及FW4的促进能力较强,相对增幅为146.91%、142.59%和132.10%。
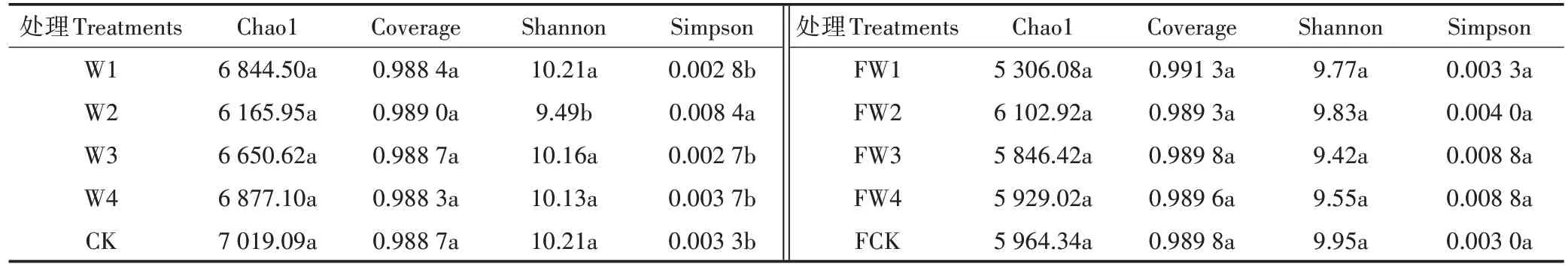
表2不同处理对土壤细菌群落多样性的影响Table 2 Effects of different treatments on soil bacterial community diversity
在未施肥条件下,污水灌溉和清水灌溉的土壤中放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)的相对丰度低于施肥条件下的土壤,提高了硝化螺旋菌门(Nitrospirae)的相对丰度;与施肥土壤相比,W1抑制了绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)的相对丰度,两种菌门相对丰度降幅为13.58%和9.30%,其他3种处理梯度出水则提高了绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)的相对丰度,与之相反的是W1对变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes)和螺旋体菌门(Saccharibacteria)的相对丰度有促进作用,其他3种处理梯度出水和清水灌溉的土壤对这3种菌门具有抑制作用;其他菌门相对丰度变化不明显。
2.3.3 不同处理梯度污水对土壤细菌在属水平上相对丰度的影响
由图5可知,在施肥土壤中,FW1中厌氧菌属(Anaerolinea)的相对丰度(2.27%)略高于其他处理;污水灌溉降低了土壤中厌氧黏细菌属(Anaeromyxobacter)的相对丰度,其中FW3对其抑制作用最强,相对丰度降低74.61%;与FCK相比,污水灌溉对Haliangium和Geobacter有抑制作用,其中FW4处理中两种菌属相对丰度的降幅为2.46%和9.06%,抑制作用最低,FW1处理中两种菌属相对丰度的降幅为56.64%和63.65%、FW3处理中的降幅为66.34%和28.43%,FW1和FW3处理对其抑制作用较强;污水灌溉提高了芽单胞菌属(Gemmatimonas)和鞘氨醇单胞菌属(Sphingomonas)的相对丰度,FW2对两者的促进作用最好,相对丰度升高100%和261.40%,FW1、FW3和FW4次之;与FCK相比,FW3显著提高了Candidatus_Nitrotoga的相对丰度,升幅为588.69%,而其他污水处理对Candidatus_Nitrotoga有抑制作用,FW1对Candidatus_Nitrotoga有显著的抑制作用,降幅为97.35%。
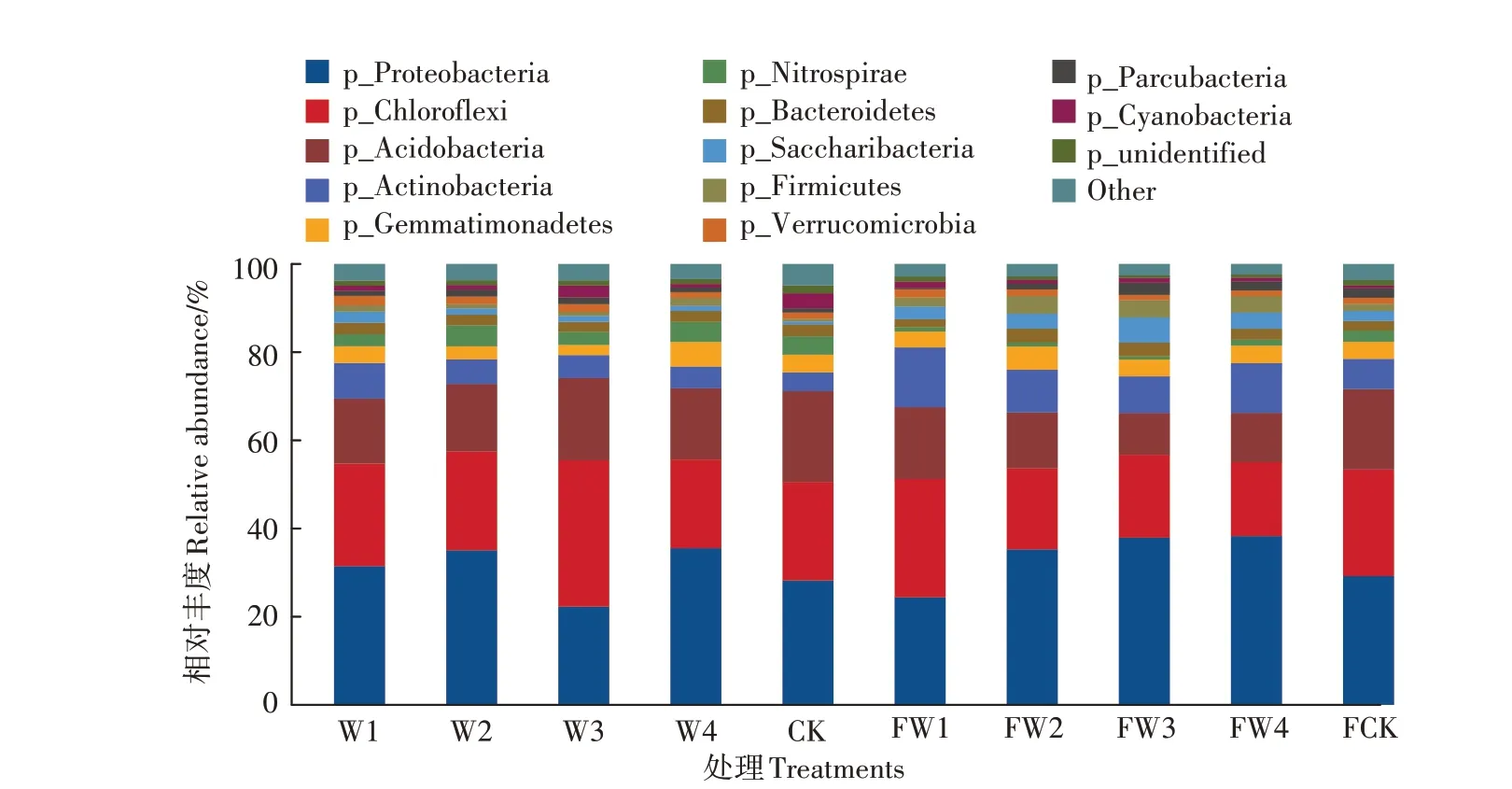
图4土壤细菌在门水平上的相对丰度Figure 4 Relative abundance of soil bacteriaat phylum level

图5土壤细菌在属水平上的相对丰度Figure 5 Relative abundance of soil bacteria at genus level
与施肥土壤相比,在未施肥土壤中污水灌溉提高了厌氧黏细菌属(Anaeromyxobacter)、Sideroxydans和Haliangium的相对丰度,分别增加了0.12%~0.92%、0.13%~1.05%、0.30%~0.95%,降低了鞘氨醇单胞菌属(Sphingomonas)的相对丰度,降低了0.28%~1.74%,但清水灌溉却对鞘氨醇单胞菌属(Sphingomonas)的相对丰度有促进作用,增加了0.81%。
2.4 不同处理梯度污水对土壤酶活性的影响
由表3得出,与施肥土壤相比,处理梯度(1)灌溉使得不施肥土壤中碱性磷酸酶活性降低;除此以外,在同一处理梯度污水灌溉下,不施肥土壤中的脲酶、蔗糖酶和碱性磷酸酶活性大于施肥土壤相应的酶活性。不施肥土壤的碱性磷酸酶活性表现为W2>W4>W1>W3>CK,与施肥土壤中的变化趋势一致,污水灌溉对土壤碱性磷酸酶活性具有促进作用,在不同施肥条件下处理梯度(2)灌溉中的碱性磷酸酶活性相对于对照分别提高了55.40%和46.67%,促进作用最强。不施肥土壤脲酶活性表现为W4>W1>W3>W2>CK,与清水灌溉相比,污水灌溉对不施肥土壤脲酶活性有促进作用,且随着污水处理强度的增加,土壤脲酶活性先降低后升高,在W2处理中脲酶活性最低,为106.49 U·g-1;施肥土壤中脲酶活性表现为FW1>FCK>FW4>FW2>FW3,FW3处 理 相 对 于FCK降 低 了25.85%,抑制了脲酶活性,其余几个处理对施肥土壤脲酶活性无显著影响。不施肥土壤的蔗糖酶活性表现为W2>W1>W3>W4>CK,施肥土壤蔗糖酶活性表现为FW3>FW1>FW2>FW4>FCK,污水灌溉土壤中蔗糖酶活性大于清水灌溉的土壤蔗糖酶活性。
3 讨论
本研究表明,在施肥水平下,不同处理梯度的污水灌溉对土壤细菌群落多样性影响均不显著,与Ibekwe等[23]研究结果类似。但现在多数研究[5,24]认为污水灌溉可提高土壤微生物多样性,这可能有以下几个原因:一是由于本次研究仅有一次茭白-水稻轮作的生长周期(8个月左右),与Bastida等[5]、Dang等[24]研究中的3年到30年灌溉周期相比,本次试验灌溉周期较短;二可能是土壤质量、灌溉方式等问题。在不施肥土壤中,W2降低了土壤中的细菌多样性,其他3种污水在一定程度上表现出抑制作用,但与清水灌溉并无显著差异,这可能是因为在不施肥的土壤中,植物更多地从污水和土壤中吸收营养物质,而W2中的植物生长更旺盛,所需的营养物质也就更多,从而导致土壤肥力下降,而研究证明微生物丰富度及多样性指数与土壤综合肥力指数具有幂函数关系,当微生物多样性提高时,土壤综合肥力指数也随着提高,而土壤综合肥力指数主要用以指示土壤肥力质量,土壤微生物多样性包含细菌群落多样性在内,因此土壤细菌多样性增加有利于提高土壤肥力[4,25],所以使得W2灌溉土壤中细菌多样性降低。但研究发现在同一灌溉条件下,降低肥料的使用会刺激微生物对碳、氮的反应[26],因此可以增加细菌群落多样性,这与郭魏[10]的结论相似。
土壤微生物的群落结构变化是在水质和施肥互作下的群体性反应,这种变化由优势种群的变化及某一部分非优势种群的有无来表现[27]。本次研究中发现,施肥的土壤中污水灌溉的土壤细菌群落结构与清水灌溉相比发生了改变,土壤细菌在门水平上相对丰度变化较大,但在属水平上优势种(unidentified)未发生明显改变。这表明相对于清水灌溉,污水灌溉促进了土壤中变形菌门(Proteobacteria)的相对丰度,且随着污水处理梯度的减弱、污水浓度的增加,土壤中污水浓度与变形菌门(Proteobacteria)的相对丰度呈负相关(FW3处理除外);污水灌溉降低了土壤中酸杆菌门(Acidobacteria)的相对丰度,提高了放线菌门(Actinobacteria)相对丰度,其中施肥土壤中的酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)相对丰度随处理梯度的增加呈现先下降后上升的趋势,不施肥土壤中酸杆菌门(Acidobacteria)随着污水浓度的增加相对丰度先增加后减少的趋势,不施肥土壤中污水浓度与放线菌门(Actinobacteria)的相对丰度具有正相关性。变形菌门(Proteobacteria)中的固氮菌可固定土壤中的氮元素,这说明当污水处理梯度增加、污水浓度变低时,污水灌溉通过提高有益菌属的相对丰度,促进土壤中氮元素转化的有关过程,但高浓度污水对其提高率较低,可能是因为污水中的微生物随灌溉进入土壤,对土壤微生物产生了抑制作用;放线菌门(Actinobacteria)可以参与土壤中有机物的分解和氮循环[28-29],这说明污水灌溉可以促进放线菌门(Actinobacteria)生长繁殖,从而促进了土壤有机物的分解,提高了土壤养分水平,其中生活污水原水灌溉更有利于放线菌门(Actinobacteria)生长。酸杆菌门(Acidobacteria)可以降解植物残体、参与单碳化合物降解,为土壤提供养分[30],污水灌溉通过抑制酸杆菌门(Acidobacteria)的活性在一定程度上抑制了土壤中的碳循环过程,其中在施肥土壤中处理梯度(3)、在不施肥土壤中处理梯度(1)对其抑制作用较强。

表3不同污水浓度灌溉对土壤酶活性的影响Table 3 Effects of irrigation with different sewage concentrations on soil enzyme activity
土壤脲酶可以催化尿素,提高土壤供氮能力;土壤蔗糖酶使蔗糖加速分解,增加土壤中易溶性物质[8];土壤磷酸酶促进了有机磷的脱磷过程,促进磷元素的有效性[18],土壤微生物通过分泌酶的形式参与到土壤各种反应过程中。脲酶、蔗糖酶和磷酸酶与土壤中碳、氮、磷循环具有密切联系,其变化反映了土壤养分的动态变化情况[31],因此土壤酶可以反应微生物在土壤各项生化反应中的强度及方向[32]。潘能等[33]研究发现,农田土壤经再生水灌溉后,土壤蔗糖酶、碱性磷酸酶和脲酶活性均有一定程度的提高;韩洋等[34]研究发现再生水对土壤蔗糖酶活性有促进作用,García-Orenes等[35]研究发现污水灌溉提高了土壤脲酶和碱性磷酸酶活性。本研究表明,在施肥水平下,污水灌溉均促进了土壤碱性磷酸酶和蔗糖酶的活性,在完全不施肥水平下,污水灌溉对3种酶活性均有不同程度的促进作用。原因是相较于清水,污水中含有更多的氮、磷营养元素和更多种类的微生物,这些物质随灌溉进入到土壤中,提高了土壤微生物群落多样性,从而使得碱性磷酸酶活性和蔗糖酶活性增加。但处理梯度(3)显著降低了施肥土壤中脲酶活性,其他污水处理对脲酶活性无显著影响,且处理梯度(3)使得施肥土壤中与氮有关的变形菌门(Proteobacteria)的相对丰度显著降低,这可能是因为处理梯度(3)中Candidatus Nitrotoga的相对丰度高于其他污水处理5.88%~269.41%,Candidatus Nitrotoga属于亚硝酸盐氧化细菌,亚硝酸盐氧化细菌主要作用是将亚硝态氮氧化为硝态氮[36],而郭魏等[10]研究发现硝态氮含量与土壤脲酶活性呈显著负相关,因此导致其脲酶活性和变形菌门(Proteobacteria)的相对丰度降低,其他处理中的微生物相对丰度相差较小,导致其他污水处理对脲酶活性无显著影响。同时在同一灌溉条件下,不施肥土壤中3种酶活性大于施肥土壤中酶活性,对比施肥处理,减少常规肥刺激了微生物对氮磷的反应,提高了3种酶活性,这与以往研究结果[16]相似。
4 结论
(1)在施肥条件下,不同处理梯度下的污水灌溉对土壤细菌群落多样性无显著影响;完全不施肥条件下,处理梯度(2)降低了土壤中的细菌群落多样性;在同一灌溉条件下,降低肥料的使用可以增加细菌群落多样性。
(2)污水灌溉对细菌门水平上的优势种影响较大,对细菌属水平上的优势种影响较小。随着污水处理梯度的提高,变形菌门(Proteobacteria)活性提高,有利于土壤氮元素的转化;污水灌溉在不同施肥水平上促进了土壤中放线菌门(Actinobacteria)的生长繁殖,处理梯度(1)对其促进作用最强,更有利于植物结瘤固氮、提高土壤肥力;污水灌溉中酸杆菌门(Acidobacteria)的活性显著低于清水灌溉,对土壤物质循环造成一定影响。
(3)随着污水处理梯度的加强,碱性磷酸酶活性呈现出先增加后减少再增加的趋势,蔗糖酶显现出先增加后减少的趋势,且均高于对照,其中处理梯度(2)综合效果更优;土壤脲酶活性表现为先降低后增加的趋势,除施肥条件下处理梯度(3)外,其他处理对施肥土壤脲酶活性影响不显著;在同一灌溉条件下,不施肥土壤中3种酶活性大于施肥土壤中酶活性[处理梯度(1)碱性磷酸酶活性相当]。
(4)综合考虑,在不施肥水平下使用生活污水原水灌溉、在施肥水平下施用厌氧处理出水灌溉对土壤细菌群落结构变化、提高酶活性更有利。
