纳米二氧化钛亚急性经口暴露对大鼠氧化/抗氧化生物标志和炎性因子的影响
2020-10-09陈章健胡贵平阎腾龙龙昌茂冯慧敏
周 迪,陈章健,胡贵平,阎腾龙,龙昌茂,冯慧敏,贾 光
(北京大学公共卫生学院劳动卫生与环境卫生学系, 北京 100191)
二氧化钛(titanium dioxide, TiO2),俗称“钛白粉”,在食品工业中常作为着色剂用于口香糖、糖果、甜点、沙拉酱等食品[1-2],其中,纳米TiO2(三维尺度中至少有一维的直径<100 nm)由于具有更加出色的遮盖能力,在食品添加领域应用前景广阔[3-4]。儿童因喜甜食是纳米TiO2的高暴露人群,根据Rompelberg等[5]的研究,儿童(≤6岁)纳米TiO2的暴露量约为成人的4倍,儿童每日纳米TiO2的97.5%分位数暴露量(有97.5%的儿童每日暴露量低于此值)约为4.16 μg/kg(95%CI:3.84~4.52 μg/kg)。
与常规尺寸相比,纳米TiO2具有独特的理化特性(如小尺寸效应、更大的比表面积、量子限域效应等),生物吸收、分布特点和安全效应也随之改变[6-7]。近年的体外试验研究显示,纳米TiO2暴露可导致细胞内活性氧自由基升高、氧化还原状态失衡,最终引发炎性反应及线粒体介导的细胞凋亡[8-10]。体内研究显示,纳米TiO2经口暴露后,约有0.06%经消化道吸收,其余以原型经消化道直接排出,吸收入血的纳米TiO2可快速分布于肝、脾,并在其中蓄积,肝脏中纳米TiO2的90天清除率约为20%~26%[11]。然而,目前有关纳米TiO2经口暴露后对体内多组织、脏器氧化/抗氧化标志及炎性因子影响的系统研究依然十分有限。
小肠和大肠是纳米TiO2经口暴露时的直接接触器官,血液、组织是纳米二氧化钛吸收后分布、转运的主要媒介,肝脏是纳米二氧化钛经口暴露后的主要蓄积器官。为了更加系统和全面地评估纳米TiO2经口暴露后对各组织、脏器的氧化/抗氧化标志物及炎性因子的影响,本研究对大鼠进行灌胃染毒,检测血清、肝、小肠和大肠中的氧化/抗氧化标志和炎性因子变化,分析比较各组织、脏器的改变模式差异,以期为深入、系统地预测、评估纳米TiO2经口暴露对不同组织、脏器的损伤效应提供依据。
1 材料与方法
1.1 药物、试剂及仪器
纳米级TiO2[锐钛矿型,(25±5) nm]购于上海麦克林试剂有限公司,微量总巯基(total mercapto, T-SH)检测试剂盒购于南京建成生物工程研究所,丙二醛检测试剂盒(malomdialdehvde, MDA, TBA法)、总超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、还原型谷胱甘肽(glutathione, GSH, DTNB速率法)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒购于北京雷根生物技术有限公司,氧化型谷胱甘肽(glutathione disulfide, GSSG)试剂盒购于北京索莱宝生物技术有限公司,二喹啉甲酸法(bicinchoninic acid assay, BCA法)蛋白定量试剂盒购于北京普利莱基因技术有限公司,白细胞介素-6(interleukin 6, IL-6)、肿瘤坏死因子受体-α(tumor necrosis factor alpha, TNF-α)、酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)试剂盒购于英国Abcam公司。
1.2 纳米TiO2颗粒的理化表征
应用场发射透射电子显微镜(transmission electron microscope, TEM,Tecnai F30,美国FEI公司)对纳米TiO2的形貌和粒径进行观察,应用Image J软件(Version 1.8.0_112,美国国立卫生研究院)统计TEM图像中200个纳米TiO2颗粒的平均费雷特粒径(Feret diameter),应用场发射扫描电子显微镜配套的X射线能谱分析仪(energy dispersive X-ray spectroscopy, EDS, Nova_NanoSEM430,美国FEI公司)定量测定纳米TiO2中元素组成及含量。应用X射线衍射物相结构分析仪(X-ray powder diffractometer, XRD, X-Pert3 Powder, 荷兰PANalytical公司)测定纳米TiO2的晶型及含量,测定结果采用match(Version 3.6.2.121,美国路易斯安纳Ochsner健康系统)软件进行晶型鉴定及定量分析。
1.3 动物及分组
清洁级雄性Sprague Dawley(SD)大鼠24只(4周龄), 体质量63~81 g,由北京大学医学部实验动物科学部提供[实验动物生产许可证:SCXK(京)2016-001,实验动物使用许可证:SYXK(京)2016-0041],适应性喂养一周后,按照体质量将大鼠随机分为4组,每组6只,分笼饲养于清洁级动物房内(室温22~24 ℃,湿度60%~70%,光照12/12 h明暗交替)。在第7、14、21、28和29(处死前)天记录大鼠体质量,在每周第1、4天称取每笼进食量,并依据间隔天数计算相邻两次称量期间每只大鼠的日平均进食量。
为了让使用的染毒剂量能反映绝大多数儿童纳米TiO2的暴露情况,本研究选取荷兰膳食调查中每日纳米TiO2摄入P95:4.52 μg/kg体质量与西欧国家平均纳米TiO2暴露差异倍数4.5相乘得到每天20.34 μg/kg体质量,最终选取20 μg/kg体质量作为97.5%儿童纳米TiO2暴露的估计值[5,12],以100为安全系数,以5为组距,得低、中、高剂量组染毒浓度分别为2、10、50 mg/kg体质量。
对照组大鼠每日用1 mL超纯水灌胃,低、中、高剂量组用超纯水分别稀释含纳米TiO2浓度为0.4 g/L、2.0 g/L和10.0 g/L的母液,依据每只大鼠体质量,在每次染毒前分别配置1 mL相应剂量的染毒液。每日灌胃前将染毒液超声分散30 min,涡旋混匀30 s。灌胃染毒持续28 d,经过12 h禁食不断水后,以10%(体积分数)水合氯醛(0.4 mL/100 g体质量)麻醉,腹主动脉取血后断髓法处死大鼠,摘取脏器称重并保存。
1.4 ELISA及微板法检测氧化损伤及炎性指标
促凝血在4 ℃下3 000 r/min离心10 min后取血清。肝、大肠及小肠称重后取0.10 g组织加入1.0 mL 生理盐水进行匀浆,严格按照说明书操作规程对相应氧化/抗氧化指标、炎性因子进行测定。采用扫描式多功能读数仪(VARIOSKAN FLASH,美国Thermo公司)读取氧化/抗氧化因子和炎性因子的检测结果,采用Sigma 3-30K低温高速离心机(德国Sigma公司)进行离心。各指标采用BCA蛋白对结果校正后进行统计分析,除GSH/GSSG是两个指标物质的量比无量纲外,其余指标均为组织、脏器中每1 mg BCA蛋白对应的量。
1.5 统计学分析
采用Excel 2016、R 3.5.1及SPSS 24.0整理数据并进行统计分析。正态分布资料采用均值±标准差表示,非正态分布资料采用中位数±四分位数间距表示。Shapiro-Wilk检验满足正态分布的数据采用单因素方差分析法检测整体差异,且Levene检验组间方差齐的数据用Dunnett 法对组间差异进行两两比较,方差不齐时采用Dunnett’s T3法进行组间两两比较,正态分布不满足的数据采用Kruskal-Wallis法(使用bonferroni法校正多重比较P值)进行非参数差异检验和后续的组间两两比较,所有检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 纳米TiO2的理化表征
本研究应用透射电镜观察纳米TiO2颗粒的形貌和粒径分布(图1A),TiO2颗粒多呈球型,表面光滑,平均粒径(Feret diameter)为(25.12±5.64) nm(图1B)。EDS结果见图1C,由图谱定量分析可见,颗粒物中钛元素质量占比约为66.98%±0.51%,氧元素质量占比约为33.02%±0.61%,纳米TiO2的纯度超过99.99%。XRD结果显示(图1D),纳米TiO2晶型主要为锐钛矿(anatase),含量为100.0%,上述理化特征与产品标签内容一致。
2.2 纳米TiO2对体质量、进食及脏器系数的影响
高、中、低剂量组大鼠体质量变化见图2,日均进食量变化见图3,脏器系数见表1,与对照组相比,低、中、高剂量组大鼠体质量、进食量和脏器系数差异均无统计学意义(P>0.05)。
2.3 纳米TiO2对氧化/抗氧化生物标志的影响
连续经口灌胃染毒28 d后,各组大鼠血清、肝、小肠和大肠的氧化/抗氧化生物标志见表2。
2.3.1氧化还原相关酶 与对照组相比,高剂量组血清中SOD活力显著上升(P=0.009),肝、小肠和大肠的SOD活力差异均无统计学意义(P>0.05)。与对照组相比,高、中、低剂量组血清、肝、大肠和小肠中的GSH-Px活力的差异均无统计学意义(P>0.05)。
2.3.2抗氧化指标 与对照组相比,高、中、低剂量组血清、肝、大肠和小肠中的GSH浓度、T-SH浓度以及GSH和GSSG的摩尔浓度比值(GSH/GSSG)在血清、肝、小肠、大肠中的差异均无统计学意义(P>0.05)。
2.3.3氧化指标 与对照组相比,中剂量组小肠中GSSG浓度显著上升,差异有统计学意义(P=0.022),高剂量组小肠中GSSG浓度显著上升,差异有统计学意义(P=0.031);高、中、低剂量组GSSG浓度在血清、肝和大肠中的差异无统计学意义。与对照组相比,低剂量组肝MDA浓度显著升高,差异有统计学意义(P=0.042),中剂量组肝MDA浓度有升高趋势(升高9%),但差异无统计学意义(P>0.05),高剂量组肝MDA浓度显著升高,差异有统计学意义(P=0.011);血清、小肠和大肠中MDA浓度差异均无统计学意义(P>0.05)。
2.4 纳米TiO2对炎性因子影响
炎性因子改变见表3,与对照组相比,低、中、高剂量组血清、肝、小肠、大肠中IL-6浓度差异均无统计学意义(P>0.05),低剂量组肝中TNF-α浓度有增高趋势,但差异无统计学意义(P>0.05),中剂量组肝中TNF-α显著增高,差异有统计学意义(P=0.001),高剂量组TNF-α显著升高,差异有统计学意义(P=0.005),不同剂量组间TNF-α浓度差异无统计学意义(P>0.05)。
3 讨论

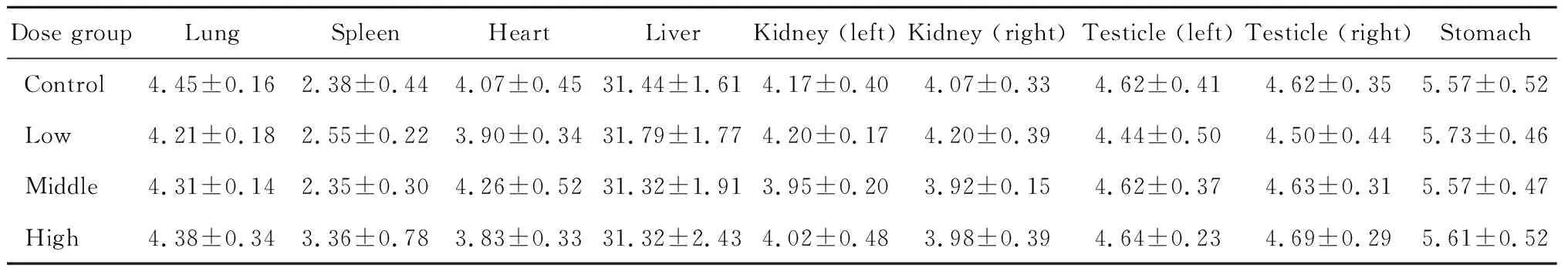
表1 不同剂量组脏器系数Table 1 Organ weights coefficients of rats in different dose groups mg/g
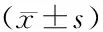
表2 纳米TiO2染毒后对多组织氧化/抗氧化生物标志的影响Table 2 Effects of TiO2 nanoparticles on oxidation/antioxidation biomarkers in multiple tissues
SOD和GSH-Px是机体清除过氧化物、保护其他氧化还原敏感位点、减少氧化损伤的重要抗氧化酶。SOD是机体唯一可以特异性催化清除超氧化物(O22-)转化为氧气和过氧化氢的抗氧化酶[16],与对照组相比,本研究中观察到高剂量组血液组织中SOD活性升高,与Huang等[17]观察到的纳米TiO2经口急性染毒(10 mg/L, 4 d)后,导致幼年牙鲆鱼(Paralichthysolivaceus, 俗称比目鱼)SOD活力上升一致,提示纳米TiO2暴露后出现了自由基增加。GSH-Px可以催化由谷氨酸、半胱氨酸及甘氨酸构成的还原性三肽GSH,将GSH氧化为GSSG的同时还原机体中的H2O2、脂过氧化物等。本研究中各剂量组在各组织、脏器中的GSH浓度、GSH-Px、GSH/GSSG与对照组相比差异均无统计学意义,中、高剂量组可见小肠中GSSG含量显著增高,但是GSH/GSSG相比对照组未见显著差异,提示纳米TiO2暴露可以造成更多GSH被氧化,但是GSH与GSSG的比例依然处在机体代偿范围之内[18]。T-SH是蛋白质参与氧化还原时最易被氧化的敏感位点,主要包含GSH所含-SH和其余各类蛋白质所含-SH两部分,后者对于蛋白维持构象、发挥生物活性具有重要意义,含-SH的分子改变可能导致炎性反应激活[14-15],炎性因子升高。本研究中各组T-SH、GSH浓度在各脏器中均未见显著差异,提示各剂量组中,纳米TiO2对GSH以外的含-SH的生物分子的氧化作用与对照组相比无明显差异。
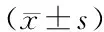
表3 纳米TiO2暴露对多组织炎性因子的影响Table 3 Effects of TiO2 nanoparticles on inflammatory cytokine in multiple tissues
MDA是活性氧自由基攻击生物膜中多不饱和脂肪酸分子形成的脂质过氧化物,可以反映机体生物膜结构受氧化损伤的程度,本研究中低剂量组和高剂量组肝MDA浓度与对照组相比显著上升,提示纳米TiO2染毒后可能诱导低剂量组和高剂量组的肝脏出现了脂质过氧化。本研究中观察到氧化产物及炎性因子浓度显著增加,与Hu等[19]报道的纳米TiO2灌胃(64、320 mg/kg体质量, 14周)导致小鼠肝MDA等氧化产物及炎性因子TNF-α显著增加一致,与Cui等[13]用5、10、50 mg/kg 纳米TiO2灌胃染毒小鼠60 d,观察到5 mg/kg组MDA浓度和SOD mRNA表达量未出现显著改变,10 mg/kg和50 mg/kg组小鼠MDA和SOD mRNA表达量出现显著改变的结果一致。
本研究中未观察到抗氧化物质的显著下降,仅观察到氧化产物GSSG和MDA增加,抗氧化酶SOD活性上升,与Shukla等[20]用10、50、100 mg/kg纳米TiO2经口染毒小鼠14 d的研究发现一致,该研究结果显示,与对照组相比,10 mg/kg染毒组的ROS含量、GSH含量及MDA含量均未出现显著差异,50 mg/kg染毒组的GSH含量依然未出现显著改变,100 mg/kg染毒组的GSH含量显著下降,50、100 mg/kg组MDA含量均显著升高,提示MDA可能比GSH对TiO2经口暴露所致氧化/抗氧化改变更加敏感,较高浓度纳米TiO2染毒后可观察到GSH浓度显著改变。本研究中观察到的GSSG含量增加,但GSH含量与GSH/GSSG在2~50 mg/kg保持不变与Shukla等[20]观察到的纳米TiO2剂量10~50 mg/kg灌胃染毒时GSH浓度不变、100 mg/kg染毒时GSH浓度改变的结果相一致,此现象可能与Gornati等[21]观察到的纳米TiO2暴露后引起的SOD、GSH的转录、翻译代偿性升高机制有关,增加的SOD及GSH可将纳米TiO2经口暴露产生的活性氧自由基还原,保障GSH与GSSG的氧化/抗氧化平衡,从而保护其他生物分子。
TNF-α和IL-6均为具有促炎作用的细胞炎性因子,TNF-α主要由巨噬细胞产生,可促进血中C反应蛋白、血清淀粉样蛋白A等急性时相反应蛋白的产生,引发炎性反应。与对照组相比,中剂量组和高剂量组均观察到肝TNF-α浓度显著升高,提示中剂量组和高剂量组出现了炎性反应,与Chen等[22]前期研究报道的纳米TiO2经口暴露(0~50 mg/kg体质量,30 d)导致SD大鼠TNF-α升高一致。本研究仅观察到各剂量组IL-6浓度有上升趋势,但差异并无统计学意义,可能与本研究中测定的IL-6个体波动水平较大,得到结果的标准差较大有关。
对不同剂量组大鼠肝、血液组织、小肠和大肠的氧化/抗氧化生物标志物和炎性因子改变进行分析结果显示,不同剂量纳米TiO2暴露均未造成各组织的还原性物质含量发生显著改变,纳米TiO2染毒后可观察到抗氧化酶SOD活性显著升高、氧化产物GSSG和MDA的含量显著升高、促炎因子TNF-α含量显著升高。各剂量组出现显著改变指标的个数由高到低依次为:高剂量组>中剂量组>低剂量组,出现显著改变的指标个数呈现出随剂量增高而增加的趋势,且与对照组相比,低剂量组仅观察到氧化产物显著改变,中剂量组观察到氧化产物和炎性因子的改变,高剂量组同时观察到氧化产物、炎性因子和氧化还原酶活性的改变,提示纳米TiO2经口暴露后,对大鼠氧化/抗氧化生物标志以及炎性因子的影响有随剂量增加而增强的趋势。
对不同脏器出现显著改变的指标进行分析比较结果显示,纳米TiO2染毒后,对血液组织、肝、小肠、大肠造成的影响不同,与对照组相比,大肠中各剂量组指标改变均无统计学意义,血液组织中可见高剂量组SOD活性升高,小肠中可见低、高剂量组氧化产物GSSG增加,肝中可观察到低、高剂量组氧化产物GSSG和MDA增加,中、高剂量组炎性因子TNF-α增加。各个组织、脏器发现的差异有统计学意义的改变指标数由高到低依次为:肝>小肠>血液组织>大肠,且在血液组织中仅观察到抗氧化酶SOD活性的变化,在小肠中观察到氧化产物GSSG显著上升,在肝中同时观察到炎性因子和氧化指标出现显著改变,提示亚急性经口暴露下,主要蓄积器官肝对纳米TiO2诱导的氧化/抗氧化生物标志和炎性因子变化最为敏感,其次是小肠和血液组织,大肠最不敏感。此结果与Sycheva等[23]用纳米TiO2经口灌胃染毒小鼠后发现的肝组织出现显著氧化型损伤而大肠组织中未出现显著性氧化损伤一致。上述结果提示,在接下来的研究中应重点关注纳米TiO2对肝等主要蓄积器官的毒作用。
综上所述,纳米TiO2亚急性经口暴露后可导致大鼠肝、小肠和血液组织的氧化/抗氧化生物标志出现显著改变,可诱导肝脏炎性因子升高,其中,肝对纳米TiO2诱导的氧化/抗氧化生物标志改变最为敏感,随后依次为小肠和血液组织,大肠最不敏感。氧化/抗氧化生物标志及炎性因子的改变,是多种疾病的早期标志,对于预测、评估纳米TiO2经口暴露的潜在毒效应具有一定的提示作用,然而,对暴露后各组织、脏器具体的损伤情况仍有待通过组织病理学检查等方法进行进一步的验证。
(志谢:感谢北京大学公共卫生学院劳动卫生与环境卫生学系的赵琳、刘佳兴、张永亮,北京大学医学部实验动物科学部以及北京大学分析测试中心的各位老师在本实验中给予的帮助与指导。)
