药物去势联合放疗对前列腺癌患者的效果评估
2020-09-27王兴姜真戎文文
王兴,姜真,戎文文
(禹城市人民医院 放疗科,山东 德州 251200)
前列腺癌发病率排70 岁以上中国男性泌尿生殖系肿瘤的第1 位[1-2]。在欧美男性肿瘤病死率中,前列腺癌仅次于肺癌和结直肠癌[3-4]。前列腺癌早期症状不典型,多数患者确诊时已失去手术机会,根治性放疗被认为是治疗局限期前列腺癌的标准方法,目前以其为基础的综合治疗在降低前列腺癌复发率,提高患者生存质量等方面发挥着重要作用[5-6]。本文针对高龄中晚期前列腺癌患者在放疗前提下应用药物去势治疗进行讨论,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年1月—2016年1月禹城市人民医院收治且年龄>70岁的前列腺癌患者89例。年龄72~93岁, 平均(73.3±8.6)岁。随机分为:药物去势联合根治性放疗治疗组(观察组44例)和单纯根治性放疗治疗组(对照组45例)。通过前列腺彩超、穿刺活检,病理诊断为前列腺腺癌,前列腺癌病理分级使用中国泌尿外科诊疗指南推荐的Gleason 评分系统[7],本研究中所有病例Gleason 评分>7 分。所有患者自愿参加本研究,患者及家属知情并签署同意书。本研究已获得医院医学伦理委员会批准(批准书编号:2018056)。两组患者年龄、卡诺夫斯凯计分(KPS)等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准
纳入标准:①所有患者明确诊断前列腺腺癌,符合《中国常见恶性肿瘤诊治规范》诊断标准[7];②年龄> 70 岁,不符合手术条件或不愿行手术治疗者;③无 骨髓及血液系统疾病患者;④KPS>70 分,预计存活期> 12 个月。排除标准:①有远处转移者,包括骨转移及肺转移等;②合并其他恶性肿瘤或血液功能障碍者;③配合度较差,精神异常不能顺利配合治疗者。
1.3 仪器与试剂
全自动电化学发光免疫分析仪(德国罗氏公司),贝克曼LH750 全自动血液分析仪(美国贝克曼公司),酶联免疫吸附试验(ELISA)试剂盒由上海生工生物工程股份有限公司提供。
1.4 治疗方案
两组患者采用图像引导的放射治疗(image guide radiation therapy, IGRT),体模固定后做CT 扫描模拟,在CT 模拟机下确定患者的位置,射野中心,皮肤参考点标记、照射,照射范围包括全盆腔,前列腺局部、盆腔淋巴结及肿瘤转移部位,具体方法参考文献[8-9]。 中位放疗总剂量为74 Gy,每天照射四野。全盆腔:2 Gy/次,5 次/周,共25 次,5 周完成。然后,缩野至前列腺局部补量24 Gy,每日计划靶区(planning target volume, PTV)剂量1.8 ~2.0 Gy/次,5 次/周,2 ~3 周 完成。当治疗过程中出现与放疗相关的≥Ⅲ度不良反应时,可暂停治疗。治疗过程中,针对患者出现的症状予以止吐、胃黏膜保护剂或重组粒细胞集落刺激因子等药物,放疗结束后,定期复检。
药物去势治疗方案:醋酸戈舍瑞林缓释植入剂(商品名:诺雷得,英国阿斯利康制药有限公司,进口药品注册证号H20040447),在腹前壁皮下注射,3.6 mg/次,每28 天1 次,必要时可使用局部麻醉,对肝、肾功能不全者及老年患者不需调整剂量。开始治疗应同时应用抗雄激素药物:比卡鲁胺片(商品名:康士得,英国阿斯利康制药有限公司),50 mg/片,28片/盒,餐后半小时口服150 mg,1 次/d,疗程为2 ~4周,定期复查血常规、肝功能,当治疗过程中出现肝功能异常(转氨酶升高,胆汁淤积和黄疸)可终止治疗。治疗期间定期复查前列腺特异性抗原(prostate specific antigen, PSA),当下降至<0.2 ng/ml 并且持续3 ~6 个月可停药,停药后前半年,每月检测1 次血清总前列腺特异抗原(TPSA)、游离前列腺特异抗原(FPSA),半年后每2 个月检测1 次,2年后每月检测1 次,如果出现PSA 值超过正常范围或影像学检查发现局部病灶加重,出现新的转移灶或原转移灶较前加重时恢复用药[10]。
1.5 评价标准
前列腺癌病理分级使用中国泌尿外科诊疗指南推荐的Gleason 评分系统。G1:分化良好(轻度异性,Gleason 2 ~4),G2:分化中等(中度异性,Gleason 5 ~ 6),G3 ~4:分化差或未分化(重度异性,Gleason 7 ~10)[11]。正常男性血清睾酮:14.0 ~25.4nmol/L,去势治疗后血清睾酮维持在治疗前水平的5%~10%。肿瘤标志物指标:采用化学发光微粒子免疫分析技术检测,标准参考范围TPSA:0 ~4ng/ml 及FPSA:0 ~0.934ng/ml。前列腺癌生化复发特指发生在前列腺癌根治术后或放射治疗后肿瘤继续进展并发生临床复发或转移的前兆,PSA 的监测是生化复发的重要指标[12]。按照RECIST 1.0 标准确定疾病是否进展,统计中位生存期以疾病进展(PD)、疾病稳定(SD)、部分缓解(PR)、完全缓解(CR)评定疗效[13]。
1.6 随访
研究人员通过详细查阅病历,并电话随访患者及患者家属,获得患者临床资料及病理特征,随访截止日期为2017年12月31 日。所有患者定期复查CT及肿瘤标志物,根据RECIST 标准对患者进行疗效评价。总生存时间(overall survival, OS)为从开始治疗到发生死亡事件或者随访截止日期。疾病无进展生存时间(progression-free survival, PFS)为从本次治疗开始到发生复发或肿瘤转移。通过电话或住院随访对所有89例患者进行随诊,中位随访时间是28.6 个月(12.0 ~48.0 个月)。
1.7 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以例(%)表示,比较采用χ2检验;Kaplan-Meier 法绘制生存曲线,比较用Log rank χ2检验,影响因素分析用单因素和多因素Cox 风险比例模型,P< 0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料
两组患者的年龄、Gleason评分、TPSA、FPSA比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组的临床疗效
两组随访结束时,有19例(21.3%)患者出现死亡事件。70例患者随访到PFS,观察组客观缓解率、疾病控制率与对照组比较,差异有统计学意义(P< 0.05)。见表2。
采集89例患者中位疾病无进展生存时间(mPFS)和OS。观察组mPFS 是(36.5±3.7)个月,对照组mPFS 为(19.8±2.4)个月,组间比较,差异有统计学意义(t=2.326,P=0.001)。采用Kaplan-Meier 法绘制生存曲线(见图1)。观察组OS 为(39.8±3.8)个月,对照组OS 为(25.4±2.7)个月,组间比较,差异有统计学意义(t=4.569,P=0.017)。采用Kaplan-Meier法绘制生存曲线(见图2)。
利用Cox 回归模型对入组患者的PFS、OS 进行单因素及多因素分析。前列腺癌患者KPS 70 ~80 分、淋巴结转移阳性患者、Gleason 评分G8 ~10 及单纯放疗是PFS 的影响因素(见表3、4)。KPS 评分<90 分、淋巴结转移阳性患者、Gleason 评分G8 ~10 是前列腺癌患者OS 的影响因素(见表5、6)。
2.3 不良反应
乳腺增生发生率为47.6%(20/42),仅1例出现较明显的乳房胀痛、女性化表现。脂代谢异常率以甘油三酯升高较明显为40.5%(17/42)。而根治性放疗后,尿失禁率为7.1%(5/70),白细胞减少发生率为30.0%(21/70),且均为1 ~2 度。
表1 两组患者治疗前的一般情况比较 (±s)
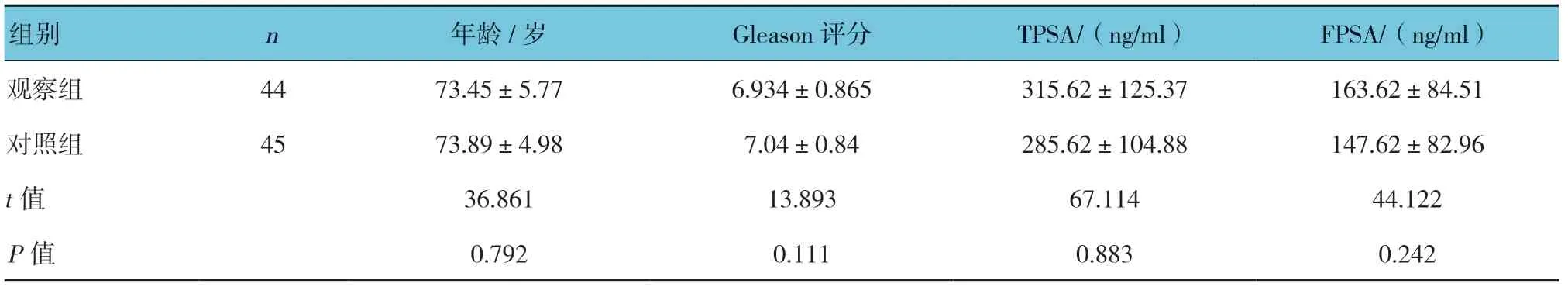
表1 两组患者治疗前的一般情况比较 (±s)
组别 n 年龄/岁 Gleason 评分 TPSA/(ng/ml) FPSA/(ng/ml)观察组 44 73.45±5.77 6.934±0.865 315.62±125.37 163.62±84.51对照组 45 73.89±4.98 7.04±0.84 285.62±104.88 147.62±82.96 t 值 36.861 13.893 67.114 44.122 P 值 0.792 0.111 0.883 0.242
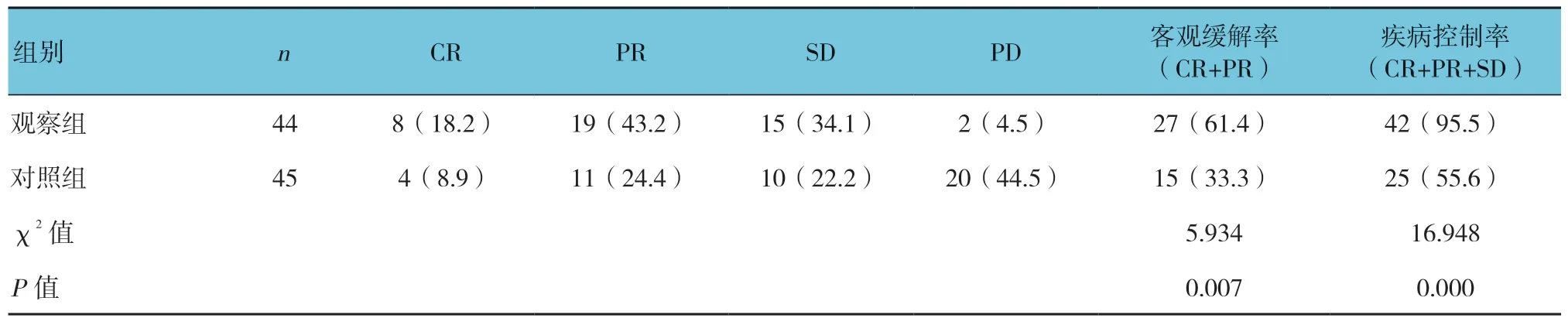
表2 两组临床疗效评估 例(%)
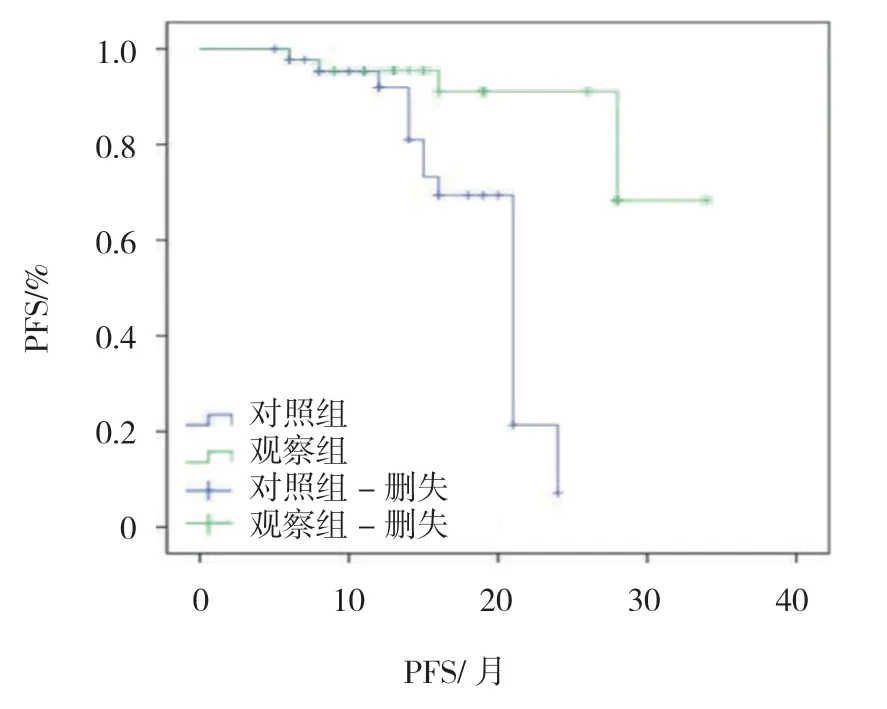
图1 药物去势治疗联合根治性放疗对PFS 的影响
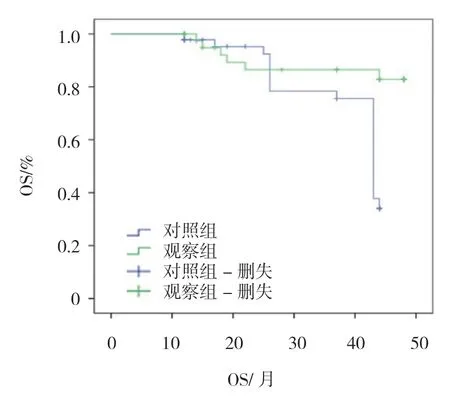
图2 药物去势联合根治性放疗对OS 的影响

表3 前列腺癌患者PFS 单因素Cox 回归分析参数

表4 前列腺癌患者PFS 多因素Cox 回归分析参数

表5 前列腺癌患者OS 单因素Cox 回归分析参数
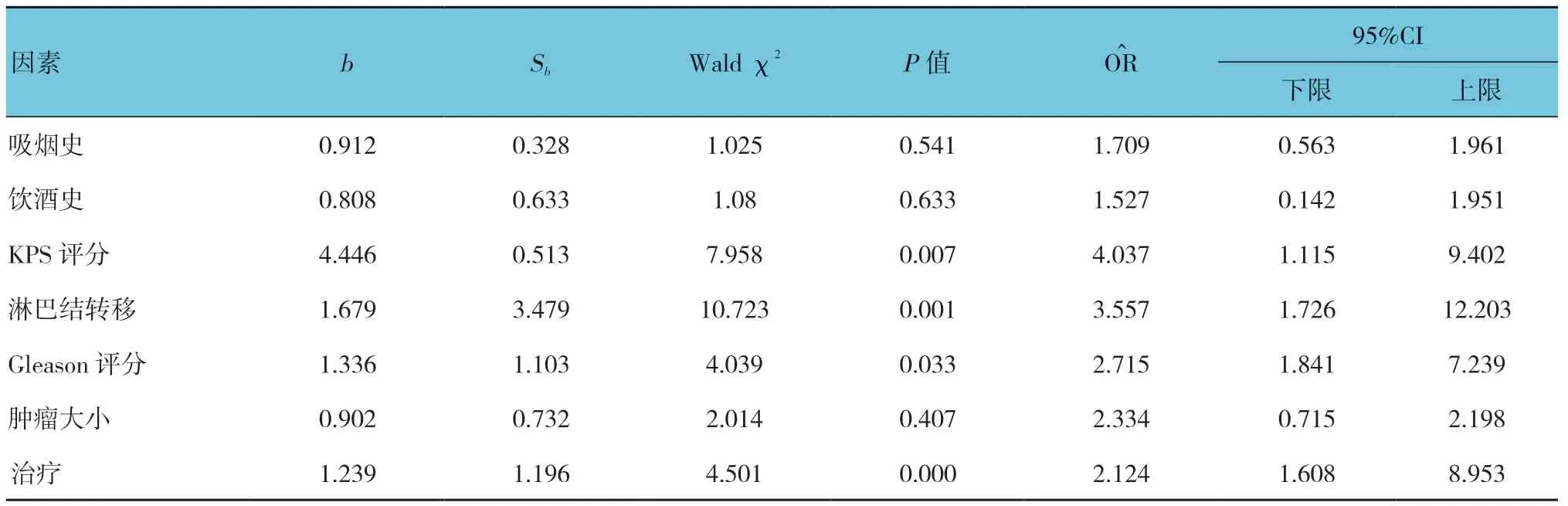
表6 前列腺癌患者OS 多因素Cox 回归分析参数
3 讨论
前列腺癌是一种进展相对缓慢的肿瘤,由于其早期症状不典型,多数患者确诊时已进展为中晚期。依据世界卫生组织(WHO)发布的2017年版《世界卫生统计》报告[14],我国男性平均寿命为74.6 岁,而本研究入组患者平均年龄为(73.3±8.6)岁,因此对高龄前列腺癌患者如何选择安全有效的治疗手段是目前广泛关注的焦点。张帆等[15]报道超高龄(>80 岁)老人行腹腔镜前列腺根治术(LRP)的10年随诊,认为目前不宜对>80 岁老年前列腺癌患者实行根治术。
有文献纳入32 465例前列腺癌患者,分别行根治性前列腺切除和根治性放射治疗,结果表明行根治性放射治疗的患者发生尿失禁、性功能障碍等并发症发生率较低[16]。IGRT 可以将传统三维适形放疗(threedimensional conformal radiation therapy, 3D-CRT)时靶区外放间距从10 mm 缩小至5 mm,进一步减小在肿瘤治疗中放射线对直肠、膀胱等周围正常组织的影响。目前国外文献报道,实行IGRT 与3D-CRT 根治性放疗后,术后发生肠道反应和髋骨骨折确诊病例明减少,绝对风险分别为13.4/100(人·年)VS 14.7/100(人·年)和0.8/100(人·年) VS 1.0/100(人·年)[17]。
既往研究表明,前列腺癌是一种雄激素依赖性恶性肿瘤,癌细胞在无雄激素刺激的情况下会发生凋亡,将雄激素水平降低至治疗前的5%~10%能有效抑制前列腺癌的进展。HUGGINS 等[18]发现手术去势和雌激素能够延缓转移性前列腺癌的进展,由此开创了前列腺癌内分泌治疗的先河。目前常用的去势治疗包括睾丸切除术、黄体生成素释放激素类似物(luteinizing hormone releasing hormone agonists, LHRH-a)及LHRH拮抗剂、抗雄激素药物等[19]。临床常用的LHRH-a药物有戈舍瑞林、曲普瑞林和亮丙瑞林,需注意的是LHRH-a 具有“闪耀”现象,即在初次注射后血清睾酮会出现2倍升高,第2 ~3 天时最明显,持续约20 d,使患者病情加剧,因此开始治疗当日应同时应用抗雄激素药物2 ~4 周,以对抗“闪耀”现象[20]。 MANDEL 对1 218例激素敏感性、非转移性前列腺癌患者行随机双盲平行对照试验,长期生存分析的结果表明,与安慰剂组比较,每日口服1 次比卡鲁胺(150 mg)可以降低局部进展性前列腺癌患者的病死率,提高总生存率,平均延长生存时间1.8年,然而在局限性前列腺癌患者中比卡鲁胺组并未提高生存率[21]。
对70 岁以上年龄段老年男性,随年龄增长预期寿命下降,患者合并症逐渐增多,围手术期风险增加,患者接受手术治疗的临床受益不明确。而就安全、有效性来言,随访结束时,在所有89例入组患者中,有70例患者随访到PFS,药物去势治疗联合放疗治疗患者PFS 及OS 长于单纯放疗患者。药物去势治疗联合根治性放疗后局限性前列腺癌患者的疾病客观缓解率与疾病控制率高于单纯根治性放疗患者;本研究发现,患者KPS 70 ~80 分、淋巴结转移阳性、Gleason 评分G 8 ~10、单纯放疗治疗的患者均是PFS、OS 的危险因素。本研究中乳腺增生发生率为47.6%(20/42),仅1例出现较明显的乳房胀痛、女性化表现。脂代谢异常率以甘油三酯升高较明显。而根治性放疗后,尿失禁率为7.1%(5/70)、白细胞减少发生率为30.0%(21/70),且均为1 ~2 度。
综上所述,对高龄中晚期前列腺癌患者放疗联合药物去势疗效较好,能有效延长患者的PFS、OS,推荐临床广泛应用。
