熊果酸对舌癌细胞Tca8113生长、迁移和凋亡的影响及机制研究*
2020-09-27房子倩龚永媚徐昊黄健华黄克强
房子倩,龚永媚,徐昊,黄健华,黄克强
(1.锦州医科大学附属第二医院 正畸科,辽宁 锦州 121004;2.锦州医科大学附属第一医院 外科学重点实验室,辽宁 锦州 121000)
舌癌是口腔癌中常见的恶性肿瘤之一,在我国,舌癌发病率居口腔癌第1 位[1]。舌癌生长快、浸润性强、恶性程度较高,常波及舌肌致舌运动受限以及语言障碍、吞咽困难,并易通过血液、淋巴循环通路至全身转移,预后差[2]。目前手术为主的综合治疗是其主要治疗方式,由于位置较为特殊,手术切除范围受限,且易破坏患者容貌,给患者身心带来极大伤害。近年来舌癌发病率呈上升趋势且不断年轻化[3],因此,研究新型有效药物对于舌癌的治疗有重要意义。
熊果酸是一种存在于天然植物中的三萜类化合物,广泛存在于蔬菜和中药中。已证明熊果酸具有抗炎、降温、保护肝损伤等作用[4-5]。近年来研究发现,熊果酸有抗癌及抗血管生成等作用[6-8]。目前国内外关于熊果酸对舌癌影响及机制的详细研究相对较少,本实验以人舌癌细胞Tca8113 为研究对象,探究熊果酸对其生长、迁移和凋亡的影响及其机制。
1 材料与方法
1.1 材料与仪器
熊果酸(药物浓度≥98%,南京景竹生物公司), 分子式:C30H48O3,分子量为456.68,CAS 号:77-52-1。 人舌鳞癌细胞株Tca8113(美国ATCC 公司),胎牛血清、RPMI1640 培养基(美国Gibco 公司),MTT(Thiazolyl Blue Tetrazolium Bromide)试剂盒、BCA 蛋白定量试剂盒、Annexin V-FITC/PI 细胞凋亡检测试剂盒(武汉碧云天生物公司),兔抗人局部黏着斑激酶(focal adhesion kinase, Fak)、磷酸化局部黏着斑激酶(phosphorylated focal adhesion kinase, p-Fak)、B细胞淋巴瘤-2(B cell Lymphoma 2, Bcl-2)、Bcl-2- Associated X 的 蛋 白 质(Bcl-2-associated X protein,Bax)、活化冬氨酸蛋白水解酶-3(cleaved cysteinyl aspartate specific proteinase 3, Cleaved-caspase 3)抗体、 辣根过氧化酶标记山羊抗兔IgG 抗体(沈阳万类生物公司),流式细胞仪、电泳仪(美国BD 公司),自动 凝胶成像仪、凝胶成像分析系统、酶标仪(美国Thermo Fisher 公司),倒置显微镜(德国LEICA 公司)。
1.2 方法
将含10%胎牛血清的RPMI 1640 培养基(含青霉素100 u/ml、链霉素100 mg/L)置于37℃、5%二氧化碳恒温箱内培养人舌癌Tca8113 细胞。待细胞处于对数生长期时,用0.25% EDTA 胰蛋白酶消化和传代,进行以下实验。
1.2.1 MTT 法测试熊果酸对Tca8113 细胞活性的影响取对数生长期Tca8113 细胞消化后离心收集,重悬后稀释浓度为5×104个/ml 接种于96 孔板中,每孔加200 恒温箱培养24 h 后,加入不同浓度梯度(0、20、40、50、80 及100 μmol/L)熊果酸的培养基于预设6 组复孔中,24 h 后每孔中加20 μl MTT 染色液孵育4 h,吸出上清液后加150 μl DMSO,震荡10 min,用酶标仪(波长490 nm)测各孔光密度(OD)值,计算各浓度细胞生长抑制率。计算方法:细胞生长抑制率(%)=(1-实验组A 值/对照组A 值)× 100%。
1.2.2 克隆形成实验取对数生长期Tca8113 细胞消化后离心收集,重悬接种于6 孔板内,500 个/孔。待细胞贴壁后加入80 μmol//L 含熊果酸培养液并设置阴性对照组。培养箱内培养7 d 后吸弃培养液,磷酸盐缓冲溶液(PBS)洗涤2 次后加结晶紫染色10 min,PBS 再次清洗,拍照记录实验结果。
1.2.3 划痕实验检测熊果酸对舌癌细胞Tca8113 迁移的影响将密度为4×105个/ml 的Tca8113 细胞每孔2 ml 接种于6 孔板中,置恒温箱培养24 h,细胞生长融合达90%左右时用200 μl 移液器枪头均匀划痕,用PBS 洗涤去除漂浮细胞,加入含熊果酸(8 μmol/L) 培养液并设空白对照组。分别于0、12 及24 h 后观察对照组与实验组划痕迁移情况,用Image J 图像处理软件分别测量0、12 及24 h 的划痕间距并计算其迁移率。
1.2.4 Hoechst33342 染色观察舌癌细胞Tca8113 的凋亡Tca8113 细胞处于对数生长期时,消化收集后制成细胞悬液接种于12 孔板内,每孔1×105个细胞,待细胞融合90%左右,加药分别培养0、12 及24 h 后,加入5 μg/ml Hoechst33342 工作液于37℃恒温孵箱染色15 min,用荧光照相显微镜拍照记录。
1.2.5 流式细胞术检测Tca8113 细胞的凋亡取对数生长期Tca8113 细胞消化后离心收集,按5×105个细胞接种于4 个培养皿中,设置空白对照组及实验组(熊果酸80 μmol/L),孵箱内培养24 h 后观察。加药培养后分别于12 和24 h 消化离心,PBS 清洗2 次后加入150 μl PBS 重悬细胞。向细胞悬液内加入5 μl AV(annexin V-FITC),4℃避光下孵育15 min 后加入10 μl 碘化丙锭(PI),混匀后孵育5 min,上机进行流式细胞仪检测。
1.2.6 Western blotting 检测相关蛋白表达取处于对数生长期Tca8113 细胞消化重悬后制成密度为5× 105个/ml 的单细胞悬液接种于培养皿中,待融合至80%时进行加药实验。设置空白对照组及实验组;收集Tca8113 细胞并于0、1、3、6、12 及24 h 后分别取出相应培养皿,待细胞在冰上裂解后提取细胞蛋白并检测蛋白浓度后制样。上样后进行电泳,用聚偏二氟乙烯膜转膜,封闭1.5 h 后,分别加一抗p-Fak、Fak、Bcl-2、Bax、Cleaved caspase-3,4℃孵育过夜,洗膜后加入辣根过氧化酶标记的二抗,经室温孵育2 h 后洗涤,加高敏荧光显影液曝光显影。
1.3 统计学方法
数据分析采用SPSS 17.0 软件,计量资料以均数± 标准差(±s)表示,比较采用t检验或单因素方差分析,进一步两两比较采用LSD-t法,P<0.05 为差异有统计学意义。
2 结果
2.1 熊果酸对Tca8113 细胞活性的影响
MTT 实验结果显示,使用不同浓度(0、20、40、 50、80 及100 μmol/L)熊果酸处理Tca8113 细胞,细胞 增殖抑制率分别为(0.00±0.00)%、(7.41±0.56)%、(22.19±1.64)%、(41.58±1.10)%、(51.11±2.00)%和(71.08±2.71)%,差异有统计学意义(F=16.595,P=0.000),随药物浓度增加,细胞增殖抑制率上升(见图1)。熊果酸浓度设为0 μmol/L 组、40 μmol/L 组和80 μmol/L 组,其克隆形成率分别为(73.0±3.6)%、(13.6±2.8)%和(0.0±0.0)%,经方差分析,差异有统 计学意义(F=36.442,P=0.000);与0 μmol/L 组比较,40 μmol/L 组和80 μmol/L 组克隆形成率降低(P< 0.05),80 μmol/L 组未见明显克隆株,处于静止期(见图2)。
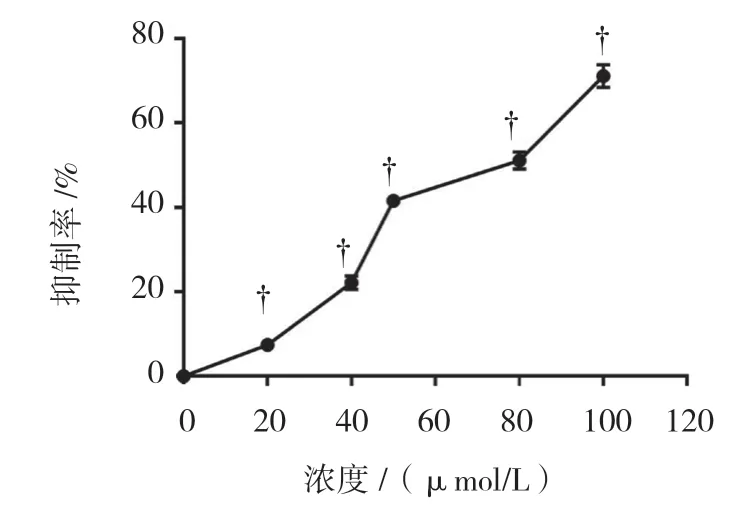
图1 不同浓度熊果酸处理24 h 对Tca8113 细胞活性的影响(±s)
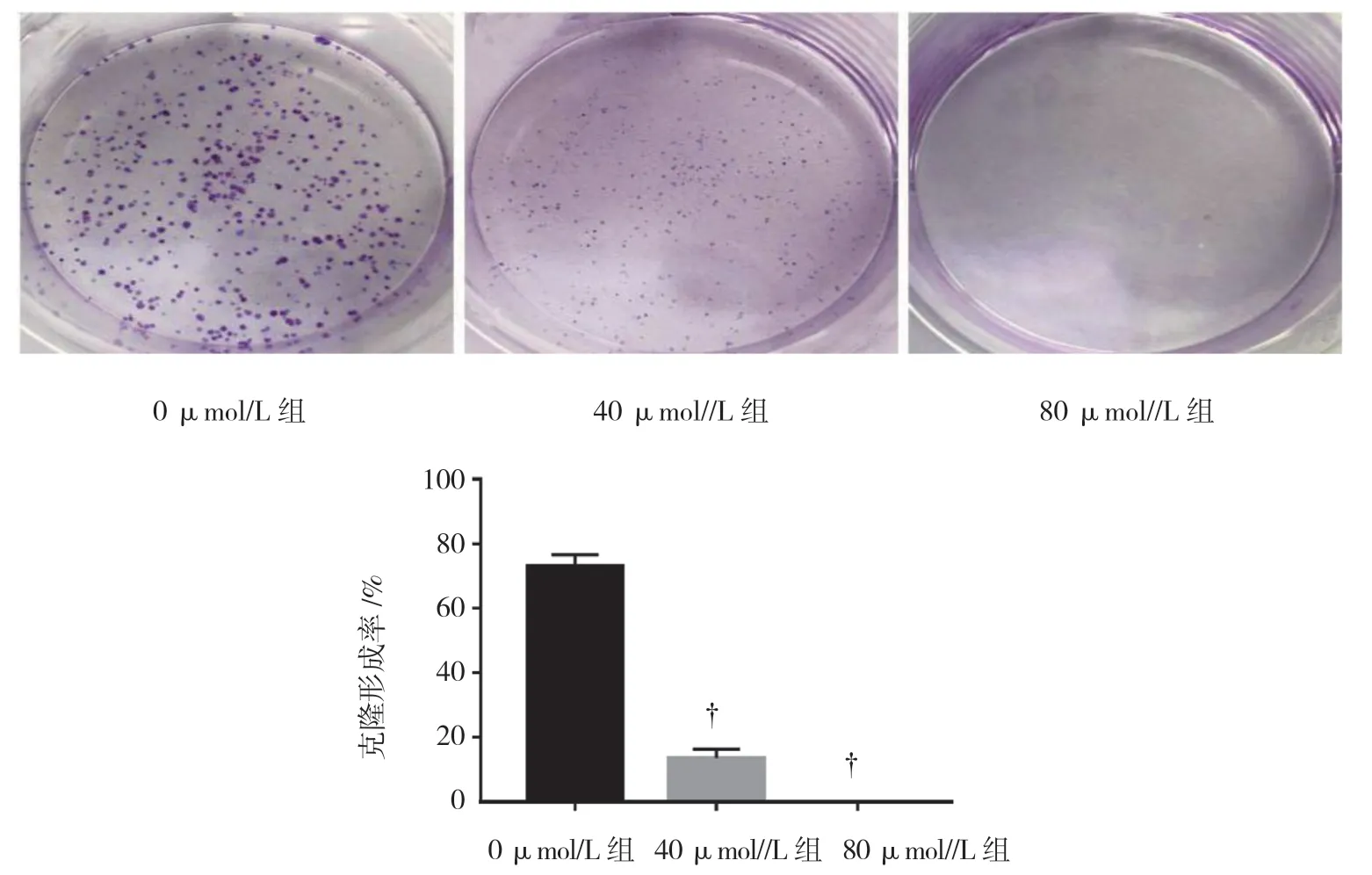
图2 不同浓度熊果酸对细胞克隆形成的影响(±s)
2.2 熊果酸对人舌癌Tca8113 细胞凋亡的影响
0 h 组细胞细胞核弥散均匀蓝光,颜色较为浅淡,形态规则,无固缩、碎裂;12 h 组出现多数细胞核高亮度荧光染色,不同程度固缩、碎裂;24 h 组大部分细胞细胞核呈高亮荧光染色,核固缩、碎裂的细胞更多(见图3)。
给 药0、12 和24 h 后凋 亡率分别 为(0.73± 0.12)%、(21.91±1.30)% 和(44.36±2.04)%,经方差分析,差异有统计学意义(F=736.006,P= 0.000);与0 h 组比较,12 h 和24 h 组凋亡率升高(P< 0.05),且随时间的增加凋亡率随之升高(见图4)。
2.3 熊果酸对舌癌细胞Tca8113 迁移的影响
12 和24 h 后空白对照组发生迁移(见图5、6 和表1),实验组的划痕比空白对照组宽,迁移率随时间的延长而提高,镜下观察可见细胞的体积减小、形态皱缩等变化,划痕后细胞愈合能力降低并随时间的延长而降低。12 h 实验组与空白对照组比较,差异有统计学意义(t=3.911,P=0.041);24 h 实验组与空白对照组比较,差异有统计学意义(t=11.539,P=0.001);24 h 实验组与12 h 实验组比较,差异有统计学意义(t= -13.735,P=0.000)。
2.4 Tca8113 细胞的相关蛋白表达
各相关蛋白相对表达水平在不同时间点的比较,差异有统计学意义(P<0.05),p-Fak、Fak、Bcl-2 的蛋白 表达水平随时间延长而降低,而Bax、Cleaved Caspase-3的蛋白表达水平随时间延长而升高。见图7 和表2。

图3 各组细胞的形态学改变(Hoechst33342 染色)
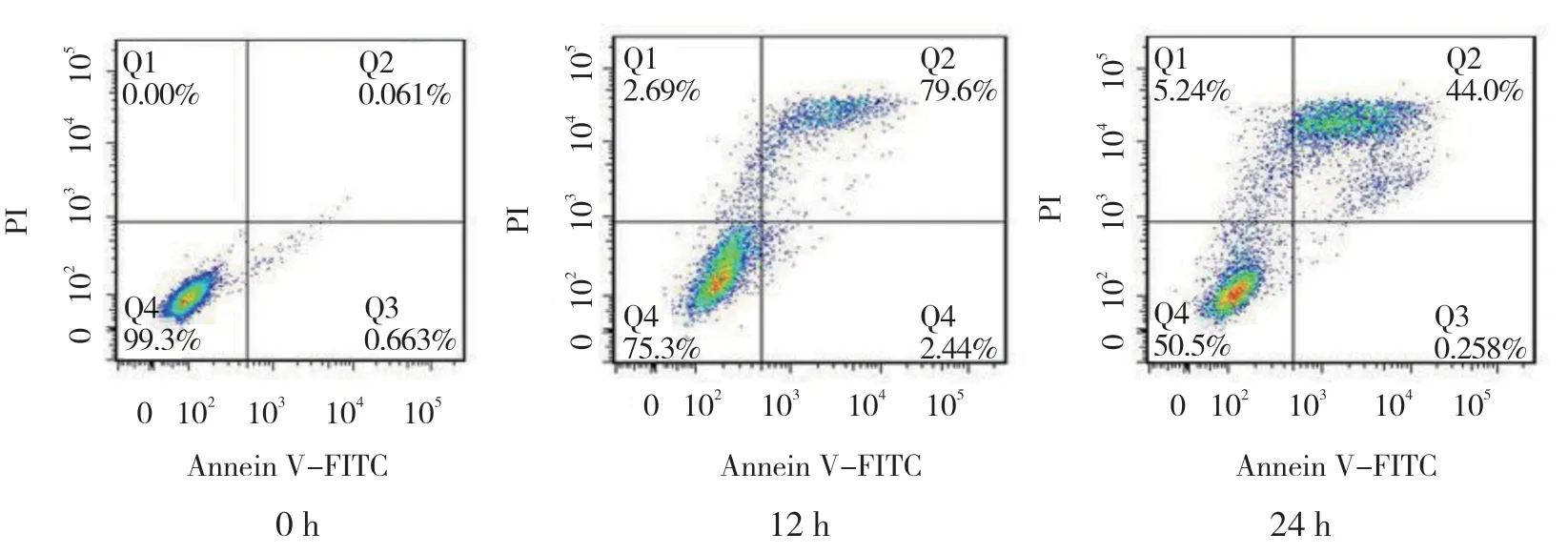
图4 熊果酸对Tca8113 细胞凋亡的影响

图5 两组不同时间点的划痕比较
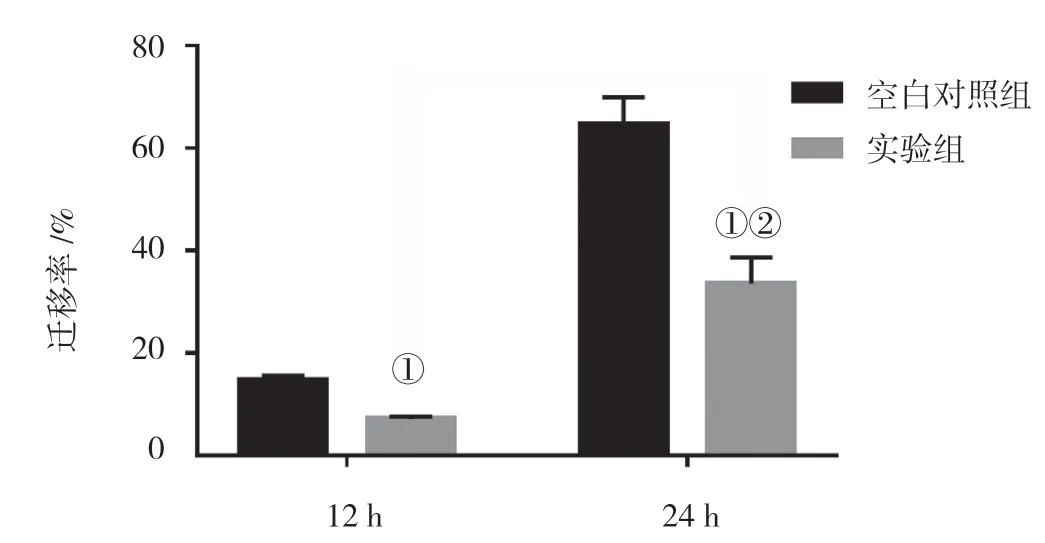
图6 熊果酸对Tca8113 细胞迁移能力的影响(±s)
表1 熊果酸对Tca8113 细胞迁移率的影响 (n =3,%,±s)

表1 熊果酸对Tca8113 细胞迁移率的影响 (n =3,%,±s)
注:①与空白对照组比较,P <0.05;②与12 h 实验组比较,P < 0.05。
组别 12 h 24 h空白对照组 14.29±3.50 64.23±6.70实验组 7.14±2.60① 47.83±5.10①②

图7 熊果酸对Tca8113 细胞相关蛋白表达量的影响
表2 各时间点不同蛋白相对表达水平比较 (±s)

表2 各时间点不同蛋白相对表达水平比较 (±s)
组别 Bcl-2 Bax Cleaved Caspase-3 p-Fak Fak 0 h 1.302±0.045 0.242±0.013 0.131±0.003 0.738±0.039 0.775±0.064 1 h 1.063±0.059 0.323±0.009 0.209±0.009 0.583±0.019 0.709±0.044 3 h 0.836±0.036 0.468±0.010 0.292±0.008 0.528±0.020 0.623±0.026 6 h 0.724±0.031 0.552±0.020 0.357±0.012 0.508±0.020 0.571±0.027 12 h 0.615±0.041 0.747±0.038 0.462±0.019 0.273±0.016 0.186±0.009 24 h 0.576±0.033 0.931±0.049 0.529±0.032 0.163±0.008 0.113±0.008 F 值 131.910 255.415 236.973 259.171 180.578 P 值 0.000 0.000 0.000 0.000 0.000
3 讨论
熊果酸又名乌苏酸,以与糖结合成苷或者游离的形式分布于多种植物中,有抗菌、降血糖等多种生物活性[9]。近年来研究发现熊果酸有抗肿瘤作用,通过对肿瘤细胞活性、凋亡、血管生成、迁移等多种生物学功能进行调控[10],发挥抑制肿瘤细胞发生、发展的作用[11]。本实验发现其对舌癌Tca8113 细胞有抑制作用且呈浓度依赖性,提示熊果酸有抗肿瘤作用,与相关实验研究结果[12-15]一致。在前列腺癌研究中,熊果酸通过ROCK/PTEN 介导Cofilin-1 线粒体定位,从而诱导前列腺癌细胞的凋亡[16]。本实验结果表明,熊果酸对Tca8113 细胞具有促凋亡作用,且呈时间依赖性。细胞凋亡是由基因主导的细胞自发有序死亡过程,大致分为内源性途径和外源性途径2 种,其中内源性凋亡的核心环节是线粒体途径,其过程包括抗凋亡因子Bcl-2 表达量减少,促凋亡因子Bax 的表达量增加并转位线粒体,进一步调节Cyt C,使Cyt C 释放入胞浆,激活Caspase-9 进而召集激活Caspase-3,引起Caspase 级联反应,下游底物剪切被激活从而发生细胞凋亡[17],其中Bcl-2 和Bax 的比值对内源性凋亡有重大影响。本实验结果表明,Tca8113 细胞经熊果酸作用后Bax 表达量增强,而Bcl-2 表达量减弱,Bcl-2/Bax 比值降低,且Cleaved caspase-3 表达增强,提示熊果酸可诱导Tca8113 细胞的凋亡。可推测熊果酸能促进Bax 等促凋亡基因表达而抑制Bcl-2 等抑凋亡基因表达,进而激活Caspase-3 引发其级联反应,导致细胞凋亡。GAYATHRI 等[18]发现熊果酸能通过线粒体凋亡的途径诱导白血病细胞K562 凋亡,与本研究结果相符。
肿瘤细胞的迁移与细胞外基质黏附作用有关, Fak 是一种蛋白酪氨酸激酶,可调节各种类型细胞的黏附、运动、迁移和存活。Fak 在晚期癌症中可通过与整合素、G 蛋白偶联受体和细胞因子受体的相互作用而被激活,并促进癌症进展和转移[19]。在胶质瘤研究中发现通过抑制Fak 表达,可抑制其迁移能力[20]。研究表明[21],抑制乳腺癌细胞的Fak 后,其细胞迁移减少,降低了乳腺癌发生,并认为Fak 是通过维持肿瘤干细胞的量来促进癌症的发生。Fak 激酶依赖性功能通常与局灶性黏连的整合素相关信号传导相关,在正常细胞和癌细胞中的细胞迁移和黏附中起重要作用,其结构位于Fak 的中间并含有活化环,酪氨酸(Y)位点Y576 和Y577,它们可被Src 磷酸化,可以抑制肿瘤生长和转移[22]。活化的Fak 作为肿瘤进展和转移的关键信号介质起着重要作用,表明Fak 是癌症治疗的潜在靶点[23]。本研究划痕实验结果表明,一定浓度熊果酸可对Tca8113 迁移起到抑制作用,同时经熊果酸处理后p-Fak、Fak 表达下调,说明熊果酸可抑制Tca8113 细胞的迁移,这一结论与其在其他肿瘤中的现象一致[24-25]。
综上所述,熊果酸作为一种天然植物中的三萜类化合物,能抑制舌癌Tca8113 细胞的体外活性,下调p-Fak、Fak 抑制其迁移,并通过促进Bax 表达、抑制Bcl-2 表达,诱导其凋亡。
