果酸联合调q激光治疗中波紫外线诱导黄褐斑鼠模型的实验研究
2020-09-25贾晓敏陈伟谭文蒋甜甜廖阳英唐桦冯浩
贾晓敏,陈伟,谭文,蒋甜甜,廖阳英,唐桦,冯浩
[1.西藏自治区拉萨市人民医院 病理科,西藏 拉萨 850000;2.西藏自治区卫生健康委员会,西藏 拉萨850000;3.长沙市中医医院 病理科,湖南 长沙 410111;4.湖南师范大学附属第一医院 (湖南省人民医院) 皮肤科,湖南 长沙 410005]
黄褐斑是一种常见的后天色素沉着性皮肤病,常表现为对称网状色素沉着,颜色深浅不一,易复发,好发于女性。临床上50%~80%患者易发于面中部[1],主要影响美观,增加患者心理压力,降低患者生活质量。黄褐斑病因尚未明确,研究认为可能与遗传易感性、日晒、内分泌因素、长期摄入某些药物、微量元素缺乏、精神因素等相关[2]。目前治疗方法多样,各种外用药物 (如:氢醌、果酸) 、系统用药 (如:氨甲环酸、维生素C) 、光学治疗 (如:强脉激光、调q激光) 均取得一定的疗效,但仍有限[3],且目前相关治疗主要以临床研究为主,缺少相关机制研究。本研究主要通过动物实验,研究果酸联合调q激光治疗中波紫外线诱导的黄褐斑鼠模型的疗效,并初步探讨其可能机制。
1 材料与方法
1.1 材料
SPF级雌性豚鼠30只,6~8周龄,体重250~300 g,由湖南太平洋生物科技有限公司提供,黄体酮注射液 (规格1 ml:20 mg) 购自广州白云山明兴制药有限公司,戊巴比妥钠注射液购自广东邦民制药厂有限公司,果酸、果酸无菌刷、果酸中和液 (1%碳酸氢钠溶液) 购自薇诺娜公司,3%氢醌乳膏购自广东人人康药业有限公司,超氧化物歧化酶 (superoxide dismutase,SOD) 试剂盒及丙二醛 (Malondialdehyde,MDA) 试剂盒购自南京建成生物工程研究所,HMB45鼠单克隆抗体购自英国Abcam公司。
1.2 动物分组及模型复制、治疗
随机将30只豚鼠分为正常组 (6只)和实验组 (24只),选取背部约3 cm×3 cm 皮肤剃毛备用。正常组不予以特殊处理;实验组参照文献[4-5]模型复制的方法,于豚鼠后腿根部屈侧肌内注射黄体酮与0.9%氯化钠注射液混合液 (1∶1),20 mg/kg,1次/d,左右腿交替,连续注射30 d,同时每日予以波长280~320 nm的中波紫外线 (上海季光特种照明电器有限公司紫外线灯) 照射背部裸露的皮肤 (紫外灯距离豚鼠背部约20 cm),1次/d,60 min/次,共30 d,复制黄褐斑鼠模型。随机挑选实验组及正常组豚鼠各6只,抽取心脏血行SOD和MDA检测,取背部约1.0 cm×1.0 cm 皮损处全层皮肤组织,行HE和免疫组织化学染色。实验组余18只为模型组,随机分为A、B、C组,每组6只。A组予以果酸联合调q激光治疗,初始选用20%的果酸[6],均匀涂抹于皮损处,停留3~5 min 并密切观察皮肤反应后,使用1%碳酸氢钠中和液中和,再冷喷20 min,2 周后采用调q激光治疗,波长1 064 nm,能量1.3~2.4 J/cm2,光斑半径为5 mm,治疗头垂直皮肤表面,平行均匀扫描患处3或4次,1个月为1个疗程,共4个疗程,果酸浓度依次为20%、35%、50%、70%[7];B组于黄褐斑鼠背部病灶皮损处涂抹3%氢醌软膏,1次/d;C组不做任何特殊处理。4个月后进行检测。
1.3 血清及皮肤、肝脏组织匀浆的制备
于心脏处抽取血液5 ml,离心,获取血清。随后分离出皮损组织及肝脏组织,用预冷4℃的0.9%氯化钠NaCl 溶液漂洗,滤纸拭干,称重,皮肤和肝脏组织各约0.5 g,将组织剪碎,置于匀浆器中加入0.9% NaCl溶液约4.5 g,将其研磨制备成10%的组织匀浆,随后将匀浆液离心,取上清液进行检测[8]。
1.4 血清及皮肤、肝脏组织SOD、MDA检测
血清及皮肤、肝脏组织SOD、MDA的测定按试剂盒操作要求进行,采用分光光度法测定样品管的吸光度值,检测SOD、MDA水平[9]。
1.5 皮肤组织病理学检测
HE染色病理标本切片制备:取各组豚鼠皮损部位全层皮肤,约1.0 cm×1.0 cm,随即放入10%中性甲醛进行固定、石蜡包埋、切片、HE染色,观察皮肤的组织病理学变化。免疫组织化学染色:选用SP法标记黑色素细胞,一抗选用鼠抗人单克隆抗体HMB45,己二酸二丁酯 (DAB) 显色,苏木精复染。用磷酸盐缓冲液代替一抗做阴性对照。
1.6 统计学方法
数据分析采用SPSS 13.0 统计软件,计量资料以均数±标准差 (±s)表示,比较采用t检验或方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 正常组与模型组皮损表现
正常组豚鼠背部皮肤呈均匀的浅棕色;模型组黄褐斑鼠背部模型复制区域皮肤呈均一稳定、边界清晰的深褐色色斑。见图1。
2.2 正常组与模型组皮损病理组织学形态变化
正常组豚鼠表皮的鳞状上皮层细胞排列整齐,较菲薄,由排列整齐的基底细胞和棘细胞组成,2或3层,真皮层内未见微小血管扩张,炎症细胞少见;模型组黄褐斑鼠表皮的鳞状上皮层细胞明显增生,核大且排列紊乱,真皮层内可见小血管增生扩张,炎症细胞多见,基底层可见连续分布的黑素颗粒。见图2。
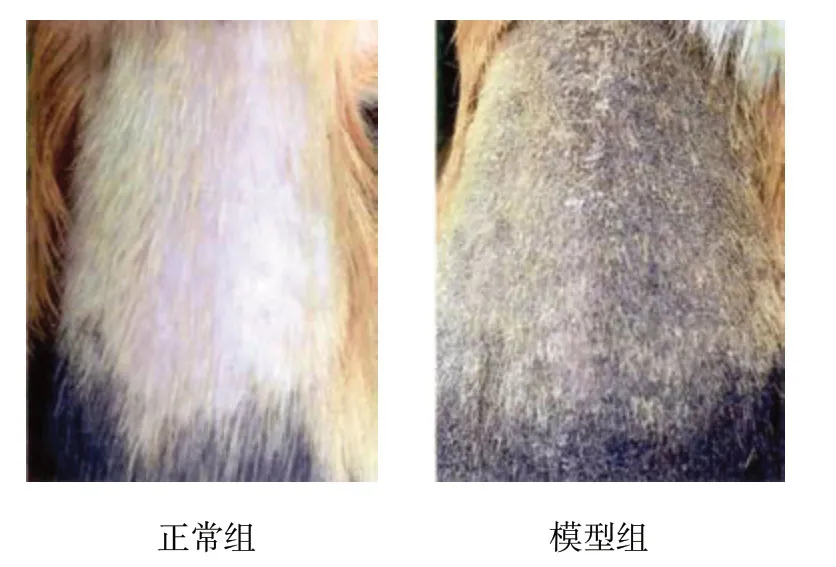
图1 皮损表现
2.3 正常组与模型组上皮层内黑色素细胞的分布
正常组豚鼠上皮层内可见少许黑色素细胞,主要分布于基底层,胞浆着色棕褐色;模型组黄褐斑鼠上皮层内可见大量黑色素细胞,成簇分布于基底层和棘层,胞浆着色深褐色,伴细胞核增大及核上移,表皮细胞数增多。见图3。
2.4 正常组与模型组血清MDA、SOD水平比较
两组MDA和SOD水平的比较,差异有统计学意义 (P<0.05),模型组血清MDA水平上升,SOD水平下降。见表1。
2.5 模型组治疗前后皮损比较
模型组治疗前皮损处均可见均一稳定、边界清晰的深褐色斑。A组治疗后可见皮肤稍淡红,无明显色素沉着;B组治疗后可见皮肤颜色变浅,仅有局部小片色素沉着,治疗过程中皮肤偶有干燥、脱屑;C组治疗后肉眼可见皮肤色素稍减退,但仍明显区别于正常皮肤。见图4。
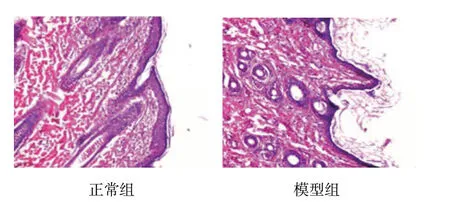
图2 皮肤病理改变 (HE染色×100)
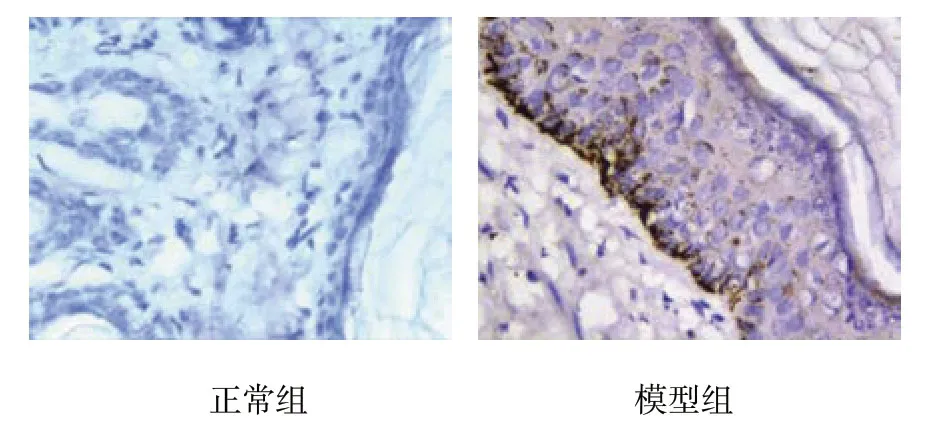
图3 上皮层内黑色素细胞的分布改变 (SP法×400)
表1 模型组与正常组血清MDA及SOD比较 (n=6,±s)

表1 模型组与正常组血清MDA及SOD比较 (n=6,±s)
组别 MDA/nmol SOD/u正常组 2.922±0.514 268.935±4.845模型组 7.758±1.168 196.687±7.062 t值 9.283 20.671 P值 0.000 0.000
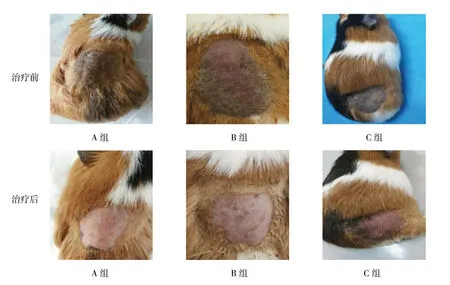
图4 模型组治疗前后皮损比较
2.6 模型组治疗后皮损HE染色结果
A组和B组豚鼠表皮的上皮层细胞增生有所减轻,排列整齐,真皮层内微小血管扩张减轻,炎症细胞浸润少见,黑色素细胞分辨不清晰;C组豚鼠表皮的上皮层细胞明显增生,核大且排列紊乱,真皮层内仍可见微小血管扩张增生,炎症细胞浸润多见,基底层可见黑色素细胞连续分布。见图5。
2.7 模型组治疗后皮损免疫组织化学结果
A组和B组黄褐斑鼠上皮基底层可见胞浆着色为深褐色的黑色素细胞,棘层及角质层未见黑色素细胞,黑色素细胞呈线状或散在分布;C组豚鼠上皮基底层和棘层仍可见大量黑色素细胞,胞浆着色深褐色,黑色素细胞堆积,呈层状分布。见图5。
2.8 模型组治疗后SOD、MDA水平比较
治疗干预后,A、B、C组血清SOD和MDA,肝脏SOD和MDA,皮肤SOD和MDA比较,差异有统计学意义 (P<0.05)。治疗后A、B组与C组比较,血清SOD活力上升 (t=10.419和11.824,均P=0.000) ;A、B两组差异无统计学意义 (t=0.323,P=0.753)。A、B组血清MDA水平均较C组下降 (t=6.014和4.153,均P=0.002) ;A、B两组差异无统计学意义 (t=4.304,P=0.155)。A、B两组肝脏SOD活性较C组上升 (t=8.760和11.082,均P=0.000) ;A、B两组差异无统计学意义 (t=0.756,P=0.467)。A、B两组肝脏MDA水平较C组下降 (t=0.782和0.429,P=0.042和0.003) ;A、B两组差异无统计学意义 (t=1.592,P=0.142)。A、B两组皮肤SOD活性较C组升高 (t=3.028和4.385,P=0.013和0.001) ;A、B两组差异无统计学意义 (t=0.197,P=0.847)。皮肤MDA水平A、B组低于C组 (t=5.719和4.825,均P=0.000) ;A、B两组差异无统计学意义 (t=1.359,P=0.204)。见表2。
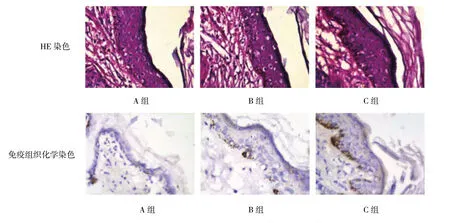
图5 模型组治疗后皮损染色结果 (×400)
表2 各组治疗后血清、肝脏和皮肤组织中SOD及MDA的水平比较 (±s)
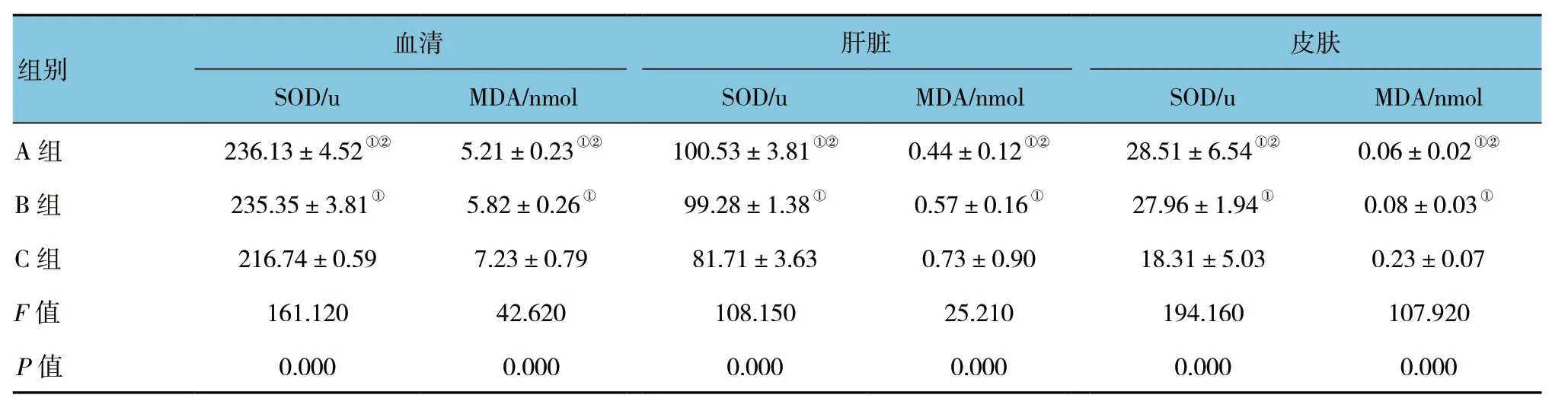
表2 各组治疗后血清、肝脏和皮肤组织中SOD及MDA的水平比较 (±s)
注:①与C组比较,P<0.05;②与B组比较,P>0.05。
组别血清 肝脏 皮肤SOD/u MDA/nmol SOD/u MDA/nmol SOD/u MDA/nmol A组 236.13±4.52①② 5.21±0.23①② 100.53±3.81①② 0.44±0.12①② 28.51±6.54①② 0.06±0.02①②B组 235.35±3.81① 5.82±0.26① 99.28±1.38① 0.57±0.16① 27.96±1.94① 0.08±0.03①C组 216.74±0.59 7.23±0.79 81.71±3.63 0.73±0.90 18.31±5.03 0.23±0.07 F值 161.120 42.620 108.150 25.210 194.160 107.920 P值 0.000 0.000 0.000 0.000 0.000 0.000
3 讨论
黄褐斑是一种以面部色素沉着为主的损容性疾病,多发于育龄期女性,对患者的容貌、心理造成一定影响,治疗起来难度较大,复发率很高。黄褐斑的发病机制复杂,一般认为是由多种因素导致黑色素细胞中黑色素过量表达及代谢障碍所致[10]。黑色素的形成与脂质过氧化和酪氨酸酶密切相关。人体在应激状态下或紫外线刺激时,可使体内氧自由基增多,SOD 相对不足,导致过多的氧自由基与真皮层细胞产生氧化反应,形成大量的脂褐素,形成黄褐斑[11]。目前黄褐斑的治疗方式多种多样,果酸及调q激光在临床上的应用均取得一定疗效,但两者联合应用的报道相对较少。
果酸化学名称为乙醇酸,是目前突出的化学剥脱试剂的主要成分,在治疗色素沉着性皮肤问题方面受到越来越多的关注[12]。果酸治疗黄褐斑见效较慢,且对深层的色素疗效欠佳。就其作用机制而言,较多的关注在于其化学剥脱作用,其他可能机制有待进一步研究。调q激光可以调节波长控制治疗深度,在不影响周围组织的情况下,选择性地破坏黑素体。但调q激光的缺点是靶组织吸收少,爆破不够,单一提高能量,对周边皮肤组织及基膜会造成损害,有增加色素沉着的风险[13-14]。故单一使用果酸或调q激光均有一定局限性。
因此,本研究联合2种治疗方法治疗黄褐斑鼠。结果显示不同浓度的果酸联合调q激光周期性干预治疗黄褐斑鼠后,肉眼观色素沉着基本消退。HE染色可见表皮的上皮层细胞增生、排列紊乱及真皮层内微小血管扩张明显减轻,炎症细胞浸润减少,免疫组织化学染色结果示表皮黑色素细胞呈线状或散在分布,相对于自然恢复对照组,黑色素细胞及黑色素颗粒明显减少。均提示黄褐斑明显改善。果酸联合调q激光治疗后血清、肝脏、皮肤组织的MDA水平降低,SOD水平升高,提示治疗的同时又明显有抗氧化作用。故结合果酸及调q激光的治疗特点,考虑果酸还有一定的抗氧化性,能促使SOD水平升高,MDA水平降低,抑制机体内过氧化程度,从而使黑色素细胞的生成减少,减少皮肤的色素沉着。
综上所述,果酸联合调q激光治疗黄褐斑效果显著,其机制可能与果酸的剥脱作用、抗氧化作用,以及调q激光选择性破坏黑色素细胞、减少黑色素生成有关。
