低浓度呕吐毒素作为激发子对马铃薯抗干腐病的诱导及其作用机制
2020-09-25赵潇璨徐永清贺付蒙孙美丽孔德兴冯艳忠陈赫书李凤兰
赵潇璨 徐永清 贺付蒙 孙美丽 袁 强 王 雪 孔德兴 刘 丹 冯艳忠 陈赫书 田 明 刘 娣 李凤兰,*
研究简报
低浓度呕吐毒素作为激发子对马铃薯抗干腐病的诱导及其作用机制
赵潇璨1徐永清1贺付蒙1孙美丽1袁 强1王 雪1孔德兴1刘 丹1冯艳忠2陈赫书2田 明2刘 娣2李凤兰1,*
1东北农业大学生命科学学院, 黑龙江哈尔滨 150030;2黑龙江省农业科学院, 黑龙江哈尔滨 150086
干腐病是马铃薯窖储过程中镰刀菌侵染引发的真菌病害, 严重影响了马铃薯的商品价值。呕吐毒素(vomitoxin, DON)又称脱氧雪腐镰刀菌烯醇, 是马铃薯干腐病致病镰刀菌在侵染薯块过程中产生的次生代谢产物。生物防治是病害防治的有效方法, 其中采用生物因子作为激发子诱导植物系统抗性的方法成为热门。本研究采用低浓度DON作为激发子对马铃薯块茎进行处理, 确定其在马铃薯抗干腐病中的作用及诱导马铃薯系统获得抗性(systemic acquired resistance, SAR)作用机制, 为马铃薯干腐病的生物防治提供理论依据。DON处理对马铃薯干腐病的扩展具有一定的影响, 且存在浓度效应, 其中5 ng mL-1DON处理马铃薯4 h能有效降低接种接骨木镰刀菌马铃薯块茎的干腐病病斑直径扩展; 低浓度DON处理提高了块茎组织的SOD、POD、几丁质酶、β-1,3-葡聚糖酶活性, 减少细胞膜过氧化产物MDA的积累; 薯块内的苯丙烷代谢关键酶PAL和4CL的活性升高, 促进了代谢产物总酚、类黄酮、木质素和花青素的积累。同时DON作为激发子可诱导马铃薯块茎中内源信号分子SA、JA和ET的含量增加, 植物系统抗性的调控基因的表达量上调。
马铃薯; 干腐病; 镰刀菌; 呕吐毒素; 激发子; 诱导抗性
马铃薯()是茄科茄属草本植物, 其总产量位居第四, 是世界重要农作物之一[1]。采后的马铃薯通常需要入窖储藏, 因此窖储质量关乎马铃薯的品质及其商品价值[2]。马铃薯窖储过程中易发生多种病害, 其中, 马铃薯干腐病是最为普遍的一种真菌病害[3], 其致病菌为镰刀菌, 其中接骨木镰刀菌()致病性最强[4]。马铃薯干腐病的防治方法中, 化学防治常用好力克悬浮剂[5]、乳剂阿米西达、粉剂多菌灵和百菌清等[6]杀菌剂。人工综合防治则要求在选种、种植、田间管理、收获运输及储藏等每一个环节都要严格把关[7]。生物防治采用致病菌的拮抗菌抑制病原菌的生长, Sadfi等[8]与Jawed等[9]的研究均证实拮抗菌对病原菌的抑制作用。
激发子(elicitor), 指能够诱导寄主防卫反应的任何诱导因子, 即使浓度很低也会诱导植物产生系统获得抗性[10], 这种防御反应被称为诱导抗病性(induced resistance, RI)[11]。相比传统防治方法, 利用激发子诱导植物系统抗性具有见效快、污染小、应用范围广等优点[12]。植物诱导抗性反应的信号传导中, 水杨酸(salicylic acid, SA)等信号分子起到了重要作用。研究表明, 许多激发子诱导植物产生抗病性都是通过SA信号途径来完成[13]。不同于烟草等植物, 马铃薯通过提高机体对SA的敏感度来诱导产生SAR, 这种机制可能是通过增加SA对受体的可及性或诱导SA受体的合成或活性而发生[14]。呕吐毒素(vomitoxin, DON)是马铃薯干腐病致病镰刀菌分泌的毒素之一, 被认为是重要的致病因子[15]。Bajestani等[16]研究发现, 低浓度呕吐毒素可以诱导小麦的系统获得性抗性, 同时这种现象也在水稻[17]、玉米[18]等植物中被发现。这些研究证明了低浓度毒素可以作为激发子诱导植物产生抗性。
本课题组在前期工作中发现, 低浓度DON处理可降低镰刀菌的致病性, 但低浓度DON是否具有激发子作用还不明确。本研究采用低浓度DON对马铃薯块茎进行处理, 通过分析薯块中的诱导抗氧化酶、细胞壁降解酶、苯丙烷代谢途径关键酶和相关产物、内源激素及关键调控基因表达特性, 探讨DON作为激发子与马铃薯块茎抗病诱导的相关性, 以期为窖储马铃薯干腐病的预防和治理提供理论依据和新的思路。
1 材料与方法
1.1 材料
马铃薯易感栽培品种大西洋(Atlantic)、脱毒马铃薯块茎(原原种)由黑龙江省农业科学院提供。菌株为接骨木镰刀菌(), 由东北农业大学植物学实验室保存。镰刀菌于PDA培养基中25℃恒温黑暗条件下培养15 d后使用。呕吐毒素(DON)购于FERMENTEK公司。
1.2 方法
1.2.1 DON作为激发子的处理浓度筛选和时间点确定
将DON配制成1、5、10、15、20、25、30、35、40、45和50 ng mL-1的系列工作液。选择外观整齐、无损伤的健康马铃薯块茎消毒后于超净台中用灭菌打孔器打直径1 cm、深2 cm的孔, 孔中分别接入300 μL不同浓度的DON工作液, 无菌水为对照。处理6 h后, 用打孔器将镰刀菌打成菌饼, 接入小孔内, 在25℃培养箱中培养10 d后剖开薯块, 十字交叉法测定病斑大小。每组30个薯块, 重复3次。
采用5 ng mL-1的DON处理薯块, 在分别处理0、2、4、6、12、24和48 h后, 使用无菌水清洗薯块终止处理, 并在小孔内接种菌饼, 25℃培养10 d后剖开薯块, 十字交叉法测定病斑大小。每组30个薯块, 重复3次。
1.2.2 DON激发子处理后马铃薯块茎抗氧化性指标测定
采用5 ng mL-1的DON处理薯块, 无菌水为对照, 毒素处理方法如1.2.1。分别于处理后0、2、4、6和12 h时, 去除表层变色组织, 以小孔为中心取样1 g, 锡纸包好后放入液氮速冻, 最后于-80℃保存备用。使用液氮研磨法提取样品。参照张志良等[19]方法测定抗氧化性指标超氧化物歧化酶(superoxide dismutase, SOD)活性、过氧化物酶(peroxidase, POD)活性和丙二醛(malondialdehyde, MDA)含量。
1.2.3 DON激发子处理后马铃薯块茎细胞壁防御酶测定
处理及取样方法同1.2.2, 分别于0、2、4、6和12 h取样0.5 g。液氮研磨法提取粗酶液。采用文献[20]方法测定几丁质酶和β-1,3-葡聚糖酶活性。每组重复3次。
1.2.4 DON激发子处理后马铃薯块茎苯丙烷代谢关键酶及产物测定 处理及取样方法同1.2.2, 分别于 0、2、4、6和12 h取样3 g, 用于苯丙氨酸解氨酶(phenylalanineammonialyase, PAL)和4-香豆酰辅酶A连接酶(4-coumarate:coenzyme A ligase, 4CL)测定; 分别于2、4、6和8 d取样3 g, 用于总酚、类黄酮、花青素及木质素的测定。参照曹建康等[21]与杨志敏等[22]的方法, 每组重复3次。
1.2.5 DON激发子处理后马铃薯块茎内源激素测定
处理及取样方法同1.2.2, 分别于0、2、4、6和12 h取样0.5 g, 用于SA、JA和ET含量的测定, 采用刘玉良等[23]的方法和酶联免疫分析法。
1.2.6 DON激发子处理后马铃薯块茎调控因子的表达分析 处理及取样方法同1.2.2, 分别于0、2、4、6和12 h取马铃薯块茎鲜重0.1 g。提取样品RNA, 分光光度计法测定浓度, 再将RNA反转录成cDNA第1条链。
从NCBI序列数据库中查找马铃薯序列, 使用Primer Premire 5.0软件设计并合成扩增马铃薯基因片段的荧光PCR引物(表1)。扩增片段的长度为182 bp, 内参基因为[24]。以马铃薯cDNA为模板, 进行Real-time PCR扩增。采用比较CT法(∆∆CT)处理荧光定量PCR扩增数据。相对表达量2−∆∆CT= 2−(∆CT处理−∆CT对照)= 2−[(CT处理−CT内参)−(CT对照−CT内参)]。
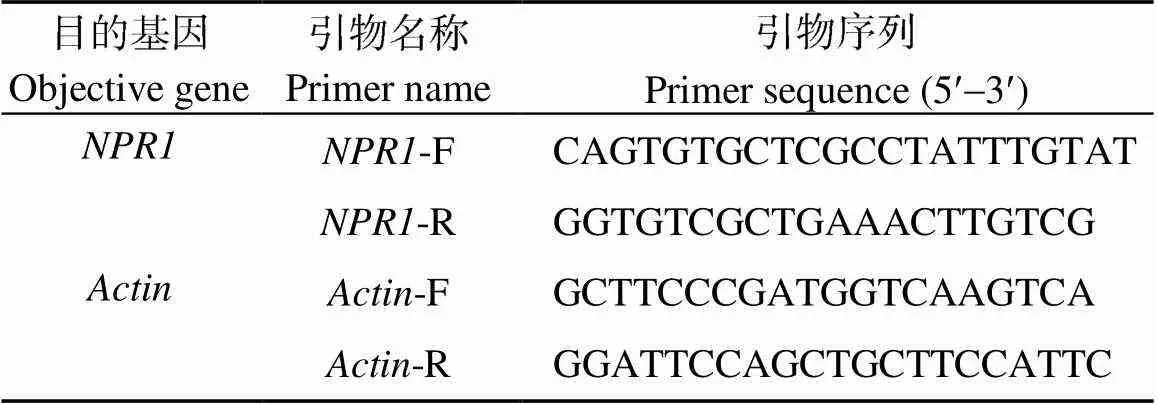
表1 Real time-PCR引物序列
1.3 数据统计分析
采用Microsoft Excel录入试验数据、分析结果并作图。采用SPSS 17.0软件进行统计分析, 根据不同方法的适用条件, 选择独立样本检验或单因素方差分析法分析试验数据。
2 结果与分析
2.1 DON作为激发子处理浓度筛选
本试验采用不同浓度DON处理马铃薯块茎, 薯块病斑直径测定结果见图1, 内部形态变化见图2。随着DON浓度升高, 病斑直径呈减小–增大–减小–增大的趋势, 表明DON处理的浓度与马铃薯抗病性提高密切相关。与对照(图2-a)相比, 1 ng mL-1DON处理薯块后(图2-b), 病斑直径不显著减小。用5、10、15 ng mL-1的DON处理薯块后, 薯块病斑直径较小且几乎无扩展(图2-c~e), 表明低浓度DON处理马铃薯块茎后, 可有效抑制病斑直径的扩展。5 ng mL-1DON处理薯块后, 薯块病斑直径最小, 低于对照处理薯块病斑直径的92.0% (<0.05)。在DON浓度为35 ng mL-1(图2-i)处理组中, 也有效地抑制病斑直径扩展(<0.05), 但抑制程度低于5 ng mL-1DON处理组; 当DON浓度高于35 ng mL-1后, 随着浓度的升高, 病斑直径逐渐增大(图2-j~l), 且在50 ng mL-1(图2-l)时, 薯块腐烂最为严重。说明用5 ng mL-1DON处理, 能显著减小马铃薯块茎干腐病的病斑直径, 诱导马铃薯块茎抗干腐病的效果最佳。
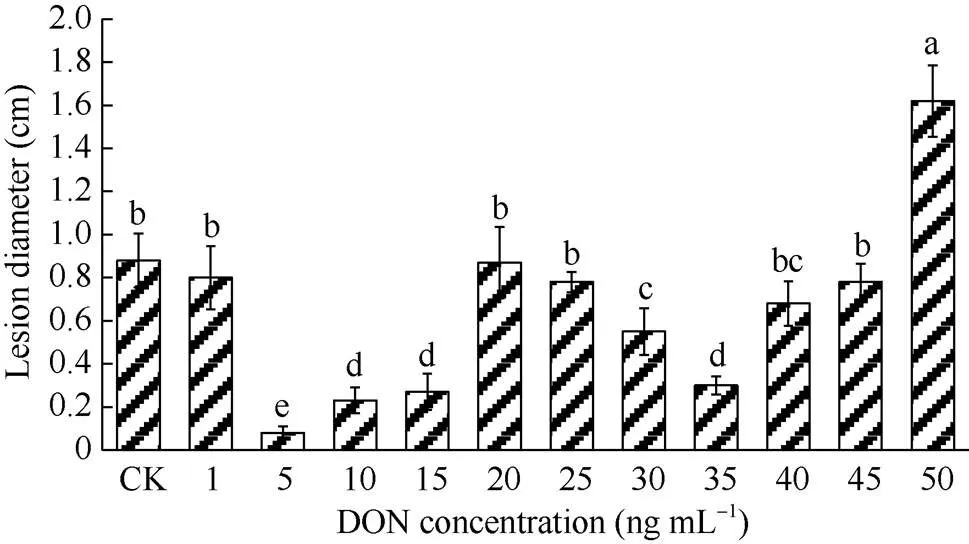
图1 不同浓度DON处理对马铃薯块茎接种接骨木镰刀菌病斑直径的影响
DON: 呕吐毒素。柱形图上不同小写字母表示差异显著(< 0.05)。
DON: vomitoxin. Different lowercase letters above the columns show significant difference (<0.05).

图2 DON处理6 h时接菌培养10 d后薯块内部形态变化
a~l分别代表无菌水、1 ng mL–1DON、5 ng mL–1DON、10 ng mL–1DON、15 ng mL–1DON、20 ng mL–1DON、25 ng mL–1DON、30 ng mL–1DON、35 ng mL–1DON、40 ng mL–1DON、45 ng mL–1DON、50 ng mL–1DON处理。DON: 呕吐毒素。
a–l represent sterile water, 1 ng mL–1DON, 5 ng mL–1DON, 10 ng mL–1DON, 15 ng mL–1DON, 20 ng mL–1DON, 25 ng mL–1DON, 30 ng mL–1DON, 35 ng mL–1DON, 40 ng mL–1DON, 45 ng mL–1DON, 50 ng mL–1DON, respectively. DON: vomitoxin.
2.2 DON作为激发子处理时间点的确定
采用5 ng mL-1DON对马铃薯块茎进行处理, 筛选激发子处理时间, 病斑直径变化见图3, 内部形态变化见图4。随着处理薯块时间的增加, 处理组的病斑直径呈先减小后增大再减小再增大的变化趋势, 对照组则呈先减小后趋于平稳的趋势。表明在采用DON处理薯块时, 不是处理时间越长, 产生的抗病性越强, 而是存在一个最佳的处理时间点。处理4 h时, DON处理组的薯块病斑直径显著低于对照组。说明用5 ng mL-1DON处理薯块4 h时, 诱导马铃薯块茎抗干腐病的效果最佳。

图3 DON处理不同时间对马铃薯块茎接种接骨木镰刀菌病斑大小的影响
DON: 呕吐毒素。柱形图上不同小写字母表示差异显著(< 0.05)。
DON: vomitoxin. Different lowercase letters above the columns show significant difference (< 0.05).

图4 无菌水与DON处理后接菌培养10 d后薯块内部形态变化
DON: 呕吐毒素。DON: vomitoxin.
2.3 DON激发子处理后马铃薯块茎抗氧化性指标的变化
处理组薯块中SOD活性相较于对照组明显提高, 随着处理时间的增加, 在整体上呈先升高后降低的趋势。对照组在整体上呈先降低后升高的变化趋势, 且在4 h时达到了最大值, 显著高于2 h时处理组(<0.01), 亦比对照薯块高出4.0倍(图5-A)。表明用5 ng mL-1DON处理薯块后, 薯块SOD的酶活性提高, 有利于马铃薯块茎广谱抗病能力增强。
处理组与对照组薯块的POD活性均呈先升高后降低的趋势, 且处理组在整体上高于对照组。处理组在初期迅速升高, 尤其是第4 h时, 2组马铃薯块茎中POD活性同时达到最高, 均显著高于处理2 h时POD的活性(<0.05)。此时, 处理组薯块中POD活性比对照组高1.4倍。在处理4 h后, 2组薯块中POD活性随时间呈下降趋势, 相对而言, 处理组下降较为缓慢(图5-B)。表明用5 ng mL-1DON处理薯块后, 薯块POD的酶活性提高, 有利于马铃薯块茎广谱抗病能力增强。
处理组薯块中没有发生MDA的大量积累, 各时间点有少量增减但不显著(>0.05)。对照组薯块中MDA含量在整体上高于处理组, 且在不同时间点MDA积累量变化波动较大, 呈先升高后降低再升高的变化趋势。对照组在2 h时, MDA的积累量达到峰值, 较处理组高4.7倍(图5-C)。表明用5 ng mL-1DON处理薯块后, 薯块MDA积累明显减少, 降低了薯块受损程度。
2.4 DON激发子处理后马铃薯块茎细胞壁防御酶变化
处理组薯块中的几丁质酶活性随着处理时间的延长呈先下降后上升的趋势, 在整体上高于对照组。处理组在2 h时出现显著降低(<0.01), 随后升高, 并在12 h时达到最大值。对照组的变化趋势则较为平稳, 且在4 h时达到最大值(图6-A)。表明用5 ng mL-1DON处理薯块后, 薯块内几丁质酶的活性升高, 增强了马铃薯抵抗病原真菌的能力。
处理组薯块内β-1,3-葡聚糖酶的活性整体上高于对照组, 2组整体上均呈先下降后上升的趋势。处理组在2 h时, 达到最低值, 随后呈现显著升高(<0.01), 基本恢复到了原有水平, 在6 h时达到最大值。对照组则整体呈下降趋势, 6 h后虽稍有上升但不显著(>0.05), 未能恢复至原来水平(图6-B)。表明5 ng mL-1DON能够诱导薯块内β-1,3-葡聚糖酶活性, 有利于马铃薯抵抗病原真菌。

图5 DON处理马铃薯块茎抗氧化性指标的变化
DON: 呕吐毒素; SOD: 超氧化物歧化酶; POD: 过氧化物酶; MDA: 丙二醛。*表示在0.05水平上显著; **表示在0.01水平上显著。
DON: vomitoxin; SOD: superoxide dismutase; POD: peroxidase; MDA: malondialdehyde.*: significantly different at< 0.05;**: significantly different at< 0.01.
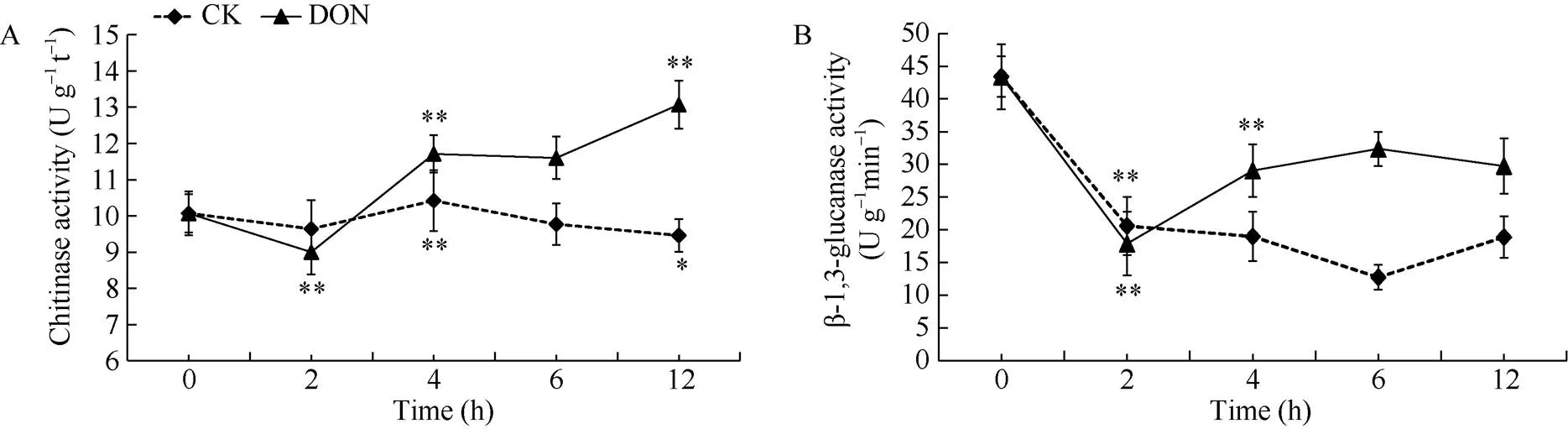
图6 DON处理马铃薯块茎细胞壁防御酶的变化
DON: 呕吐毒素。*表示在0.05水平上显著; **表示在0.01水平上显著。
DON: vomitoxin. *: significantly different at<0.05; **: significantly different at<0.01.
2.5 DON激发子处理后马铃薯块茎苯丙烷代谢关键酶及产物变化
处理组薯块中, PAL活性呈双峰型变化, 2个峰值分别出现于处理后的第2 h和第6 h, 分别高于同期对照31.1%和58.1%, 且整体上高于对照组。对照组只在2 h处出现一个小峰值(图7-A)。表明用5 ng mL-1DON处理薯块后, 薯块内PAL酶活性升高。
处理组薯块中, 4CL活性整体上高于对照组, 呈现先上升后下降的趋势, 且第4 h时达到最大值, 此时高于对照83.2%。对照组则呈整体显平缓下降趋势, 只在处理2 h时出现显著性(<0.05), 4 h后4CL活性基本保持不变(>0.05)(图7-B)。表明用5 ng mL-1DON处理薯块后, 薯块内4CL酶活性增加。
在12 h内, 处理组和对照组薯块总酚积累量很少, 但随处理时间增加, 总变化趋势较为平缓。处理组整体上高于对照组, 且呈先升高后降低的趋势, 在第4 d达到最大值。对照组呈上升后趋于平稳趋势, 在0~2 d期间总酚含量积累迅速(<0.01), 并在处理4 d时达到最大值, 但低于此时处理组的79.3% (图7-C, D)。表明用5 ng mL-1DON处理薯块后, 能够显著提高马铃薯块茎内总酚的积累。
在12 h内, 处理组薯块类黄酮含量变化并不明显(>0.05), 而对照组薯块中类黄酮含量减少。在0~8 d期间, 2组薯块中类黄酮的积累增加。处理组类整体上高于对照组, 在0~2 d期间类黄酮迅速积累(<0.01), 随后变化趋于平稳, 在第6天达到最大值, 高于此时对照的73.1%。对照组在0~4 d期间也出现了大量积累, 但不及处理组, 第4天后变化趋势也逐渐平稳(图7-E, F)。表明用5 ng mL-1DON处理薯块后, 能够促进类黄酮在马铃薯块茎中的积累。
在12 h内, 处理组和对照组花青素含量整体上都呈下降趋势, 处理组在6 h时稍有上升(<0.05), 但随后又呈下降趋势, 而对照组一直呈下降趋势。在0~8 d期间, 2组薯块花青素含量均有不同程度的增加, 且处理组整体上高于对照组。2组整体上均呈先上升后下降再上升趋势, 且均在4 d达到最大值, 处理组高于此时对照的63.2% (图7-G, H)。表明用5 ng mL-1DON处理薯块后, 能够促进花青素在马铃薯块茎中的积累。
在12 h内, 处理组和对照组薯块的木质素积累较少。在0~8 d期间, 处理组薯块积累量增多, 在整体上显著高于对照组(<0.05), 呈先上升后下降的趋势, 且在第4 d达到最大值, 高于同期对照组的64.5%。对照组的变化则不明显(>0.05)(图7-I, J)。表明用5 ng mL-1DON处理薯块后, 能够促进木质素在马铃薯块茎中的积累。
2.6 DON激发子处理后马铃薯块茎内源激素测定
处理组薯块SA含量表现出先上升后下降的变化趋势, 并且在4 h时达到最大值, 与对照相比高出71.23%。而对照组整体呈先下降后上升趋势, 在4 h时达到最小值, 在6 h时达到最大值(图8-A)。表明用5 ng mL-1DON处理薯块后, 能快速提高薯块内SA含量。
处理组薯块JA含量整体高于对照组, 呈为上升的趋势, 在12 h时达到最大值, 高于对照组31.9%。对照组整体上呈现先升后降再上升的变化趋势, 在2 h时出现最大值(图8-B)。表明用5 ng mL-1DON处理薯块后, 提高了马铃薯块茎中JA含量。
处理组薯块ET含量呈双峰型变化, 并在处理的第2 h和第6 h时出现峰值, 在第6 h时ET含量达到最大值。对照组呈增高态势, 在第12 h时积累量达到最大值, 此时高于处理组整体水平(图8-C)。表明5 ng mL-1DON处理可将马铃薯块茎内的ET含量稳定在一定范围内。
2.7 DON激发子处理后马铃薯块茎调控因子NPR1的表达分析
处理组和对照组的薯块内,基因相对表达量在整体上均表现为先升高后降低的趋势, 但处理组薯块相对表达量增加的更为显著(<0.05), 在2 h时表达量出现高峰值, 此时表达量为0 h的3.6倍且与其他时间点的表达量相比均具有显著性差异(<0.05)。而对照组在4 h时达到最高, 此时表达量为0 h的2.2倍(图9)。表明用5 ng mL-1DON处理马铃薯块茎,基因表达量上调。

图7 DON处理马铃薯块茎苯丙烷代谢关键酶活性及产物含量的变化
DON: 呕吐毒素。*表示在0.05水平上显著; **表示在0.01水平上显著。
DON: vomitoxin. *: significantly different at< 0.05; **: significantly different at< 0.01.

图8 DON处理马铃薯块茎内源激素含量的变化
DON: 呕吐毒素; SA: 水杨酸; JA: 茉莉酸; ET: 乙烯。*表示在0.05水平上显著; **表示在0.01水平显著。
DON: vomitoxin; SA: salicylic acid; JA: jasmonic acid; ET: ethylene.*: significantly different at< 0.05;**: significantly different at< 0.01.
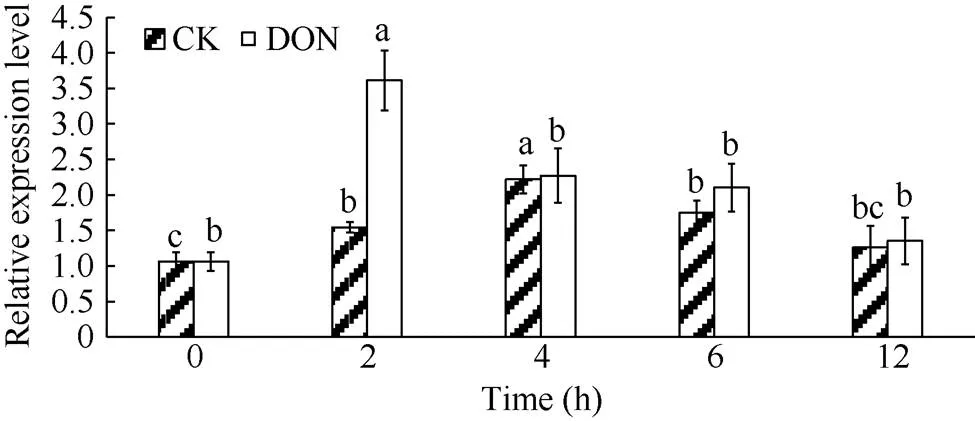
图9 DON处理马铃薯NPR1基因相对表达量变化
DON: 呕吐毒素。柱形图上不同小写字母表示差异显著(< 0.05)。
DON: vomitoxin. Different lowercase letters above the columns show significant difference (< 0.05).
3 讨论
3.1 低浓度DON作为马铃薯抗干腐病的激发子作用
真菌毒素是我们普遍认为的重要致病因子, 可以使植物表现出萎蔫、组织坏死等症状[25]。但有研究表明, 毒素在适当的浓度下, 可作为激活植物抗病机制的诱抗剂[26],Nishiuchi等[27]的研究证实了这点。本课题组在研究DON诱导马铃薯抗干腐病时发现, 5 ng mL-1DON处理4 h可以有效抑制致病菌在马铃薯块茎组织中的扩展, 且薯块内抗氧化酶、防御酶系活性和代谢产物含量显著升高, SA、JA和ET等内源信号分子含量的出现上调与基因表达量的升高。抗氧化酶和防御酶系活性的上升, 起到了清除细胞内活性氧[28]、水解破坏病原菌细胞壁、限制病程发展的作用[29]; 苯丙烷代谢途径的限速酶PAL和4CL活性提高可以有效地提高植物抗病性[30]。而系统抗病性的关键调控因子基因表达量的升高, 是植物产生抗病性的标志[31]。这表明低浓度DON处理已经诱导了马铃薯的抗病性, 发挥了激发子作用。但内源SA和JA都表现出上调趋势的调控机制还不清楚, 因此研究这2种激素在马铃薯抗病性诱导过程中的调控作用是下一步研究的重点。
3.2 呕吐毒素激发抗性与其他防治方法的效果对比及安全性分析
低浓度呕吐毒素作为激发子诱导马铃薯抗病能力, 启动的抗病相关途径直接增强了马铃薯本身的抗病性。Aver等[32]与Xue等[33]研究均表明, 毒素可以作为激发子诱导植物抗病性。而且该方法相较化学防治, 没有大量残留, 根本上提高了植物抗性; 相较生物防治, 见效快, 效果稳定; 相较人工综合防治见效快, 耗费低。安全性方面, 目前我国国标GB 2761–2011中规定了谷物及谷物制品中(包括玉米、玉米面、大麦、小麦、麦片和小麦粉) DON的限量标准为1 mg kg-1[34]。本试验中DON作为激发子的浓度为5 ng mL-1, 处于安全含量之内。表明采用低浓度的DON作为激发子对植物病害进行防治具有安全性。
[1] 罗其友, 刘洋, 高明杰, 易晓峰. 中国马铃薯产业现状与前景. 农业展望, 2015, 11(3): 35–40. Luo Q Y, Liu Y, Gao M J, Yi X F. Status quo and prospect of China’s potato industry., 2015, 11(3): 35–40 (in Chinese with English abstract).
[2] 陈彦云, 曹君迈, 陈晓军, 任晓月, 刘喜平, 丁红瑾. 我国马铃薯贮藏加工产业现状及其发展建议. 保鲜与加工, 2011, 11(6): 47–49. Chen Y Y, Cao J M , Chen X J, Ren X Y, Liu X P, Ding H J. Present situation analysis and development suggestions on potato storage and processing industry of China., 2011, 11(6): 47–49 (in Chinese with English abstract).
[3] 刁小琴, 关海宁, 魏雅冬, 马雪, 李杨, 郭丽, 马松艳.窖藏马铃薯干腐病病原菌的分离及绿色防治技术研究. 食品研究与开发, 2015, 36(1): 122–125. Diao X Q, Guan H N, Wei Y D, Ma X, Li Y, Guo L, Ma S Y. Study on isolation and green control technique of pathogens causing potato dry rot disease during storage., 2015, 36(1): 122–125 (in Chinese with English abstract).
[4] 敏凡祥, 王晓丹, 胡林双, 魏琪, 董学志, 李凤兰, 李鹤春, 刘伟婷, 郭梅. 黑龙江省马铃薯干腐病菌种类鉴定及致病性. 植物保护, 2010, 36(4): 112–115. Min F X, Wang X D, Hu L S, Wei Q, Dong X Z, Li F L, Li H C, Liu W T, Guo M. Identification of species and pathogenicity of theon potato in Heilongjiang province., 2010, 36(4): 112–115 (in Chinese with English abstract).
[5] 李梅, 田世龙, 程建新, 李守强, 葛霞, 张欣. 三种防腐剂对马铃薯薯块干腐病菌的毒力及抑制作用. 植物保护, 2013, 39(6): 188–192. Li M, Tian S L, Cheng J X, Li S Q, Ge X, Zhang X. Virulence and inhibition activity of three kinds of preservatives against the pathogen of the potato tuber dry rot., 2013, 39(6): 188–192(in Chinese with English abstract).
[6] 陈亚兰, 张健. 5种药剂对贮藏期马铃薯干腐病防效试验. 甘肃农业科技, 2016, (3): 42–44. Chen Y L, Zhang J. Experiments of 5 kinds of pesticides on potato dry rot during storage., 2016, (3): 42–44 (in Chinese).
[7] 侯忠艳. 马铃薯干腐病的发生与防治. 现代农业科技, 2012, (10): 173–179. Hou Z Y. Occurrence and control of potato dry rot., 2012, (10): 173–179 (in Chinese).
[8] Sadfi N, Chérif M, Fliss I, Boudabbous A, Antoun H. Evaluation of bacterial isolates from salty soils andstrains for the biocontrol of Fusarium dry rot of potato tubers., 2001, 83: 101–117.
[9] Jawed S, Mehmood A, Hussain A, Jatoi Z A, Kubar A A, Nizamani M M, Kaleri A A. Efficacy of different fungicides and bio control agents against, causal agent of potato dry rot., 2019, 12: 1–12.
[10] 侯玉玲. 抗病诱导剂在蔬菜病害防治中的应用. 吉林蔬菜, 2017, (1): 45–46. Hou Y L. Application of disease resistance inducer in vegetable disease control., 2017, (1): 45–46 (in Chinese).
[11] 李群. 钙依赖蛋白激酶和腺苷酸环化酶参与拟南芥响应大丽轮枝菌毒素诱导信号转导过程的实验证据. 中国农业大学博士学位论文, 北京, 2005. Li Q. Evidence for Involvment of Calcium-dependent Protein Kinase and Adenylyl Cyclase in Verticillium Toxin Induced Signal Transduction in. PhD Dissertation of China Agricultural University, Beijing, China, 2005 (in Chinese with English abstract).
[12] 赵小明, 杜昱光. 寡糖激发子及其诱导植物抗病性机理研究进展. 中国农业科技导报, 2006, 8(6): 26–32. Zhao X M, Du Y G. Progress of research on oligosaccharide elicitors and mechanism of plant induced resistance by oligosaccharides., 2006, 8(6): 26–32 (in Chinese with English abstract).
[13] Block A, Schmelz E A, O’Donnell P J, Jones J, Kiee H J. Systemic acquired tolerance to virulent bacterial pathogens in tomato., 2005, 138: 1481–1490.
[14] Dong X. SA, JA, ethylene and disease resistance in plants., 1998, 1: 316–323.
[15] 何苏琴, 金秀琳, 魏周全, 张廷义, 杜玺, 骆得功. 甘肃省定西地区马铃薯块茎干腐病病原真菌的分离鉴定. 云南农业大学学报, 2004, 19: 550–552. He S Q, Jin X L, Wei Z Q, Zhang T Y, Du X, Luo D G. Isolation and identification of pathogens causing dry rot of potato tuber in Dingxi prefecture of Gansu province., 2004, 19: 550–552 (in Chinese with English abstract).
[16] Bajestani B, Bastam V. Study on differentially lipase gene expression against different inducers of defense response in scab-resistant and susceptible wheat cultivars., 2012, 1: 6–14.
[17] 潘哲超, 陈建斌, 范静华, 周惠萍, 邱世刚, 叶漪, 果志华. 稻瘟菌粗毒素对水稻防御性相关酶系的诱导. 云南农业大学学报, 2008, 23(2): 28–32. Pan Z C, Chen J B, Fan J H, Zhou H P, Qiu S G, Ye Y, Guo Z H. Activities of defense–related enzymes induced by grude toxin from., 2008, 23(2): 28–32 (in Chinese with English abstract).
[18] 马春红, 翟彩霞, 商闯, 贾银锁. 低浓度玉米小斑病菌T小种和C小种毒素培养滤液对玉米C103叶片过氧化物酶活性的诱导作用. 见: 彭友良, 王振中主编. 中国植物病理学会2008年学术年会论文集. 北京: 中国农业科学技术出版社, 2008. pp 480–484. Ma C H, Zhai C X, Shang C, Jia Y S. The induced effects of filtrate of bipolaris maydis race C toxin and race T toxin cultivation on POD activities in maize leaves C103. In: Peng Y L, Wang Z Z, eds. Proceedings of the Annual Meeting of Chinese Society for Plant Pathology (2008). Beijing: China Agricultural Science and Technology Press, 2008. pp 480–484 (in Chinese).
[19] 张志良. 植物生理学实验指导. 北京: 高等教育出版社, 2003. pp 123–124, 268–268, 274–276. Zhang Z L. Plant Physiology Experiment Guide. Beijing: Higher Education Press, 2003. pp 123–124, 268–268, 274–276 (in Chinese).
[20] 上海市植物生理学会. 现代植物生理学实验指南. 上海: 上海科学技术出版社, 1999. pp 129–130. Shanghai Plant Physiology Association. Handbook of Plant Physiology Experiment. Shanghai: Shanghai Scientific and Technical Publishers, 1999. pp 129–130 (in Chinese).
[21] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导. 北京: 中国轻工业出版社, 2007. pp 44–45, 142–143. Cao J K, Jiang W B, Zhao Y M. Guidance on Post-harvest Physiological and Biochemical Experiments of Fruits and Vegetables. Beijing: China Light Industry Press, 2007. pp 44–45, 142–143 (in Chinese).
[22] 杨志敏, 毕阳, 李永才, 寇宗红, 包改红, 刘成琨, 王毅, 王蒂. 马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化. 中国农业科学, 2012, 45: 127–134. Yang Z M, Bi Y, Li Y C, Kou Z H, Bao G H, Liu C K, Wang Y, Wang D. Changes of cell wall degrading enzymes in potato tuber tissue slices infected by., 2012, 45: 127–134 (in Chinese with English abstract).
[23] 刘玉良, 米福贵, 特木尔布和, 王普昶, 马小廷. 苜蓿叶片水杨酸含量与其蓟马抗性的关系. 西北植物学报, 2011, 31: 588–594. Liu Y L, Mi F G, Temu’erbuhe, Wang P C, Ma X T. Relationship between alfalfa salicylic acid content and Its thrips resistance.-, 2011, 31: 588–594 (in Chinese with English abstract).
[24] 侯志强, 王庆国. 鲜切马铃薯实时荧光定量PCR分析中内参基因的选择. 安徽农业科学, 2013, 41: 5207–5209. Hou Z Q, Wang Q G. Reference genes selection for real-time fluorescence quantitative PCR in fresh-cut potato., 2013, 41: 5207–5209 (in Chinese with English abstract).
[25] Lazarovits G, Higgins V J. Biological activity and specificity of a toxin produced by., 1979, 69: 1056–1061.
[26] 王桥美, 范静华, 果志华, 陈建斌. 烟草黑胫病菌毒素对烟草防御性相关酶的诱导作用. 云南农业大学学报, 2011, 26: 20–25. Wang Q M, Fan J H, Guo Z H, Chen J B. Induction effect of toxin extracts ofon tobacco defense- related enzyme activities., 2011, 26: 20–25 (in Chinese with English abstract).
[27] Nishiuchi T, Masuda D, Nakashita H, Ichimura K, Shinozaki K, Yoshida S, Kimura M, Yamaguchi I, Yamaguchi K.phytotoxin trichothecenes have an elicitor-like activity in, but the activity differed significantly among their molecular species., 2006, 19: 512–520.
[28] Bhattacharjee S. Reactive oxygen species and oxidative burst: roles in stress, senescence and signal transduction in plants., 2005, 89: 1113–1121.
[29] 史娟, 李建设. 枯萎病菌诱导的几丁质酶和β-1,3-葡聚糖酶与寄主抗病性的关系. 农业科学研究, 2006, 27(3): 24–26. Shi J, Li J S. Relationship between chitinase and β-1,3-glacanase activity induced byon resistance of cucumber to Fusarium Wilt., 2006, 27(3): 24–26 (in Chinese with English abstract).
[30] 邓惠文, 毕阳, 葛永红, 任亚琳, 刘瑶瑶. 采后BTH处理及粉红单端孢()挑战接种对厚皮甜瓜果实苯丙烷代谢活性的诱导. 食品工业科技, 2013, 34(1): 323–326. Deng H W, Bi Y, Ge Y H, Ren Y L, Liu Y Y. Induction of phenylpropanoid metabolic activity in muskmelon fruit by postharvest BTH treatment and challenge inoculation with., 2013, 34(1): 323–326 (in Chinese with English abstract).
[31] 宋阳, 王丕武, 张学明, 曲静. 植物广谱抗病基因的研究进展. 农业与技术, 2013, 33(6): 5–7. Song Y, Wang P W, Zhang X M, Qu J. Research progress on plant broad-spectrum disease resistance gene., 2013, 33(6): 5–7 (in Chinese).
[32] Aver’yanov A A, Lapikova V P, Lebrun M H. Tenuazonic acid, toxin of rice blast fungus, induces disease resistance and reactive oxygen production in plants., 2007, 54: 749–754.
[33] Xue H, Bi Y, Prusky D, Raza H, Zhang R, Zhang S, Nan M, Zong Y Y, Cheng X Y. The mechanism of induced resistance againstdry rot in potato tubers by the T-2 toxin., 2019, 153: 69–78.
[34] 中华人民共和国卫生部. GB/T 2761-2017食品安全国家标准食品中真菌毒素限量. 北京: 中国标准出版社, 2017. pp 1–3.The Minister of Health of the People’s Republic of China. GB/T 2761-2017 National Food Safety Standard Food Mycotoxins Limits. Beijing: Standards Press of China, 2017. pp 1–3 (in Chinese).
Low concentration of vomitoxin as elicitor induced resistance of dry rot disease of potato and its mechanism
ZHAO Xiao-Can1, XU Yong-Qing1, HE Fu-Meng1, SUN Mei-Li1, YUAN Qiang1, WANG Xue1, KONG De-Xing1, LIU Dan1, FENG Yan-Zhong2, CHEN He-Shu2, TIAN Ming2, LIU Di2, and LI Feng-Lan1,*
1College of Life Science, Northeast Agricultural University, Harbin 150030, Heilongjiang, China;2Heilongjiang Academy of Agricultural Sciences, Harbin 150086, Heilongjiang, China
Dry rot disease is a fungal disease caused byspinfection in the process of potato cellar storage, which seriously affects the commercial value. Vomitoxin (DON), also known as deoxynivalenol, is a secondary metabolite produced bysp. in the process of infecting potato lump. Biological control is an effective method of disease control. Using biological factors as elicitors to induce plant system produce disease resistance has become a hot research topic. In this study, in order to provide theoretical basis for biological control of dry rot disease, potato tubers were treated with low concentration of DON as elicitor to determine its role in the resistance to dry rot disease and the mechanism of inducing systemic acquired resistance (SAR) of potato. DON treatment had a certain effect on the development of dry rot disease, and affected by the concentration. The treatment of potato tubers with 5 ng mL-1DON for four hours could effectively reduce the diameter expansion of dry rot disease lesions induced by. Low concentration of DON increased the activities of SOD, POD, chitinase and β-1, 3-glucanase in tuber tissue, and decreased the accumulation of MDA. DON treatment increased the activities of PAL and 4CL, the key enzymes of phenylpropane metabolism, and promoted the accumulation of total phenols, flavonoids, lignin and anthocyanins. Meanwhile, the content of endogenous signal molecules SA, JA, and ET in potato tubers could be increased by using DON as elicitor, and the expression of(regulatory gene of plant systemic resistance) was increased.
potato; dry rot disease;sp; vomitoxin; elicitor; induced resistance
10.3724/SP.J.1006.2020.04049
本研究由国家自然科学基金青年项目(31201470), 国家自然科学基金项目(J1210069)和哈尔滨市应用科技研究与开发项目(2015RAQXJ021)资助。
This study was supported by the Youth Program of National Natural Science Foundation of China (31201470), the National Natural Science Foundation of China (J1210069), and the Harbin Applied Science and Technology Research and Development Project (2015RAQXJ021).
李凤兰, E-mail: lflan715@163.com
E-mail: ZXC1656068953@163.com
2020-02-28;
2020-07-17.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20200716.1740.006.html
