良好实验室规范下生态毒理测试SOP的日程设计与合规化管理
2020-09-21汪丹姚洪伟周芳丽
汪丹,姚洪伟,周芳丽
1. 上海化工院检测有限公司,上海 200062 2. 上海化工研究院有限公司,上海 200062
经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)良好实验室规范(Good Laboratory Practice, GLP)原则中对GLP的定义为:“GLP是一种有关非临床人类健康和环境安全试验的设计、实施、查验、记录、报告及归档等组织过程和条件的质量体系”。其中,“设计”是GLP实验的前提和关键环节,任何GLP研究都必须在研究启动之前具备周详和可操作的计划,也就是研究计划书。所以,研究计划作为控制生态毒理研究实施的书面文件,无论从逻辑性还是科学性来说,重要性不言而喻。
在OECD GLP法规中,将研究计划定义为:“规定研究实施的目的和试验设计,以及其修订内容的书面文件”。因此,研究计划必须满足2个要点,一是内容必须清楚,二是必须为最新正式版。从内容上来说,计划书需要符合5W1H原则(who(谁去做),why(为什么),when(何时做),where(何地做),what(做什么),how(怎么做)),具体为人员职责、测试场所、测试时间、测试对象、操作内容和实施方式。从管理上来说,最为重要的就是控制所有参与操作的人员都能获取最新版的正式计划书。这才能确保试验人员能够了解试验内容,提前准备和安排生物、材料和仪器等,确保在试验开始时试验体系和设备等处于良好状态。
在生态毒理研究中,每个研究都可能是由多个不同活动组成的复杂过程,研究周期短则几个小时,长至几年不等,整个过程需要多个操作人员和技术人员共同配合。因此,为了确保研究实施有序合理、人员配合默契以及资源使用高效,尤其对于那些时间周期长、牵涉操作复杂的研究,计划书的设计就成为研究成功与否的关键要素,而其中最为关键的要素就是时间的安排和规划。
在实际工作中,GLP测试机构在计划书中的时间安排和日程管理方面,存在很多疑惑,有时难以在合规性和实践性中间找到平衡点,比如,如何定义第一次采集数据的活动和最后一次采集数据的日期?如果实际日期与预计日期不一致时,是否要进行修订或者开展偏离流程?试验起始日期是否应该与研究启动和结束日期存在逻辑关联性?
所以,试验机构希望能够建立一种机制来合理地定义和设计计划书中的试验日程,使其即能满足GLP法规和监管机构要求,同时也能灵活应对试验操作中的随时可能发生的不确定性情况。因此,结合生态毒理研究的实际工作流程,从法规规定、检查要求、研究属性和科学管理等几个方面出发,对该问题进行探讨。
1 GLP法规对计划时间的管理要求(Proposed date requirements of the GLP regulations)
在OECD、美国食品药品监督管理局(United States Food and Drug Administration, US FDA)、美国环境保护局(United States Environmental Protection Agency, US EPA),日本厚生省等发布的GLP法规中,以及瑞士的GLP法令(Ordinance on Good Laboratory Practice, OGLP)和欧盟的GLP法规中,均有对计划书中试验时间点的定义和规定,部分监管机构也发布了指南进一步对计划书时间点的要求进行解释,这都为检测机构在实际管理中提供了指导和参考。
1.1 OECD GLP法规中的规定
OECD GLP法规[1]规定计划书中至少应该包括研究启动时间(项目负责人批准计划书的签名日期)、预计的试验开始时间和预计的试验完成时间,在研究报告中应该包括试验开始和试验完成日期。
OECD GLP法规给出了以下4个时间点的定义:(1)研究启动时间:项目负责人签署计划书的日期;(2)试验开始时间:第一次采集研究相关数据的日期;(3)试验完成时间:最后一次采集研究相关数据的日期;(4)研究完成时间:是指项目负责人签署最终报告的日期。
其中,研究开始和研究完成日期定义很容易理解,并已经在业内形成共识。但是对于预计试验开始时间和预计试验完成时间的定义却比较宽泛,也曾引起行业内的广泛讨论。
1.2 US FDA的GLP法规中的规定
美国共有3部GLP法规,分别是US FDA管理的《非临床研究的良好实验室规范》(21 CFR Part 58)(简称FDA GLP法规),US EPA管理的《联邦杀虫剂、杀真菌剂和灭鼠剂条例》(FIFRA)的GLP法规(40CFR 160 GLP)(简称FIFRA GLP)和《有毒物质控制法》(TSCA)的GLP法规(40 CFR 792)(简称TSCA GLP),FIFRA GLP与TSCA GLP法规内容基本一致。
FDA GLP法规在非临床研究的良好实验室管理方面具有很高的权威性,自1979年开始实施,适用范围为食品、色素添加剂、动物用药、人用药、生物产品、人类医用设备、诊断制剂及电子产品和动物食品添加剂等。
1978年版的FDA GLP法规(§58.120(a)(4))[2]规定:“计划书中需要列明试验预计开始和结束日期”。但是实际上,由于不同测试领域的机构对该条款的理解不同,最后实际的做法相去甚远,所以,US FDA在1981年发行的《GLP问题与回复指南》[3]中特别对该规定进行了解释,首先,US FDA明确说明项目负责人(SD)在编制计划书时,应该在计划书中给出包括预计试验起始日期在内的日程,而这个试验预计起始日期的设置允许一定的灵活性。其后,US FDA结合实际为测试机构提供了具有参考价值的做法,具体如下:将预计的试验起始时间分别设置为第一次施药日期和最后一次施药的日期,或是试验体系开始分配到研究的日期和解剖最后一只动物的日期,或是接受试验体系的日期到最终病理学诊断的日期。
但是,US FDA在1984年发布的GLP法规修订版[4]中,提议删掉上述§58.120(a)(4)条款,理由是根据§58.120(b)条款(已批准的计划书发生的任何修改或者修订,必须说明理由,经SD批准签字和签署日期后与原计划书一同保管),计划书批准后试验日期发生改动时,项目负责人必须对研究计划进行修订。但是从另外一个角度来说,US FDA认为测试机构在试验日程设计和安排方面具有自主决定权。所以为了避免因日程变化而修订计划书的情况,US FDA提议删掉§58.120(a)(4)条款。随后,在1987年发布的FDA GLP法规最终修订版[5]中,原§58.120(a)(4)规定被删除(表1)。自此,US FDA不再要求计划书中必须包含预计的试验开始和试验结束日期。自该版本后,后续所有US FDA发行的GLP法规都不再对计划书的预计试验起始时间有强制规定。
同时,在与FDA GLP法规一脉相承的日本厚生省颁布的《药物非临床良好实验室管理法规》中,也没有对计划书的试验开始和试验结束日期有任何规定。
1.3 US EPA的GLP法规中的规定
US EPA起草GLP法规时内容基本引自US FDA,但是随着双方对法规的几次修订,现行的EPA GLP法规与FDA GLP法规存在几点不同,比如在计划书时间的管理上,US EPA没有采纳US FDA的管理理念。
因为US EPA同时监管TSCA GLP和FIFRA GLP,2个法规内容基本一致,所以下文以FIFRA GLP(40CFR 160)为代表进行阐述。
在FIFRA GLP(§160.3)[6]中,给出了试验开始和试验结束日期的定义:(1)试验开始日期:试验样品添加到试验体系的第一个日期;(2)试验结束日期:从研究中直接收集数据的最后一个日期。
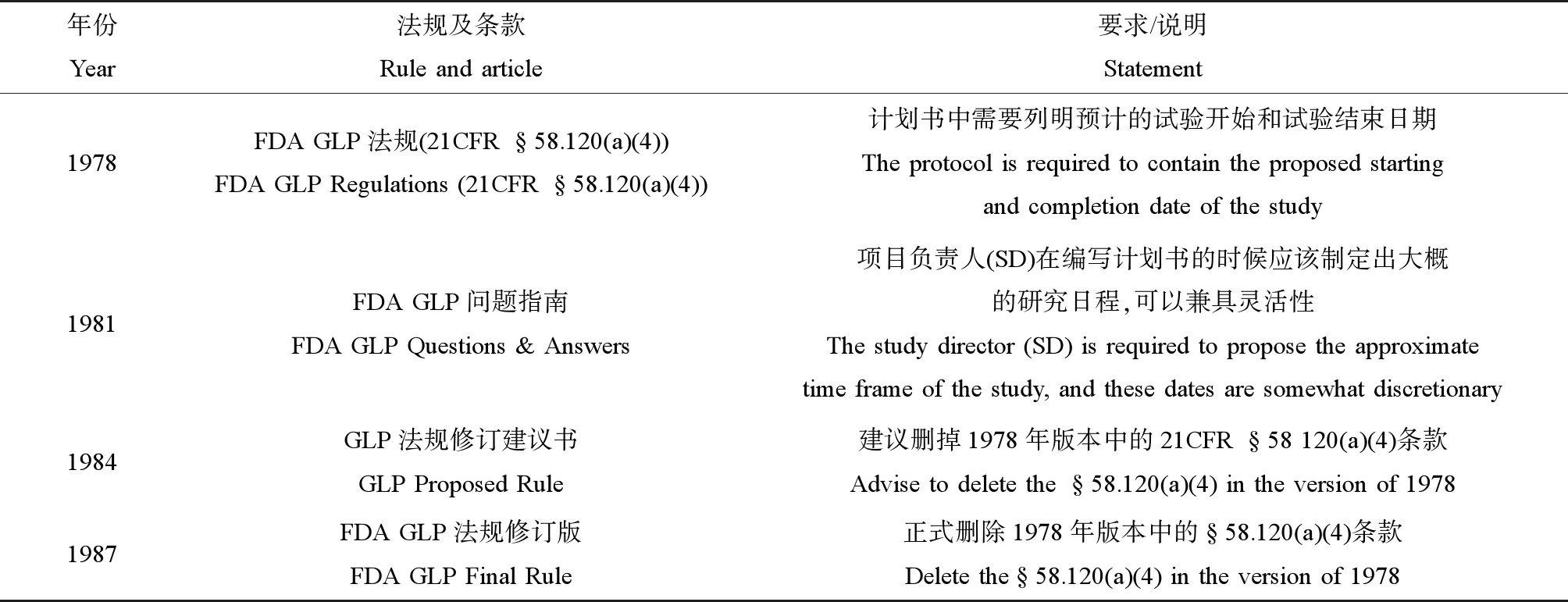
表1 美国食品药品监督管理局(US FDA)对计划书中试验开始和试验结束日期的历史规定Table 1 The United States Food and Drug Administration (US FDA) historical rules about the proposed experiment beginning date and finishing date in protocol
40CFR(§160.120(4))中规定:“计划书中应该包括预计的试验开始和试验结束日期”。
FIFRA GLP法规与FDA GLP在计划书修改方面的规定是相同的,也就是“批准后的计划书的任何修改或者修订需要说明理由,并且经SD签字和注明日期,与计划书一同保管”,所以,对于需要符合EPA GLP法规的研究来说,计划书发生的任何修改,比如时间修改等,都需要进行研究计划修订的流程。
1.4 瑞士法规中的规定与解释
瑞士实施的GLP法规是OGLP法令,该法令从2000年3月1日开始实施,作为欧盟国家和OECD成员国,瑞士的OGLP法规与OECD GLP法规和符合性监管内容基本相同,包括对试验起始日期的定义和计划书修订的规定。
在瑞士官方发布的GLP法规解释说明文件[7]中,对如何定义试验开始和结束的日期给出了具体的解释。根据瑞士OGLP法规,试验开始和结束的日期应该是收集研究相关数据的开始和结束日期。如果在试验之前有所谓的预实验,比如采集研究的基线值,那么试验开始日期应该是预实验的开始日期。因为这2个日期的定义很宽泛,所以在制定计划书时最好进行解释和说明,建议可以采用以下2种做法:(1)在每个研究的标准操作规程(SOP)中,描述试验开始/结束日期对应的具体操作或活动。(2)研究计划中给出预计的试验开始日期和完成日期,同时说明该日期对应的具体操作。
1.5 德国联邦风险评估研究所(Bundesinstitut für Risikobewertung, BFR) GLP检查手册中的规定
作为欧盟国家和OECD成员国,德国GLP法规也是基于OECD的GLP法规,要求计划书中需要列出预计的试验开始日期和预计的试验结束日期。
在德国GLP检查手册[8]2.8.4.8条中明确规定,在进行研究审计时,要核对研究计划、原始数据和最终报告的一致性,其中明确说明:“比较研究计划、原始数据和最终报告之间试验开始日期和完成日期的一致性”,由此可以了解到,德国检查官会在GLP监管检查中,核查这些时间点是否一致。
1.6 日本环境省(MOE)GLP法规中的规定
虽然,日本厚生省发布的GLP法规不要求计划书提供试验起始日期,但是日本环境省的化学品GLP法规[9]中的规定保持与OECD GLP中的规定一致,也就是要求在计划书中给出试验起始日期,定义与OECD的规范相同。而为了帮助机构理解,日本环境省发布的测试机构自查手册[10]给出了部分生态毒理测试的建议试验开始日期和试验结束日期(表2)。将上文所述的所有GLP法规中对研究计划中时间点的规定和要求总结于表3中。

表2 日本在化学品测试机构自查手册中的建议[10]Table 2 Recommendations in the Japan’s self-inspection manual for chemical testing organizations[10]
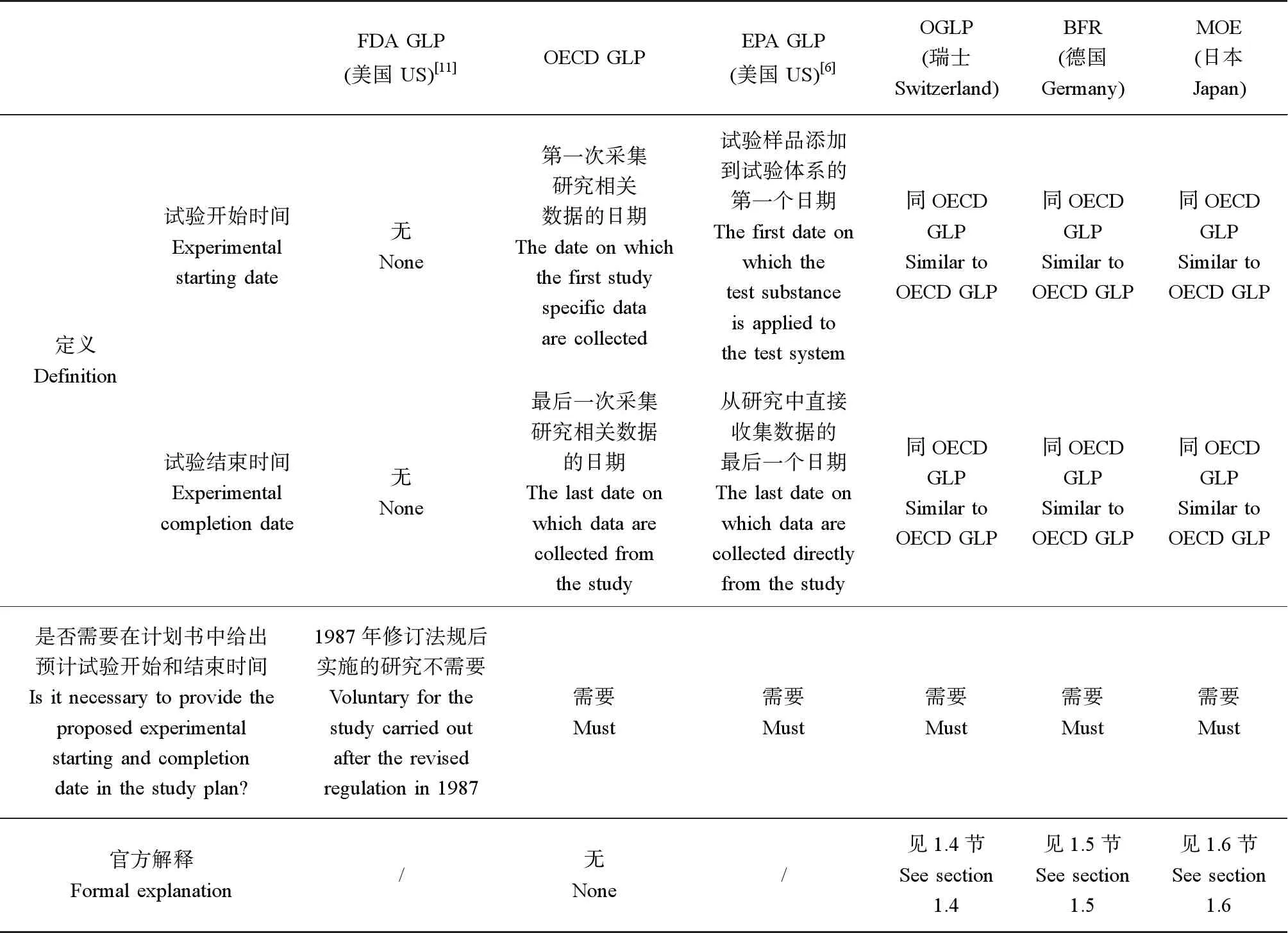
表3 各GLP法规中对研究计划中时间点的规定和要求Table 3 Rules and requirements of each GLP regulation on protocol time points
2 GLP法规中时间定义的解读与讨论(Interpretation and discussion of date definition in GLP)
从上述的GLP法规和其解释文件中了解到,不同国家和组织对于这2个时间点的设计和规定是不相同的,这表明,不同监管机构对这些时间点的定义也有着不同的意见,但是无论如何,遵从OECD GLP规范的测试机构还是需要在试验计划书中给出这些时间点。
在进行时间点的设计时,不管出于任何目的,都不建议将法规的定义生搬硬套使用。对于那些会开展多种类型、多种试验体系的GLP机构来说,千万不要采用“一刀切”的方式,试图为不同类型的研究设计出一种通行的、万能的定义,因为那些看起来“一劳永逸”的定义,反而会给试验人员在实操中带来困惑和不解,以及后期面对质量保证(QA)人员和GLP检察员询问时需不断解释和说明。
从GLP规范给出的定义可以看出,时间安排的核心点有2点:其一是识别“活动”,其二是定义“开始”与“结束”。
对于前者,“活动”应该是“与研究有关的”相对应的,那么何种活动是“与研究有关的”呢?比如,动物到达机构时进行健康检查,设备校准与计量,驯养期的生物环境参数测量以及培养基溶液配制,这些是否与研究相关?从广义的角度来说,这些数据都是与研究有关的,但是这些明显不适合用于做为具体研究活动的代表或者标识。
比如,以鱼类的毒性研究为例,如果将鱼类驯养作为“与研究有关的”活动,那么意味着计划书中的试验开始日期就是受试鱼引进的日期,但是事实上,受试鱼在用于试验之前,将经历适应期(至少7 d)、驯养期(至少14 d),以及敏感性测试,所以基本上所有的受试鱼在用于试验前都已经在实验室生活了至少2个月时间,之后才能用于测试。而对于鱼类试验来说,一般不会提前2个月启动研究计划,因此,如果“研究启动日期”晚于“试验开始日期”,时间逻辑上来说不够合理。另外,通常受试鱼都是大批量地驯养在实验室,供应于一定周期内(比如1 a)的所有鱼类研究,也就是说,同一批次的受试鱼将用于多个研究,所以鱼的驯养仅属于“与研究有关的”通用性活动,而非“与具体研究有关的”指代性活动。同时在鱼的驯养期间,所有相关的活动,比如运输、引进、适应和驯养,都详细记录在生物档案中,并通过设施检查进行核查。因此,从时间逻辑和质量保证角度来说,采用生物驯养作为“研究有关活动”的标志是不科学的。
对于第2个关键点“开始”与“结束”的定义,需要符合时间逻辑顺序,OECD GLP法规没有给出4个时间点之间的逻辑性。根据GLP法规中的要求“在研究启动之前应该有书面研究计划”可知,研究启动也就是SD签署计划书时肯定有了书面计划书。虽然,GLP法规中没有规定试验开始日期必须在研究启动日期之后,也就是没有规定相关数据的收集必须在研究启动之后才能进行;但是,从常识上来说,正常的流程应该是先有计划书,然后开展研究活动,这样才能确保研究有序执行;所以从这种逻辑上来推断,研究计划中的试验预计开始日期应该在研究启动之后。[12]
3 生态毒理GLP研究活动的属性(Activities categorization and property in ecotoxicology GLP study)
研究计划工作中最为困难的任务之一就是日程和进度安排,项目负责人要把可用的资源、人员和活动工作量协调好,考虑好各项活动之间的相互依赖关系,预见可能出现的问题或者不可预期的活动时间,然后制定出计划日程。为了清楚地说明GLP研究中相关活动的关键性和在研究中所起的作用,根据活动产出结果的作用来划分活动的属性,简单地将活动分为生产活动、支持活动和管理活动[13],具体定义如下。
生产活动:如果该活动能够得到可量化的实体结果,那么该过程就称为生产活动;支持活动:如果该活动能够为生产活动提供必要的无形实体支持,那么该活动称为支持活动;管理活动:为机构管理运行提供支持的活动称为管理活动。图1给出了3种活动之间的关系,并给出了一些简单的活动任务内容。
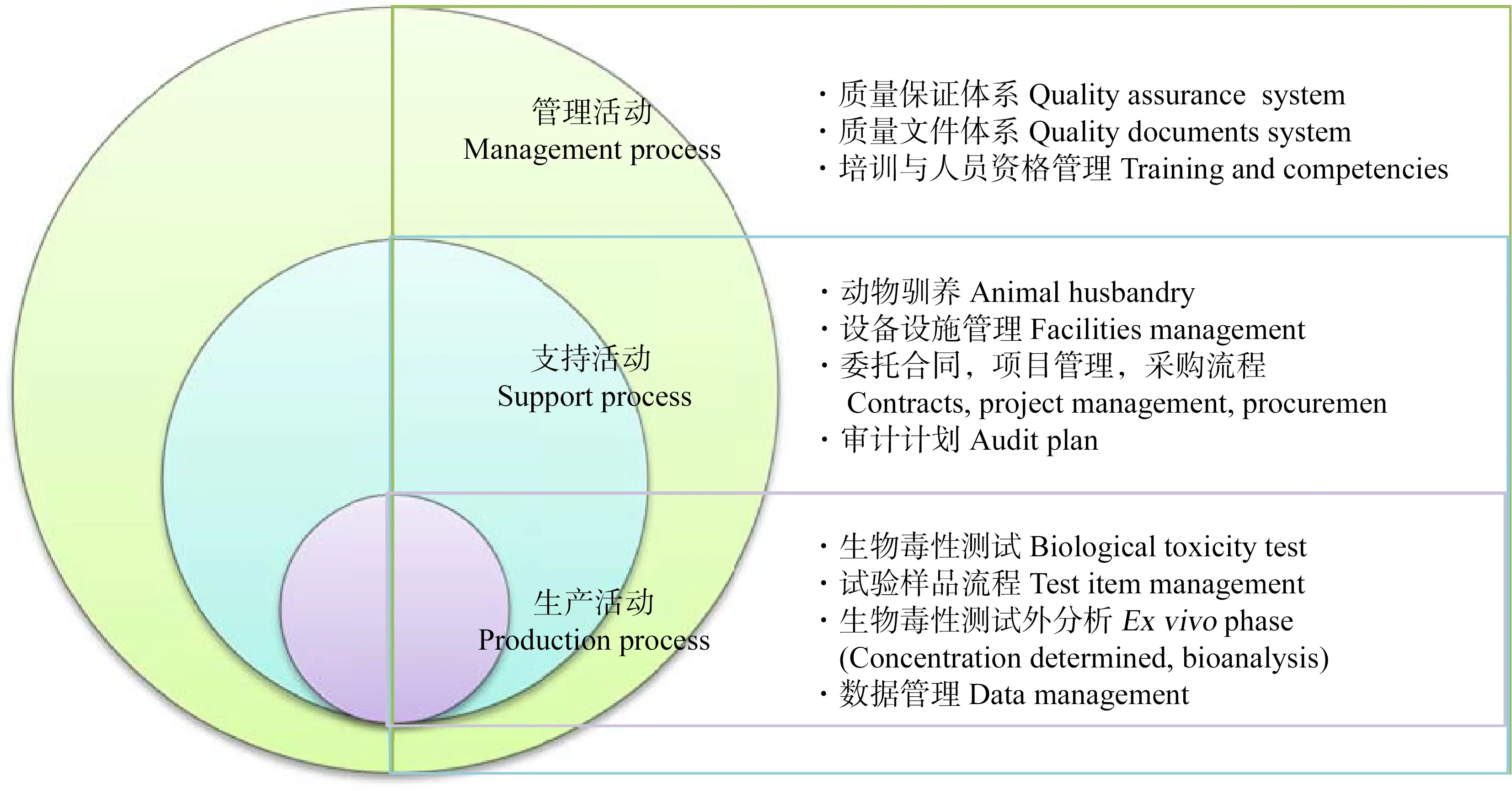
图1 GLP研究的活动属性图示Fig. 1 Activity categorization illustration in GLP study
为了进一步阐述不同活动在研究中受关注的程度以及研究中各个环节的属性,以常规的生态毒理研究流程为例,结合质量保证部门所实施检查活动的性质,对各个相关的活动进行归类(表4)。
如上所述,生产活动作为产生最终数据和结果的过程,与管理活动和支持性活动共同组成了完整的研究,从研究实施的角度看,生产活动的失败或者失误会直接导致数据缺失或者结果错误,从而直接影响研究结果和结论。而可能导致生产活动失败的重要原因之一就在于研究计划的日程不合理,比如,对活动任务完成周期的错误估计,对不同活动关联影响缺乏前瞻性,日程变化时通知试验人员存在滞后性等。
但是,要注意的是数据处理和分析这类生产活动,对于大多数研究来说,数据统计、处理和分析产生的数据属于二次数据,它发生的时间是在所有实验数据已经采集之后,相对于其他生产活动,它的发生比较独立。更为重要的是,因为整个统计和分析的过程易于采用直接方法重现和复核。所以数据处理和分析时间安排比较灵活和宽松,相关人员在时间安排上拥有较大的自主权。所以,为了确保研究计划时间安排能够对研究实施进行有效控制,不建议采用统计分析时间作为试验完成日期的节点。
4 生态毒理GLP研究日程安排要点(Key point of planning schedule for ecotoxicology GLP study filed)
对于不同类型生态毒理GLP研究,生物毒性试验、试验样品处理和生物毒性测试生产活动的顺序是不同的。
比如,对于按照OECD化学品测试方法301开展的快速生物降解试验,试验顺序为:配制施用形式的样品—试验样品开始暴露(活性污泥接种物体系)—试验期间数据记录—试验样品停止暴露(活性污泥接种物体系)—试验结束—数据处理,按照活动属性来说,对应的活动应该是:试验样品流程—生物毒性测试—数据管理(图2)。
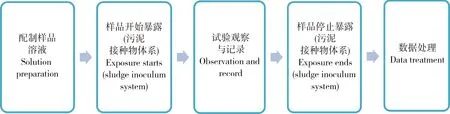
图2 快速生物降解试验的生产活动顺序Fig. 2 Sequence of the production processes in ready biodegradation test
对于藻类生长抑制试验来说,活动的顺序是:定量分析方法验证—配制样品溶液—样品与生物体系作用—试验过程—停止样品与生物体系作用—症状观察—试验溶液浓度分析,也就是生物毒性测试外分析—试验样品流程—生物毒性测试—生物毒性测试外分析(图3)。
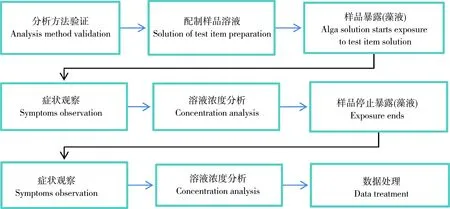
图3 藻类生长抑制试验的生产活动顺序Fig. 3 Sequence of the production processes in alga growth inhibition test
大多数情况下,生态毒理类研究启动时的活动节点是样品流程或者是生物毒性测试外分析(例如化学分析),而试验完成对应的活动节点是生物毒性测试或者是生物毒性测试外分析(可能是病理分析,也可能是化学分析)。

表4 生态毒理GLP研究过程活动属性分类及对应的质量保证活动Table 4 Categorization and property of processes in ecotoxicology GLP study and quality assurance actions
如果没有生物毒性前/后分析(比如化学分析)的情况,可以将试验开始日期定义为样品配制日期,或者是样品开始暴露的日期,试验完成日期可以设置为生物体系与样品结束相互作用的日期。
对于有生物毒性测试外分析的情况,可以采用多场所试验管理或者研究专题管理的方式进行处理。
(1)多场所试验管理
将定量分析试验部分作为多场所研究的试验阶段管理,其分析负责人作为该阶段的负责人。主研究计划中的试验开始日期定为配制样品的日期,试验完成日期定义为最终症状观察的日期或者结束暴露的日期,主研究计划中的阶段研究计划将开始定量分析方法验证与溶液分析结束的日期作为试验阶段开始和结束的日期。
(2)研究专题管理
将定量分析方法验证的开始日期作为试验开始日期,将浓度分析结束的日期作为试验结束日期,因为定量分析方法的日期可能受到仪器状态、仪器安排等非预期因素的影响,所以时间安排上可以设置为时间段(比如2~3 d),时间段必须合理,不能过于宽泛。
5 研究实施中计划时间变化的处理(Handling the time change during implementation)
对于批准后的计划书中时间发生变化的情况,有些机构认为时间上的变化属于管理性的内容,无需进行修订或者开展偏离流程,但是这可能违反GLP法规的规定。OECD GLP[1]规范中规定:“研究计划的修订是指试验项目启动以后对试验计划进行的有意修改。研究计划中的修订需要有明确的理由,并经过项目负责人的同意,签名并注明日期,与计划书一同保存”。在OECD GLP NO.3文件“GLP管理机构准则试验机构检查与试验项目核查实施指南”[14]中的试验的实施中规定,试验计划书的任何修改由项目负责人签字并注明日期。
所以,如果计划书中规定了预计的时间,那么该内容就属于计划书的一部分,相关的改动就应该属于研究计划修订,需要说明理由,获得SD的批准,并且与原研究计划一同保存。
从计划角度,计划书中时间安排的目的是协调各个试验人员之间的配合,确保各方能在试验前提前做好准备,所以当预计时间安排发生变化时,应该通过一种合理和有效的方式及时告知相关人员,而研究计划的修订流程就是一种比较有效和合规的流程,并且确保试验人员能够获得最终版的计划书及其修改。
虽然,GLP法规接受对计划书进行修订,但是过于频繁的修订可能会让监管机构怀疑测试机构在项目管理能力上存在不足,从而使研究陷于风险度较高的境地,引起监管部门对研究可靠性和可信性产生质疑。
因此,如果计划书中试验起始日期的活动定义为随机性较强的活动,比如生物称重、设备开机和称量等,那么实际操作中,这一类的活动的发生比较灵活,所以如果以这类活动为试验起始日期的节点,那么就比较容易产生因为时间修改导致的计划偏离。
如果既想避免不断修订计划书带来的工作量,以及忘记修订导致的计划偏离,又想确保试验人员和QA人员及时跟进最新计划履行工作,那么首先应该按照GLP的规定,在计划书中给出预计的试验开始和结束日期以及对应的活动内容,对于这些出现在最终计划书中的活动应该是易于理解和界定的,并且是较为固定的活动。其次,建立独立文件或记录作为日程安排表,即方便实验人员参照实验进度表执行试验计划,且防止操作遗漏,但是,在使用独立的日程安排表时,需要在项目负责人、试验人员和质量保证人员之间建立合理的沟通机制,确保相关人员能及时了解日程的安排和变化。
独立的日程表上一般会包括生物称量和分组、施药日期、溶液更换日期、症状观察日期、环境参数测定日期、采样日期和化学分析日期等,同时还应该包括计划实施的日期、实际实施的日期和试验人员等信息。在设计日程表时,需要获得所有可能会参加该研究的试验人员的同意。比如,在设计水生试验样品定量分析日程时,关于采样时间、分析样本转交时间和分析时间等,项目负责人需要先与分析人员和试验人员进行沟通和协商。
6 总结与讨论(Discussion and conclusion)
在GLP实验室中,研究计划的日程设计非常关键,不仅涉及到数据采集、设备调配、场地安排、人员分配和QA检查等多个方面,也会从侧面反映实验室管理能力和技术实力。虽然,在US FDA的法规中,已经不再需要对试验开始和结束日期进行描述,但是OECD GLP法规、EPA GLP法规以及德国、瑞士和日本环境省的GLP监管机构始终都保持了对计划书中预计试验开始和试验完成日期的定义和规定。而在生态毒理领域的GLP实验室,基本是按照OECD GLP或者EPA GLP法规体系来管理的,所以相关的计划书中必须体现试验起止日期。
为了更加合理地对研究日程进行规划,本文提出了按照活动属性分解研究活动的方法,有利于了解各个活动之间的影响程度和相互依赖性,并识别出研究中对结果具有直接影响的活动,将这类活动称为生产性活动,其发生和结束的时间可对应到计划书中试验开始和结束的日期。将该方法与具体研究类型结合,按照研究中生产性活动发生的先后顺序,分别识别试验开始和完成时对应的活动,从而确定研究计划中最合理的时间设计。这既能满足计划书合理性要求也符合前瞻性的理念。
GLP法规的初衷是为了确保研究的质量和重现性,而研究科学性更多要依赖于实验室的技术能力和人员水平,所以,GLP规范和研究项目不可截然分开,也就是管理和实践必须结合。有时当谈到GLP规范时,人们会认为这是对科学研究的一种束缚,因为GLP规范确实给实验室增加了大量文档性工作,但是当我们对法规具备了足够的了解,并且能够结合科学管理观做到统筹兼顾,将可能出现的问题解决在前端,可以极大地避免重复性劳动和无解的内部争议,提高工作效率,提升测试机构的管理水平和测试效率,逐步地提升我国GLP测试机构在国际上的认可度。
