尖晶石MFe2O4(M=Co、Cu、Mg)催化沼气重整制氢研究
2020-09-18姚金刚易维明蔡红珍
周 亮,姚金刚,易维明,刘 静,蔡红珍
(1.山东理工大学 农业工程与食品科学学院,山东 淄博 255049;2.山东省清洁能源工程技术研究中心,山东 淄博 255049)
氢是能量密度最高的载能体,是未来最有潜力替代化石燃料的可再生能源,作为高热值燃料,其燃烧过程只生成水且不释放其他污染物。因此,氢能的开发与利用日益受到世界各国的广泛关注[1-2]。目前氢气可通过热化学分解、电解水、水煤气转化和甲烷热裂解等[3-5]方法制备,但这些方法经济效益都较差。
沼气是一种清洁可再生的生物质能源[6]。沼气中甲烷(CH4)的含量为40%~70%,二氧化碳(CO2)的含量为30%~60%。此外,沼气中还含有少量的一氧化碳(CO)、硫化氢等温室气体,若是将沼气直接排放到大气中,不但会加剧温室效应的进程,还会破坏生态平衡,且CH4在空气中具有爆炸性,严重威胁了人身安全,若是能将沼气加以有效利用,则能带来环境与经济的双重效益[7]。
目前沼气的利用方式有:直接燃烧、合成生产高附加值燃料、重整制氢等[8-10],沼气干气重整制氢实质是CH4-CO2重整或称为甲烷干气重整反应(式6),它可以将CH4和CO2转化为合成气(H2和CO混合气)。与传统的蒸汽重整相比,由于产物中H2/CO比值低,沼气干气重整更适合通过费托反应或羰基合成生产烃类、甲醇和其他液体燃料[11]。
催化剂可以有效促进反应物间的传热和传质,降低反应温度,促进水煤气转换反应、甲烷蒸汽重整反应,进而提高H2产量。目前,镍基催化剂在重整制氢反应中得到了广泛应用,并取得了良好的催化效果,但该类催化剂容易因积碳而失去活性[12-13];贵金属催化剂对反应过程催化活性高而稳定,可抗积碳并能提高H2产量,但该类催化剂价格昂贵且在高温条件下易烧结。所以,目前重整反应研究的关键在于开发出低成本、抗积碳、活性高、稳定性好的非贵金属催化剂。
具有MFe2O4构型的尖晶石型铁氧体化合物,具有良好的热稳定性和化学稳定性,它易与过渡金属发生相互作用,并可以提高活性组分的分散度和抗烧结性能[14]。尖晶石型氧化物上的氧缺位有利于表面积碳的消除,从而可提高催化剂的抗积碳性能[15]。尖晶石催化重整反应实例有很多,Dolgykh等[16]研究了CoFe2O4铁氧体催化剂在乙醇重整反应中的催化性能,催化研究显示:在700 ℃条件下最大产氢率达到64.1%。李光俊等[17]采用柠檬酸络合法制备了CuFe2O4催化剂,并用于催化甲醇重整反应,结果表明CuFe2O4催化剂上CO选择性最高且稳定较好;Shen等[12]采用共沉淀法制备了以MgAl2O4为载体负载镍的催化剂,结果显示Ni负载量为3.4%的尖晶石型MgAl2O4催化剂在平均粒径为9.8 nm条件下,进行连续100 h的干气重整反应,催化剂呈现出良好的稳定性,无烧结失活和积炭现象。目前,鲜有研究报道尖晶石催化沼气干气重整反应。因此本文通过凝胶-溶胶法制备CoFe2O4、CuFe2O4和MgFe2O43种尖晶石铁氧体催化剂,在固定床上开展沼气干气催化重整制氢研究,考察温度、VCH4和VCO2比值及GHSV等因素对H2和CO选择性的影响。
1 实验部分
1.1 催化剂的原料与制备
C6H8O7·3H2O、Co(NO3)2·6H2O、Cu(NO3)2·3H2O、Mg(NO3)2·6H2O、Fe(NO3)2·9H2O均为分析纯,由天津奥普升化工有限公司提供。
采用溶胶-凝胶法制备,按照一定的化学计量比,将既定的金属硝酸盐溶于去离子水中,搅拌混合均匀。向该混合溶液中加入一定量的柠檬酸,在80 ℃水浴中溶解得到透明的溶液,并在80 ℃、搅拌下缓慢蒸发得到透明的溶胶,继续蒸发至粘稠胶状物,然后在105 ℃的烘箱内干燥12 h后,900 ℃下焙烧4 h。
1.2 催化剂的表征
催化剂的物相表征(XRD)采用德国Bruker D8 ADVANCE型X-射线衍射仪,功率为35 kV×30 mA,Cu Kα射线,λ=0.154 18 nm,大角扫描范围2θ=20°~80°。
催化剂比表面积和孔体积的测定在WJGS-029全自动比表面积及孔隙分析仪(Micromeritics,USA)上完成,采用液氮温度(-196 ℃)下的N2吸附法测得BET比表面和孔径分布,测试前将样品在200 ℃下脱附3 h,以去除样品中的水气等杂质。用BET公式和BJH方程分别计算催化剂的比表面积和孔体积。
催化剂的表面形貌结构用日立SU8020场发射扫描电子显微镜(SEM)进行观察,在15 kV加速电压、16 mm工作距离的条件下观察拍摄样品的微观形貌照片。
催化剂的程序升温还原(H2-TPR)在AutoChem II 2920化学吸附仪(Micromeritics,USA)上测定,催化剂预先在氩气气氛中于500 ℃处理1 h,冷却至室温切换为10%H2/Ar,吹扫至基线稳定后,以10 ℃/min升温至900 ℃。
1.3 实验装置与步骤
实验反应器为自制的固定床反应器,实验在固定床反应器上(φ25 mm×760 mm)进行,装置示意图如图1所示。固定床通过三段式热电偶进行加热,在固定床的中部设计了一段凹槽来放置定量的(1 g)催化剂。催化前催化剂在400 ℃、100 mL/min的N2流中稳定0.5 h,实验产生的气体产物用5 L气袋收集后进行气相色谱检测。测试结束后,催化剂在50 mL/min的N2流中冷却至室温,以备分析。
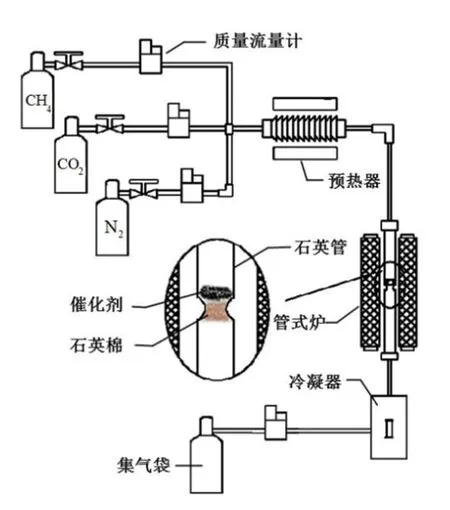
图1 沼气催化重整反应装置图Fig.1 Experimental scheme of methane reforming
1.4 数据分析
实验收集的气体采用Agilient 490 微型气相色谱仪(Molsieve 5Å色谱柱和Hayesep A色谱柱,柱温100 ℃,载气为Ar)进行分析。相关计算公式如下[18-19]:
(1)
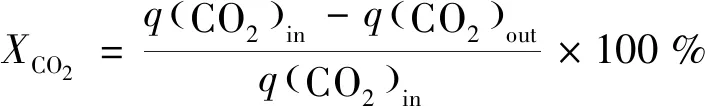
(2)
(3)
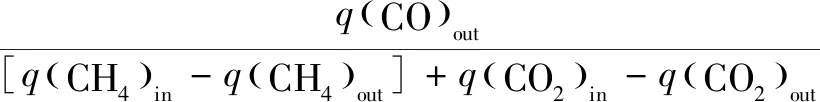
(4)
式中:X为转换率;S为选择性;q为气体体积流量,mL/min。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD分析
催化剂催化前后的XRD表征结果见图2。图2中,b、d和f分别为催化后的3种尖晶石催化剂R-CoFe2O4、R-CuFe2O4和R-MgFe2O4,由图2可知,催化剂均具有明显的尖晶石晶体结构。在CoFe2O4(JCPDS 03-0864)、MgFe2O4(JCPDS 73-2410)晶体中,Co2+、Mg2+存在于尖晶石面心立方体结构的八面体位置中,Fe3+存在于八面体位置中[20],为典型正尖晶石的Fd-3m晶群。在各催化剂中,都出现了Fe3O4(JCPDS 89-0691)立方体晶系Fd-3m型晶群的(220)、(222)、(331)、(511)和(440)晶面衍射峰。尖晶石中Fe3+-Fe2+离子之间的游离交换,可使催化剂产生大量氧晶格缺陷,晶格中的O2-离子逸出后,破坏了尖晶石结构的电中性平衡,因此,大量的阳离子会向内聚集,导致晶格间隙膨胀和晶格畸变,从而提高了MFe2O4催化剂的还原能力[21]。

a:CoFe2O4;b:R-CoFe2O4;c:CuFe2O4;d:R-CuFe2O4;e:MgFe2O4;f:R-MgFe2O4:MFe2O4;:Fe3O4;:Cu;:CuO图2 催化剂催化前后的XRD谱图Fig.2 XRD profiles of catalysts before and after reaction
在CuFe2O4(JCPDS 72-1174)的XRD衍射峰中,出现了CuO(JCPDS 89-5899)单斜晶系Cc型晶群(111)晶面的特征峰。据Cheng等[22]研究发现,表面分散的CuO可以在一定程度上提高催化剂的催化活性,且α-Fe2O3与CuO基团的协同作用可以进一步分散CuO,从而提高CuFe2O4催化剂的催化活性[23]。但是在催化后CuFe2O4的XRD衍射峰中,CuO的特征峰消失,出现了Cu(JCPDS 70-3039),这可能是发生了碳还原氧化铜的反应,即
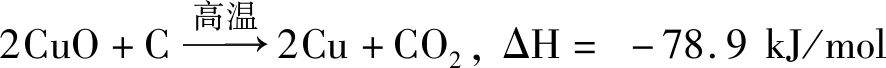
(5)
2.1.2 BET分析
表1列出了MFe2O4(M=Co、Cu、Mg)尖晶石型催化剂的比表面积、孔体积和孔径。可以看出3种催化剂的孔径均在2~50 nm之间,均属于介孔催化剂。较大的比表面积和孔体积有利于催化剂的活性组分在载体表面的自发分散,从而提高催化剂的活性[24]。
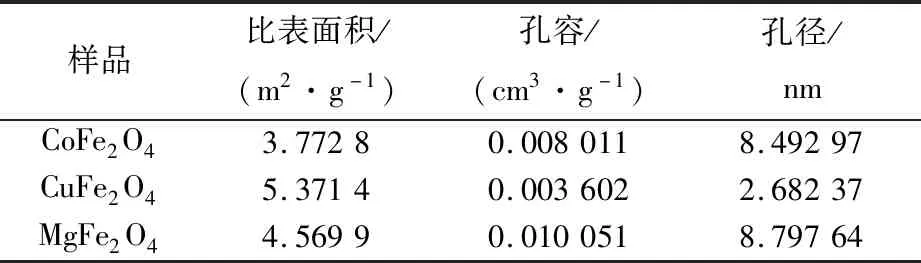
表1 催化剂的物理化学性质Tab.1 Physico-chemical performance of catalysts
2.1.3 SEM分析
图3为3种催化剂催化前后的SEM照片,可以明显看出催化前后的3种催化剂都呈不规则的几何多面体结构,颗粒间彼此相连,根据谢乐公式计算得到晶粒尺寸大多位于30~80 nm范围。
图3(d,e和f)分别为催化后的3种尖晶石催化剂R-CoFe2O4、R-CuFe2O4和R-MgFe2O4,可以看出R-CoFe2O4和R-MgFe2O4的立体结构相比催化前要模糊。这主要是因为粒子本身粒径太小,粒子间的距离很短,其范德华力远大于粒子本身的重力,从而引起粒子间的团聚[25]。
2.1.4 H2-TPR分析
图4为MFe2O4催化剂的H2-TPR图谱,可以看出CuFe2O4和MgFe2O4都出现了两个还原峰,而CoFe2O4只出现了一个还原峰,根据Chagas[26]的研究,这是因为位于405 ℃和460 ℃的两个还原峰进行了重叠。第一个还原峰位于405 ℃,与Co2+→ Co0、Fe3+→ Fe2++Fe3+有关,随后是催化剂在460 ℃出现的Fe2++Fe3+→Fe2++Fe0还原峰。
MFe2O4催化剂中,M位元素的H2还原峰面积和位置与催化活性关系较大[27]。270 ℃和425 ℃时,在CuFe2O4的H2-TPR曲线出现了高度分散的Cu2+→Cu1+和结晶中的Cu2+→Cu1+的还原峰。Cu的还原峰温度明显低于其他M位元素,Meshkani等[23]认为,尖晶石结构的出现,改变了催化剂中Cu与Fe所占的亚晶格位置,进而影响催化剂的H2还原峰面积和还原温度。
2.2 催化剂的筛选
本节考察了3种催化剂的催化活性,并以不加催化剂作为空白样进行了对比实验。基于所选催化剂对沼气干气重整制氢过程CH4、CO2转化率以及H2、CO选择性的影响,筛选出最优催化剂,并进行后续的进一步研究。
各催化剂在GHSV=6 000 h-1、VCH4/VCO2=1的反应条件下对沼气重整反应过程CO2、CH4转化率以及H2、CO选择性的影响如图5所示。由图5可知,CO2和CH4转化率以及H2和CO选择性都随温度的升高呈增加趋势,这是因为高温有利于反应物分子的活化,增强了催化剂中的活性组分与载体之间的相互作用[28]。
相比于其他两种催化剂,CuFe2O4催化剂具有更高的催化活性。这是因为在CuFe2O4中形成的Fe3O4最终还原成Fe,Fe作为促进CH4裂解催化剂,在高温下容易与积碳形成Fe3C,而Fe3C也是促进CH4裂解的催化剂[29];此外,从CuFe2O4析出的Cu对Fe表面的积碳形成有抑制作用[23]。因此,选择CuFe2O4为催化沼气重整反应中的最优催化剂。
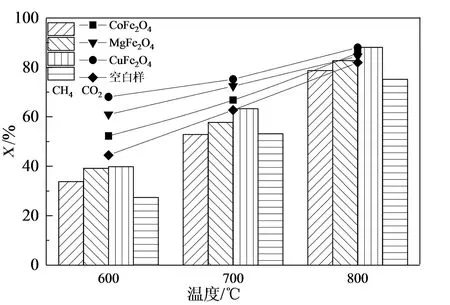
(a)转化率
2.3 沼气干气催化重整研究
2.3.1 温度的影响
如图6所示,以CuFe2O4为催化剂,在保持其他实验条件不变的条件下,考察了温度对沼气干气催化重整反应各产物组分转化率以及选择性的影响。从图6可以看出,产物由H2、CH4、CO以及CO2组成;当温度从600 ℃升到800 ℃时,H2和CO选择性显著提高,分别从65.95%和70.33%增加到87.60%和89.79%;CH4和CO2的转化率也随温度的升高而升高,分别由原来的39.81%和67.78%增加到88.13%和87.77%。上述结果表明:高温有利于沼气干气催化重整反应的进行,这是因为干气重整是一种强吸热反应(式6),高温有利于反应物分子的活化,增强了催化剂中的活性组分与载体之间的相互作用;高温不仅有利于CH4和CO2的转化,还有利于提高H2和CO选择性。

图6 温度对沼气干气催化重整反应产物的影响(VCH4∶VCO2=1∶1,GHSV=6 000 h-1)Fig.6 Effect of reforming temperature on the yields of gaseous products over CuFe2O4(VCH4∶VCO2=1∶1,GHSV=6 000 h-1)
CH4+CO2→2H2+2CO,ΔH= 247.3 kJ/mol
(6)
2.3.2VCH4和VCO2比值的影响
从图7可以看出,在VCH4和VCO2比值从3∶1降低到1∶1区间内,CH4和CO2转换率下降,H2和CO选择性上升,这是因为比值的适当减小有利于反应平衡向有利于氢气生成的方向移动[30];当VCH4和VCO2比值小于1∶1时,CH4和CO2转换率上升,H2和CO选择性下降,且CO选择性始终高于H2选择性,原因是在该既定温度下,比值的减少会促进逆水煤气变换反应(式7)的进行,使得H2和CO选择性下降[31]。
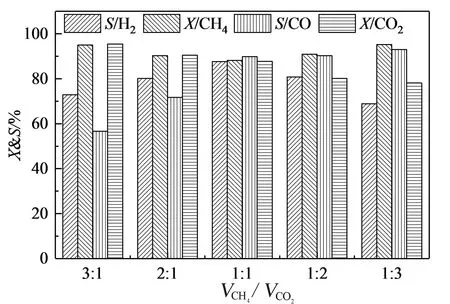
图7 VCH4和VCO2比值对沼气干气催化重整反应产物的影响(t=800 ℃,GHSV=6 000 h-1)Fig.7 Effect of VCH4 and VCO2 ratio on the yields of gaseous products over CuFe2O4(t=800 ℃,GHSV=6 000 h-1)
CO2+H2→CO+H2O,ΔH= 41 kJ/mol
(7)
2.3.3 GHSV的影响
如图8所示,空速从6 000 h-1增加到13 800 h-1的区间内,H2和CO选择性以及CH4和CO2转化率降低。这是由于随着空速的增加,原料气与催化剂的接触时间减少,影响了反应物的转化率;在高空速下,原料气将快速通过催化剂床层,原料气可能还没有被预热到反应温度就发生了重整反应[32];H2和CO选择性都随着空速的增加而减小,这是因为沼气重整反应较慢,而CH4裂解(式8)和逆水煤气变换反应(式7)较快,空速增大、停留时间减小对沼气干气催化重整反应影响较大,而对两种副反应影响较小[33]。
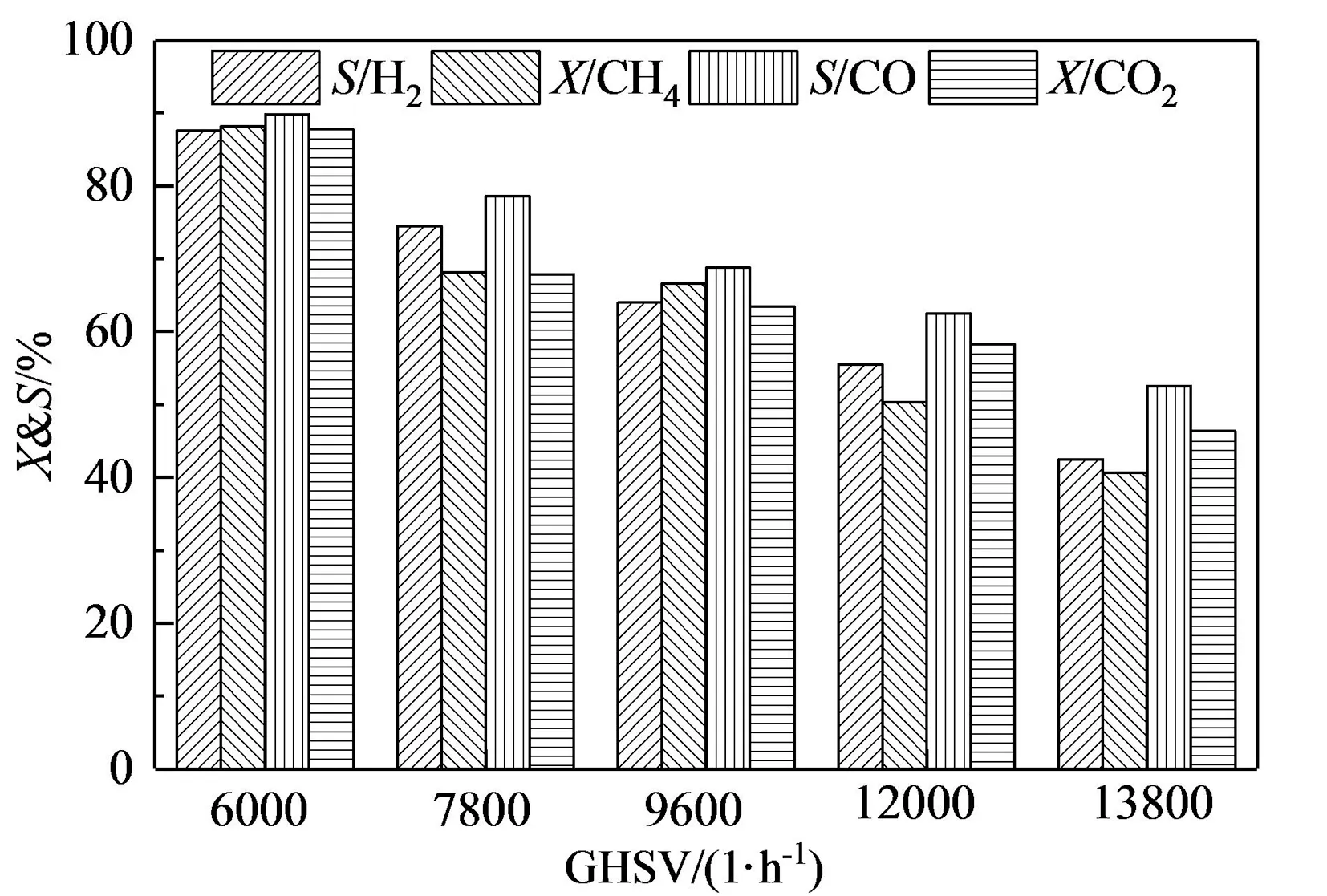
图8 GHSV对沼气干气催化重整反应产物的影响(t=800 ℃,VCH4∶VCO2=1∶1)Fig.8 Effect of GHSV on the yields of gaseous products over CuFe2O4(t=800 ℃,VCH4∶VCO2=1∶1)
CH4→C+2H2,ΔH= 75 kJ/mol
(8)
3 结论
1)采用溶胶-凝胶法自制的MFe2O4(M=Co、Cu、Mg)均形成了典型的尖晶石晶体结构。
2) Cu和载体之间的相互作用有利于消除催化剂积碳,提高H2选择性和催化剂的稳定性。
3)当VCH4∶VCO2=1∶1、GHSV=6 000 h-1、在800 ℃时,尖晶石CuFe2O4表现出最优的性能,获得氢气和一氧化碳选择性分别为87.60%和89.79%。
4)温度、VCH4和VCO2比值、GHSV是影响反应结果的重要因素。
