紫玉兰MlSOC1基因亚细胞定位及花芽分化时期的表达分析
2020-09-17宣铃娟程少禹戴梦怡王卓为申亚梅
宣铃娟,程少禹,戴梦怡,王卓为,申亚梅
(浙江农林大学风景园林学院,杭州311300)
开花是植物由营养生长过渡到生殖生长必须经历的一个重要环节,这一环节是由外部环境因子和植物内在因子共同决定的[1]。植物在长期的进化过程中受到很多信号传导途径的调控,在对模式植物拟南芥的研究中发现,植物中共存在6条成花途径,包括光周期途径、春化途径、赤霉素途径、温度途径、自主成花途径和年龄途径[2-3]。植物在受到外界环境或内源物质等释放的成花信号的刺激后,将信号传导到3 个主要的成花整合因子FT(FLOWERING LOCUS T)、LFY(LEAFY)和SOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS1)中,信号被接收后通过相互作用传递给花器官决定基因,进而作用于下游花分生组织,促进植物开花[4-8]。
SOC1 基因的功能域和结构域在单子叶和双子叶植物中都相对比较保守,其编码的蛋白属于MADS 盒(MADS-box)家族,主要由MADS 盒、K盒、I区和C末端等组成[9-10]。研究发现,MADS盒基因在花分生组织的发育中扮演重要角色,并在成花调控过程方面也有非常突出的作用[11-12]。目前,在紫斑牡丹(Paeonia suffruticosa)[13]、荠菜(Brassica juncea)[14]、红 掌(Anthurium sp.)[15]、蝴 蝶 兰(Phalaenopsis sp.)[16]等多种植物中均已克隆得到SOC1 基因序列,但在木兰科木兰属植物中还未见到有关于SOC1基因的报道。
紫玉兰(Magnolia liliflora)是备受人们欢迎的木兰科木兰属植物,具有悠久的种植历史。紫玉兰花期相对其他木兰属植物晚,属于晚春开花型植物,因其具有良好的观赏价值,在园林应用特别是庭院绿化方面具有重要作用。在木兰属育种方面,紫玉兰还是优良的育种木本[17],通常被用作母本植物进行育种。鉴于SOC1 基因的重要调控作用,开展紫玉兰SOC1基因的深入研究对其成花机制的揭示具有重要的指导意义,可为木兰属植物其他种或品种的研究提供重要的参考。
1 材料与方法
1.1 试验材料
试验材料为种植于浙江农林大学玉兰路的10年生紫玉兰。于2019年4—6月不同时期采摘紫玉兰不同成花阶段的叶和花芽,一部分放入甲醛-乙醇-乙酸(formalin-alcohol-acetate, FAA)混合固定液中,另一部分迅速放入液氮中,随后置于-80 ℃超低温冰箱中储存,备用。
1.2 紫玉兰花芽分化形态特征观察
待紫玉兰花落尽且展新枝之后,每隔7 d 采集一次新枝顶端花芽的样,取一部分芽于体式显微镜下观察其外部形态特征,同时采10~15个芽用标准固定液保存,用于石蜡切片观察[18]。
1.3 MlSOC1-1 和MlSOC1-2 基因的克隆
紫玉兰花芽的总RNA用纯植物RNA提取试剂盒[购自天根生化科技(北京)有限公司]进行提取,并用核酸分析仪对提取的总RNA 质量进行检测。以提取质量合格的RNA作为模板,利用反转录试剂盒(Prime ScriptTMRT Master Mix)[购自宝生物工程(大连)有限公司]反转录成cDNA 的第1 链[19]。用Primer 5.0 软件设计引物,并将引物序列(表1)送至生工生物工程(上海)有限公司进行合成,通过聚合酶链式反应(polymerase chain reaction, PCR)对MlSOC1-1 和MlSOC1-2 进行克隆。将PCR 产物进行1% 琼脂糖凝胶电泳检测。目的条带采用MiniBEST 琼脂糖凝胶DNA 提取试剂盒(日本TaKaRa 公司)进行切胶回收、利用后,连接到pMD18-T 载体上并转化大肠埃希菌DH5α。然后经过氨苄青霉素(ampicillin)抗性筛选,将阳性克隆菌液经PCR 检测后送至生工生物工程(上海)有限公司进行测序。

表1 紫玉兰MlSOC1基因克隆、表达分析及载体构建相关引物Table 1 Primers for cloning,expression analysis and vector construction of MlSOC1 in M.liliflora
1.4 MlSOC1-1 和MlSOC1-2 的序列分析和系统进化树构建
利用ORF Finder(http://www.ncbi.nlm.nih.gov/project/grorf)在线网站查询MlSOC1-1和MlSOC1-2基因的开放阅读框;利用DNAman软件进行核苷酸序列的翻译和同源性比对;通过NCBI 网站(http://www.ncbi.nlm.nih.gov/Blast.cgi)的Blastx 进行基因氨基酸同源性比对[19];最后通过MEGA 6.0 软件进行系统进化树的构建和分析。
1.5 MlSOC1-1 和MlSOC1-2 载体的构建及亚细胞定位
亚细胞定位载体选用pCMBIA1302,在37 ℃条件下通过限制性内切酶NcoⅠ和SpeⅠ对载体和目的基因(表1)进行3 h 的双酶切,然后用T4 连接酶对双酶切后的目的基因和载体质粒于16 ℃条件下进行过夜连接;将连接产物转化大肠埃希菌,并涂布于含有卡那霉素(kanamycin)抗性的Luria-Bertani(LB)固体培养基上,过夜培养后挑取白色单菌落进行扩繁,以扩繁后的菌液为模板经PCR扩增和产物测序获得正确的阳性克隆,从而得到亚细胞定位的重组载体pCMBIA1302-MlSOC1-1/2。
将载体pCMBIA1302-MlSOC1-1/2 通过冻融法转入GV3101 农杆菌感受态中,摇菌4~5 h 之后取少量上清培养液,吹打混匀菌体,涂于含有卡那霉素和利福平抗生素的酵母甘露醇培养基(yeast mannitol medium,YEB)上,28 ℃条件下倒置培养2 d后挑取单菌落,28 ℃摇菌16 h 后进行菌落PCR 验证,正确的菌液接种于YEB液体培养基中进行摇菌扩繁2~3 d,直至D(600 nm)≈2.0后,离心收集菌体并用悬浮液将菌体稀释至D(600 nm)≈0.1。稀释后的侵染液用于洋葱表皮侵染实验。选取生长健康的洋葱暗培养3 d之后,用刀片去除洋葱表面鳞片,然后用注射器将菌悬液注入洋葱第2—3 层处的表皮,并用记号笔圈出注射的位置;继续暗培养3 d后,撕下洋葱表皮并置于载玻片上,采用Axio-Imager_LSM-800 激光共聚焦显微镜(德国卡尔蔡司公司)进行观察。
1.6 MlSOC1-1 和MlSOC1-2 的表达分析
将紫玉兰不同成花阶段叶和花芽的cDNA模板稀释10倍,于-20 ℃条件下保存,用于实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction, qRT-PCR)。以Actin为内参基因,用Primer 5.0 软件设计不同时期花芽和叶的荧光定量PCR 反应引物(表1),送至生工生物工程(上海)有限公司合成。PCR 反应体系(20 μL):cDNA 模板2 μL,荧光染料SYBR 10 μL,上游引物和下游引物各0.8 μL,用ddH2O 补足至20 μL。PCR 反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃复性30 s,40 个循环;用Light Cycler 480 软件计算阈值(CT)大小,采用2-△△CT计算方法分析表达量。
2 结果与分析
2.1 紫玉兰花芽分化过程中的形态特征变化
紫玉兰于晚春开花,在木兰属植物中为花叶同开类型。经过近一个月的新枝抽梢,在顶端开始出现新芽。在花芽分化过程中,芽外部依次形成几层被白色或浅褐色毛的佛焰苞状苞片。紫玉兰每年只进行一次花芽分化,从5 月初开始顶芽分化,至6月中上旬分化结束。根据石蜡切片的结果,可将紫玉兰花芽分化划分为6个时期(图1):未分化期(S1)、分化初期(S2)、萼片原基分化期(S3)、花瓣原基分化期(S4)、雄蕊原基分化期(S5)和雌蕊原基分化期(S6)。从芽的外部形态可以看出,随着内部器官的逐渐发展,芽渐渐膨大饱满,颜色由淡黄绿色变深至棕褐色,并且外层被绒毛,绒毛变多且变得蓬松(图1A~F)。从花芽的内部来看,未分化期芽体积生长点较小,随着分化的进行,内部花芽原基开始变大,出现生长锥,生长锥上出现突起,最后雌蕊原基分化,完成整个花芽分化过程(图1G~L)。
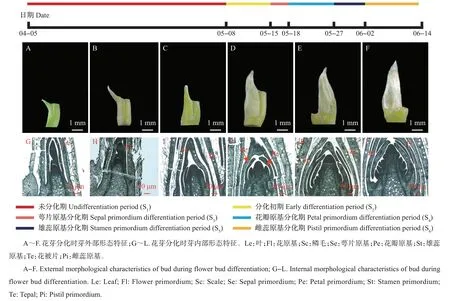
图1 紫玉兰花芽分化过程Fig.1 Process of flower bud differentiation in M.liliflora
2.2 紫玉兰MlSOC1-1 和MlSOC1-2 基因的克隆
通过对景宁木兰转录组数据的筛选,得到2 条SOC1 基因的序列信息,采用同源基因克隆及基因PCR 克隆验证的方法,得到了MlSOC1-1 和MlSOC1-2基因的核苷酸序列。其中:MlSOC1-1编码区长666 bp,编码221 个氨基酸;MlSOC1-2 编码区长654 bp,编码217 个氨基酸(图2)。通过DNAman 软件对MlSOC1-1 和MlSOC1-2 的核苷酸序列进行比对发现,这2 个基因序列的同源性为75.3%;因此,我们认定这是2个不同的基因,可能在功能、组成成分等方面存在差异,而不是同一基因通过可变剪切形成的不同剪接体。
2.3 MlSOC1-1 和MlSOC1-2 的生物信息学分析

图2 MlSOC1-1和MlSOC1-2基因核苷酸序列比对Fig.2 Nucleotide sequence alignment of MlSOC1-1 and MlSOC1-2 genes
通过与其他物种的多个氨基酸序列进行比对发现,紫玉兰MlSOC1-1 和MlSOC1-2 编码的氨基酸序列与其他物种中SOC1编码的氨基酸序列的同源性都达了65%以上,且与木兰科植物更为相近,序列同源性达90%以上。同时发现,MlSOC1-1 和MlSOC1-2 与其他植物如葡萄(Vitis vinifera)、大豆(Glycine max)等一样具有典型的SOC1-MOTIF 保守序列(图3),说明MlSOC1-1和MlSOC1-2基因都属于SOC1/TM3亚家族中的成员。
为了研究紫玉兰MlSOC1-1 和MlSOC1-2 蛋白在进化过程中与其他植物的亲缘关系,选取一些单子叶和双子叶植物的SOC1蛋白,用MEGA6.0软件构建系统进化树(图4)。结果表明:紫玉兰MlSOC1-1蛋白与皱叶木兰(M.praecocissima)中的SOC1蛋白亲缘关系最近,而MlSOC1-2 与北美木兰(M.virginiana)中的SOC1 蛋白亲缘关系最近;同时,MlSOC1-1和MlSOC1-2与荷花(Nelumbo nucifera)、烟 草(Nicotiana tabacum)、拟 南 芥(Arabidopsis thaliana)等一些双子叶植物中的SOC1 蛋白有一定的亲缘性,而与小麦(Triticum aestivum)、海枣(Phoenix dactylifera)等单子叶植物中的SOC1 蛋白亲缘关系相对较远。
2.4 紫玉兰MlSOC1-1 和MlSOC1-2 基因编码蛋白的亚细胞定位
构建pCMBIA1302-MlSOC1-1/2 的重组质粒,如图5 所示。转化DH5α 后,通过菌液PCR 验证,将挑选出的单菌落阳性克隆菌液送至生工生物工程(上海)有限公司进行测序和序列比对,结果表明pCMBIA1302-MlSOC1-1/2-GFP载体已构建成功。将pCMBIA1302-MlSOC1-1/2-GFP 融合载体及空载体(pCMBIA1302原始载体)分别转化至洋葱表皮细胞,在培养一段时间后,通过激光共聚焦显微镜观察重组载体和空载体的表达位置发现,pCMBIA1302-MlSOC1-1/2载体均在核内产生绿色荧光,重组载体的表达蛋白被定位于细胞核内,而对照载体则可以在整个细胞中表达(图6),这说明MlSOC1-1/2编码的蛋白均属于核蛋白。
2.5 MlSOC1-1 和MlSOC1-2 在紫玉兰成花过程不同阶段中的表达分析
为了解MlSOC1-1 和MlSOC1-2 基因在紫玉兰花芽分化不同阶段(S1~S6)的表达差异性,分别提取不同花芽分化期紫玉兰叶和花芽的总RNA,再将这些RNA反转录成cDNA,经稀释后作为模板进行qRT-PCR 分析。结果(图7)显示:在紫玉兰不同时期的叶片中,从未分化期到分化初期,MlSOC1-1表达量明显增加(P<0.01),随后表达量整体呈逐渐降低趋势;而MlSOC1-2 表达量从未分化期开始就呈现逐渐降低的趋势,直至雄蕊原基分化期才有所提高。在花芽中,紫玉兰花芽分化不同时期MlSOC1-1基因表达量呈先下降后上升的趋势,而MlSOC1-2基因在分化初期的表达量就高于其他时期,之后表达量开始下降,至雌蕊原基分化期时其表达量达到最低,趋向于不表达。

图3 MlSOC1-1和MlSOC1-2氨基酸序列与其他物种SOC1氨基酸序列的比对Fig.3 Sequence alignment of MlSOC1-1 and MlSOC1-2 with SOC1 amino acid sequences of other species
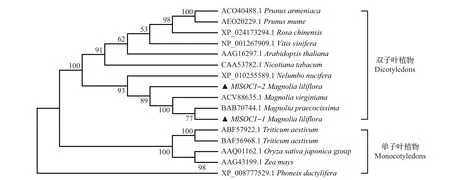
图4 紫玉兰MlSOC1-1和MlSOC1-2蛋白与其他物种SOC1蛋白的进化树Fig.4 Phylogenetic tree between MlSOC1-1/2 proteins and SOC1 proteins of other species
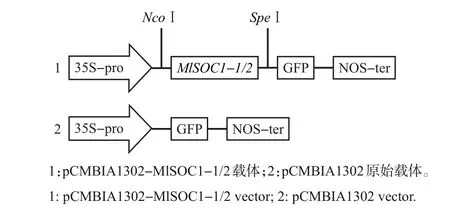
图5 载体构建示意图Fig.5 Schematic diagram of vector construction
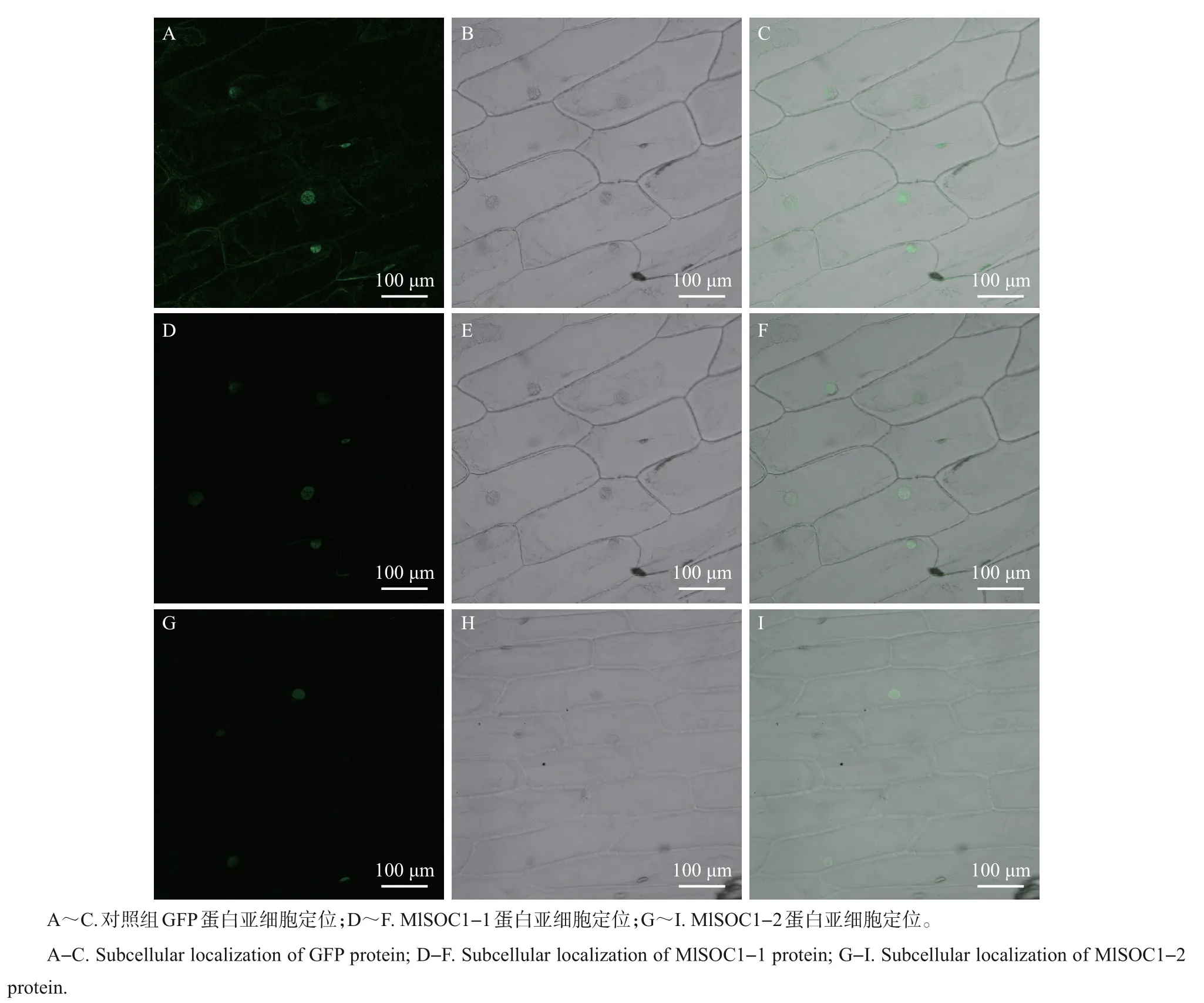
图6 MlSOC1-1/2蛋白亚细胞定位Fig.6 Subcellular localization of MlSOC1-1/2 proteins
根据MlSOC1-1 和MlSOC1-2 基因在紫玉兰花芽分化不同阶段叶片和花芽中的表达分析发现,2个基因无论是在叶片还是花芽中,其表达模式均有所差异,其中:MlSOC1-1的表达模式为由高到低再升高,该基因在成花转变及花芽分化初期具有较高的表达量,且在花芽分化的花瓣原基分化期到雌蕊原基分化期,其表达量开始不断上升,表明MlSOC1-1基因除了参与紫玉兰芽的成花转变外,还有可能对紫玉兰花器官的合成有一定作用。MlSOC1-2基因仅在成花转变及花芽分化初期具有较高的表达量,而在花芽分化的花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化期表达量不断下降,这表明MlSOC1-2基因可能仅对紫玉兰芽的成花转变起到一定作用,而对花器官发育的作用并不明显。
3 讨论
开花是植物从营养生长过渡到生殖生长的一个重要过程[1,20],相比拟南芥等草本植物,紫玉兰需要经历较长的童期(指实生树从种子播种萌发开始到具有花芽分化潜力及开花结果的阶段)才能实现向生殖生长的转变。了解紫玉兰开花转变的过程对加速紫玉兰的品种改良具有十分重要的意义。紫玉兰在花芽分化的时间进程上与其他木兰属相比稍有不同,但是在形态特征上与木兰属和鹅掌楸属[18,21-22]相一致。研究发现,MADS盒基因在植物生长过程中具有调节生长发育的多种功能[23-24],SOC1作为MADS盒基因家族中重要的成花整合因子,在控制植物开花时间上发挥重要作用,并广泛存在于单子叶植物和双子叶植物中[9,25]。
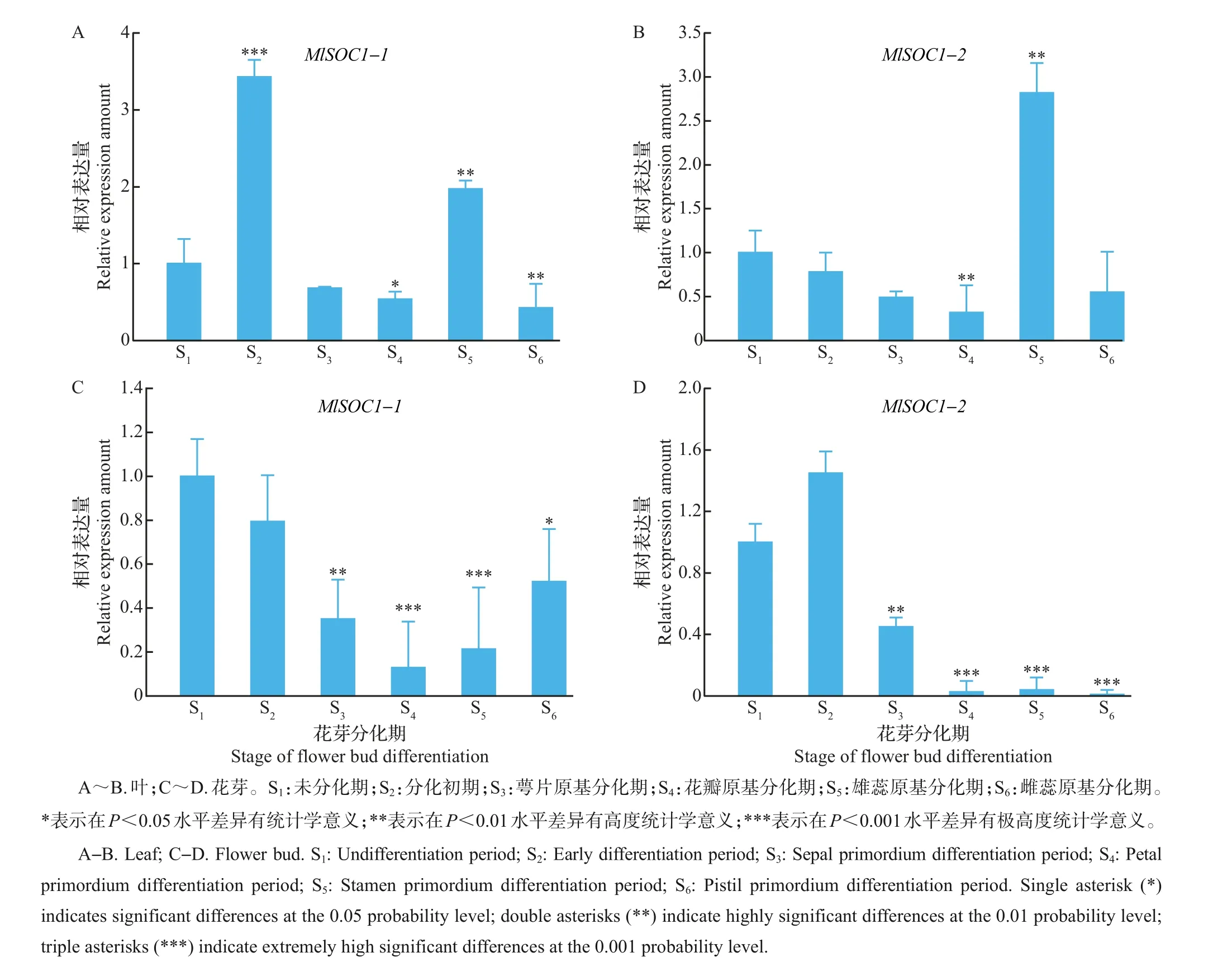
图7 MlSOC1-1和MlSOC1-2在不同花芽分化期叶和花芽中的表达分析Fig.7 Expression analysis of MlSOC1-1 and MlSOC1-2 of leaves and flower buds in different flower bud differentiation periods
在以往的研究中发现,大多数植物只存在一个SOC1同源基因,只有少数物种具有多个SOC1同源基因[26]。本次试验在紫玉兰中发现2个SOC1基因,经过比对发现,其序列同源性并不一致。MlSOC1-2的氨基酸序列与MlSOC1-1 有一定的差异性,但通过多物种氨基酸同源蛋白序列比对以及系统进化树分析,判断MlSOC1-1 和MlSOC1-2 属于MADS 盒家族基因且是SOC1 转录因子家族成员,因而判定紫玉兰中不止一个SOC1 同源基因。SOC1 基因属于MADS 盒基因,通过进化树分析发现MlSOC1-1和MlSOC1-2 基因均属于SOC1/TM3 支系[10]。从有关的研究中发现,属于该支系的SOC1 基因与植物的花分生组织特性及成花诱导相关[27]。
木兰属植物的花芽分化期较短,一般在4—6月,其花芽分化期可分为未分化期、分化初期、萼片原基分化期、花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化期[19-20]。本研究通过实时荧光定量PCR 发现,MlSOC1-1 和MlSOC1-2 基因在不同花芽分化期的表达量及表达模式有所不同,这表明MlSOC1-1 和MlSOC1-2 基因在调控紫玉兰成花过程中发挥的作用有所差异。在MlSOC1-1的表达分析中发现,MlSOC1-1前期参与成花转变,后期可能同时参与花器官的合成;因此推测,MlSOC1-1可能对花分生组织的下游基因MlLFY[28]起调控作用,从而进一步调控C 类基因AG 的表达,促进雄蕊原基和雌蕊原基的分化[29-30]。而MlSOC1-2 基因在花芽未分化期到分化初期表达量呈上升趋势,这可能与MlSOC1-2在紫玉兰中由营养生长转向生殖生长的作用有关,这与PmSOC1 基因在梅花花芽分化过程的调控结果[31]相一致。近几年的研究也发现:在拟南芥中,AtSOC1的表达量随着植株的生长而不断提高,尤其在成熟叶片中的表达量最高[32];在月季中,RhSOC1 则在顶芽中的表达量最高[33];在梅花中,PmSOC1基因在成年树和幼苗中的表达量有一定的差异[31]。本文对紫玉兰中的SOC1 基因进行分离鉴定、表达模式分析和亚细胞定位等,初步了解了SOC1 基因在紫玉兰成花过程中的作用,并为研究紫玉兰SOC1基因如何响应上游调控因子及如何与其他MADS盒开花相关基因、蛋白相互作用的研究奠定了基础。
4 结论
基于景宁木兰转录组数据筛选得到的2 个SOC1 基因,通过同源基因克隆的方法得到它们的核苷酸序列,并通过比较它们的同源性,可以排除是同一基因通过可变剪切形成不同剪接体的可能。在亚细胞定位试验过程中发现,这2 个基因都定位于核蛋白上,无太大的差异。同时,通过qRT-PCR对MlSOC1-1 和MlSOC1-2 基因在不同花芽分化阶段叶和花芽中的表达情况进行分析研究发现:MlSOC1-1 的表达呈现由高到低再升高的模式;MlSOC1-2基因仅在成花转变及花芽分化初期具有较高的表达量,而在花芽分化的中后期表达量不断下降,说明这2 个基因在花芽分化过程中起着不同的作用。而MlSOC1-1 和MlSOC1-2 在组成成分和表达上的不同是否会导致其对紫玉兰花芽分化过程调控造成差异,尚有待进一步研究。
