Erastin 诱导细胞铁死亡的研究进展▲
2020-09-15付艳君白纪红梁志清
付艳君 白纪红* 梁志清 余 倩
(桂林医学院附属医院,1 药剂科,2 内分泌科,广西桂林市 541004)
【提要】 铁死亡是在2012年发现的一种新型的并依赖铁离子的可被调节的细胞死亡方式,这种死亡形式在细胞形态学、生物化学等方面不同于凋亡、坏死及自噬,铁死亡会受到细胞内信号通路的调节。Erastin是目前公认的最常用的铁死亡诱导剂,不但可以被应用于杀伤肿瘤细胞,而且其致细胞死亡的机制与许多损伤类疾病的病理机制密切相关。Erastin诱导的细胞铁死亡被广泛应用于各大疾病的治疗及预后。
肿瘤是我国死亡率最高的疾病,化疗是肿瘤综合治疗的手段之一,多数化疗药物是通过引起肿瘤细胞凋亡起作用的。然而,随着化疗时间的延长,部分细胞会产生凋亡耐受,从而导致肿瘤耐药的形成。因此,寻找一种新的细胞死亡方式,并进行有效调控,可以为发生耐药的肿瘤细胞提供新的治疗策略,为临床诊疗带来巨大的参考依据和理论价值。铁死亡是一种依赖于脂质过氧化反应驱动的非凋亡性细胞死亡方式,其发生过程需要细胞内富含可利用的铁。这种与铁密切相关的死亡形式在细胞形态学、生物化学等方面与坏死、凋亡、自噬等均有明显的不同,该死亡方式受细胞内信号通路的严密调节,但目前还不清楚具体受哪种信号通路的调节。Erastin是目前被公认的最常用的铁死亡诱导剂,Erastin诱导的铁死亡近年来被越来越多的学者研究,以探索其发生发展机制。铁死亡可通过不同途径致使细胞死亡,研究发现Erastin诱导的铁死亡不但可以被应用于杀伤肿瘤细胞,而且其使细胞死亡的机制与许多损伤类疾病的病理机制密切相关。目前,Erastin诱导的细胞铁死亡已经被广泛应用于各大疾病的治疗及预后。
1 Erastin的化学结构与合成
Erastin,化学名为2-【1-{4-[2-(4-氯苯氧基)乙酰基]-1-哌嗪基}乙基】-3-(2-乙氧基苯基)-4-(3H)喹唑啉酮。Erastin的分子结构见图1。Erastin是一种铁死亡诱导剂,最早由美国Whitehead生物医学研究所研发,其具有显著的抗肿瘤作用[1],是目前被公认的最常用的铁死亡诱导剂[2]。
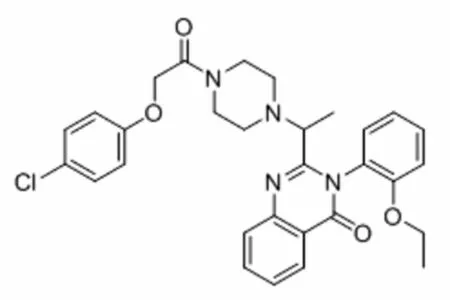
图1 Erastin的分子结构图
国内外已有学者将Erastin进行合成,其中常用的方法为:以2-氨基苯甲酸为起始原料,采取先酰化后环合的方法制备中间体。但该方法操作较为烦琐,所得产物复杂,收率不高(46.8%);并采用易挥发且毒性较大的溴素为溴代试剂制备中间体,容易生成双溴代产物,所得产物不易纯化,粗品总收率仅为8.0%。赵艳利等[3]对Erastin的合成工艺进行改进,以2-氨基苯甲酸为起始原料,通过5步反应合成了Erastin,产率31.4%,纯度98.33%,其结构经1H NMR和ESI-MS确证。这些研究显示,采用改进的方法可以更好地合成Erastin,可为该药的临床广泛应用提供更为质优价廉的产品。
2 Erastin的分子特性
线粒体在细胞生命和死亡中占据中心位置,线粒体生物能量、生物合成和信号传导是肿瘤发生的关键。电压依赖性阴离子通道1位于线粒体外膜中,作为线粒体门控器,允许代谢物、脂肪酸离子、Ca2+、活性氧物质和胆固醇跨线粒体外膜转移,是线粒体介导的细胞凋亡的关键因子[4]。实验显示,Erastin可以通过抑制Xc-系统并关闭线粒体外膜的电压依赖性阴离子通道2/3,间接诱导线粒体活性氧的产生,从而引发携带致癌基因的线粒体活性氧的结直肠癌细胞铁死亡[5-6]。此外,Erastin能够通过铁死亡途径对抗化疗药物(阿糖胞苷和多柔比星)的耐药性,抑制急性骨髓性白血病细胞的增殖,并显著增加化疗药物的抗癌活性[7]。在对铁死亡的研究中,Erastin已经发展成为重要的工具药。
3 Erastin在疾病中的应用研究
目前的研究中,Erastin应用较多的领域为诱导细胞铁死亡。铁死亡是在神经系统疾病研究中提出来的概念。2012年有研究发现[2],在大鼠海马组织体外培养过程中,抑制铁死亡可有效降低谷氨酸诱发的神经毒性。继而在神经退行性疾病中发现,抑制铁死亡也可保护神经元和少突胶质细胞,促进其存活。随着研究的扩展和深入,Erastin在诱导肿瘤细胞铁死亡方面的作用逐渐被人们发现,因此,Erastin在包括肿瘤在内的疾病中的作用得到了广泛研究,为其在这些疾病中的临床应用提供了重要的理论和实验依据[8-9]。
3.1 Erastin在缺血再灌注中的应用 缺血性疾病为临床常见疾病,重要病种有缺血性心肌病、肾病和脑出血等。现有研究发现细胞铁死亡参与了这些疾病的发生发展过程,诱导细胞铁死亡有可能成为治疗这些疾病的新方法。心肌缺血性疾病影响围术期患者的预后,而糖尿病可加重心肌损伤,但细胞铁死亡对糖尿病诱发的心肌细胞损伤机制还不完全清楚。Li等[10]通过建立大鼠糖尿病心肌缺血再灌注模型,使用Erastin诱导细胞铁死亡,并与铁死亡抑制剂进行对照,而后再检测铁死亡相关指标,发现抑制动物模型中的铁死亡可减轻内质网应激和心肌损伤。在高糖细胞模型中发现,Erastin可通过诱导铁死亡加重内质网应激和细胞损伤[11]。同时,抑制内质网反应可减轻铁死亡和细胞损伤。肾缺血/再灌注损伤也是临床常见的疾病之一,研究表明其与细胞氧化损伤密切相关[12]。细胞铁死亡也是一种氧化性损伤,但其与肾缺血/再灌注损伤的关系尚未明确。Baba等[13]研究了Pannexin 1 (PANX1)在细胞铁死亡与肾缺血/再灌注损伤中的关系,证明了PANX1缺失通过调节铁依赖性细胞死亡保护肾脏缺血/再灌注损伤,其中在细胞实验中显示沉默的PANX1显著降低了Erasin诱导的铁蛋白脂质过氧化和铁蓄积[14-15]。
3.2 Erastin在肺癌中的应用 非小细胞肺癌(non-small cell lung cancer,NSCLC)早期缺乏典型的临床症状,即使在完全手术切除后也有很高的复发风险,长期以来一直是最致命的癌症类型之一[16]。以顺铂为基础的多疗程化疗是NSCLC的标准辅助治疗方法,但其对患者整体生存的益处有限。近年研究发现,采用Erastin诱导肺癌细胞铁死亡后,可以有效抑制肺癌细胞的耐药性[17]。有研究探索了肺癌细胞对顺铂耐药的机制,发现使用Erastin诱导肺癌细胞N5CP铁死亡后,可以有效诱导N5CP细胞的铁含量升高,进而有效抑制N5CP细胞在体内的生长[18]。尽管高剂量的Erastin可以诱导细胞铁死亡,但也存在着细胞毒性问题,为了解决这个问题,有研究使用乙酰氨基酚联合Erastin来诱导肺癌细胞铁死亡,结果显示,不论是在细胞模型和肺癌移植瘤模型中,乙酰氨基酚与Erastin均有较好的协同作用,可以显著诱导细胞铁死亡,而Erastin对其他细胞的毒性作用却显著下降[17]。其他的一些研究也深入探讨了Erastin诱导细胞铁死亡后对肺癌的治疗作用,如Erastin通过诱导GPX4介导的铁死亡而部分降低NSCLC细胞对放射治疗过程中的抗辐射能力[19]。Erastin诱导的活性氧激活p53,可以促进肺癌细胞的细胞毒作用,进而抑制细胞的增殖与迁移等[20]。上述结果表明,使用Erastin诱导肺癌细胞铁死亡后,可以通过多种途径抑制细胞的增殖与迁移,还可以增强对其他治疗的敏感性,为肺癌的治疗提供一种新的方法。
3.3 Erastin在卵巢癌中的应用 卵巢癌是一种恶性程度极高的生殖系统肿瘤,由于早期缺乏特异检测手段, 卵巢癌发病不易察觉,在中晚期阶段往往发展为复发性及多重耐药性疾病,而且预后较差,在妇科恶性肿瘤中成为死亡率最高的疾病[21]。越来越多的研究证明,Erastin诱导的细胞铁死亡与多种生物化学过程密切相关,可以通过剥夺癌细胞内的铁或者改变肿瘤组织铁离子代谢方式,抑制肿瘤组织增殖。有研究发现铁死亡在卵巢癌的发生发展中起着重要作用,将其视为卵巢癌的潜在治疗靶点[22],而药物外排转运多药耐药性蛋白(ATP-binding cassette subfamily B member 1,ABCB1)的过表达与癌细胞之间的多药耐药性相关。该项研究指出ABCB1的上调是生存不良的卵巢癌多西紫杉醇耐药性复发的原因。Erastin是一种靶向SLC7A11的新的特异小分子,在不改变ABCB1表达的情况下,显著提高了细胞内ABCB1底物水平[6,23]。因此,Erastin可以逆转卵巢癌中ABCB1介导的多西紫杉醇耐药性,这表明Erastin和多西紫杉醇的组合可能为卵巢癌耐化学药品的患者提供有效的给药方法。
3.4 Erastin在肝癌中的应用 铁死亡是铁依赖性脂质过氧化物介导的细胞死亡,可用于选择性清除受损细胞和恶性细胞[24]。有学者将二者联系进行了研究, MicroRNA-214-3p(miR-214)在肝癌的发展中起调节作用,但是miR-214在细胞铁死亡中的作用尚不清楚。为了阐明miR-214是否可以调节肝癌中的铁死亡,有研究在体外用Erastin干预HepG2和Hep3B癌细胞,结果细胞活力受到了明显抑制。此外,pre-miR-214的过表达导致HepG2和Hep3B细胞更易受Erastin的影响,而anti-miR-214的过表达则表现出相反的作用,阐明了Erastin可以抑制细胞活力,而且这一作用与pre-miR-214的含量密切相关[25]。与此同时,pre-miR-214的过表达增加了丙二醛和活性氧的含量,上调Fe2+浓度,致使暴露于骨蛋白的癌细胞中的谷胱甘肽水平降低。Erastin又可增强HepG2和Hep3B细胞中转录因子4(activating transcription factor 4,ATF4)的激活[26],并且pre-miR-214过表达抑制了ATF4的表达。荧光素酶报告基因数据证实ATF4是miR-214的直接靶标,用ATF4过表达质粒转染的癌细胞对miR-214诱导的铁死亡的敏感性较低。在体内,Erastin显著降低了异种移植肿瘤的大小和重量,而miR-214增强了异种移植物对促铁死亡的作用弹性蛋白的表达和降低了ATF4表达。大量研究表明,在肝癌细胞中促进铁死亡的作用至少归因于其对ATF4的抑制作用,而miR-214大大增强了Erastin对肝癌细胞的敏感性,这可能为治疗铁死亡的肝癌提供了新的靶点。
Erastin诱导细胞铁死亡的发生与多种生物化学过程密切相关,作为一种新型细胞死亡方式参与调节各大疾病的发生发展,在肿瘤中的作用尤为突出。在调节肿瘤细胞如卵巢恶性肿瘤、头颈部癌、弥漫性大B细胞淋巴瘤、肝癌,以及横纹肌肉瘤的生长和增殖中,铁死亡发挥了不可忽视的作用。细胞铁死亡的发现为治疗肿瘤提供了一种新的思路,即诱导细胞发生铁死亡来定向清除肿瘤细胞,可为临床诊疗带来巨大的参考依据和理论价值。
