LAMP法与PCR法在食品动物源性成分检测中的应用
2020-09-10徐帅郝琴代艳发陈宏波
徐帅 郝琴 代艳发 陈宏波

摘 要:目的:探讨和对比食品動物源性成分检测中环介导等温扩增法(LAMP)与实时荧光定量法(PCR)的应用价值。方法:于湖南省汨罗市各大超市抽取样品并将其作为试验材料,共抽检13份。抽检样品分别采用LAMP法与PCR法进行检测,观察并对比两种检测方法各样品提取DNA浓度的测定结果。结果:3种已知动物源性成分样品经LAMP检测显示阳性,且PCR检测也为阳性;LAMP法检测时13份样品中与标签明示肉源不符的样品共3份,而PCR法检测时有4份。两种检测方法检测结果显示1份样品检测结果不同。结论:LAMP法与PCR法在食品动物源性成分检测中均表现出显著的应用价值,准确性高,并且具备较好特异性,但本研究中LAMP总用时80 min,较PCR总用时140 min少,更方便进行现场快速抽检。
关键词:环介导等温扩增法;实时荧光定量法;食品;动物源性;成分检测
目前市场上检测食品动物源性成分的常见方法以环介导等温扩增法(LAMP)、实时荧光定量法(PCR)为主[1] 。本研究于湖南省汨罗市各大超市抽取13份标签明示含有鸡、猪、牛成分的样品进行分析,探讨和对比LAMP法与PCR法在食品动物源性成分检测中的应用价值。
1 材料与方法
1.1 材料
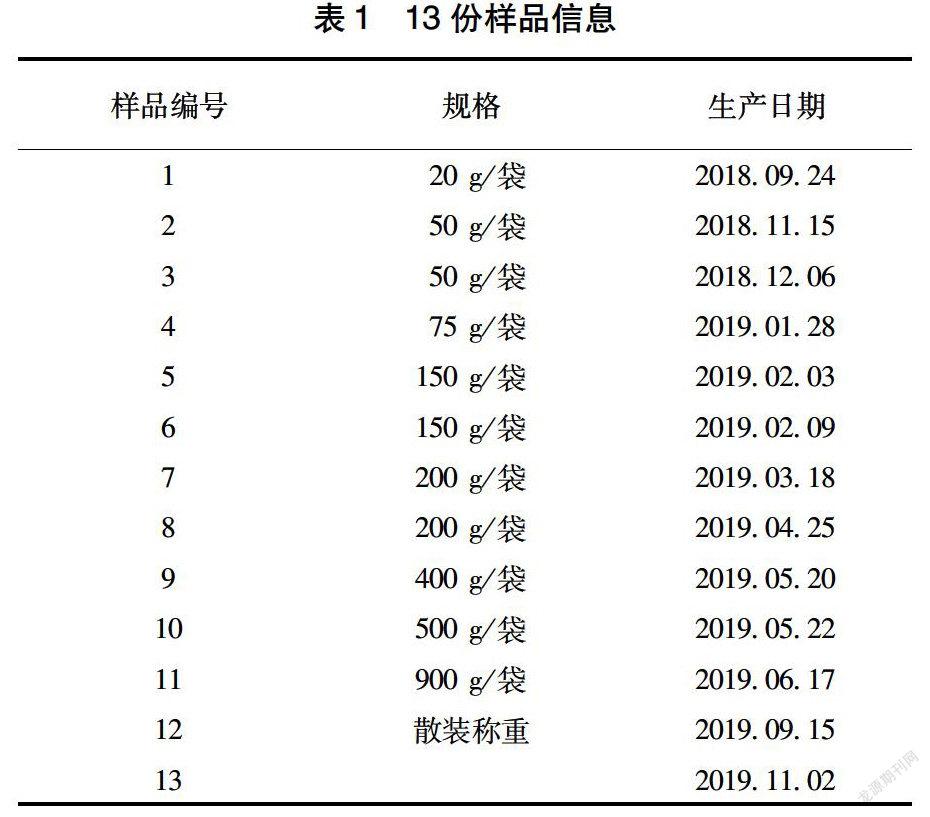
于湖南省汨罗市各大超市抽取样品并将其作为试验材料,共抽检13份,其中,混合肉制品共5份,标签明示仅含猪成分的5份,标签明示仅含牛成分的3份(表1)。
1.2 方法
1.2.1 试剂与仪器 (1)广谱型基因组DNA小量纯化试剂盒,Primerdesign生物公司;鸡源性、猪源性、牛源性成分实时荧光PCR检测试剂盒,Primerdesign生物公司。(2)动物组织基因组DNA快速提取试剂盒,赛默飞世尔科技(中国)有限公司;鸡源性、猪源性、牛源性检测试剂盒(恒温荧光法),赛默飞世尔科技(中国)有限公司。(3)1379型生物安全柜,赛默飞世尔科技(中国)有限公司;5417R型高速冷冻离心机,德国Eppendorf公司;MS3基本型圆周振荡器,莱贝(上海)科学仪器有限公司;实时荧光定量PCR扩增仪,美国ABI StepOne;308C型恒温荧光检测仪,广州迪澳生物科技有限公司;微量紫外分光光度计,德国Becman公司。
1.2.2 LAMP检测方法 (1)DNA提取方法:首先取0.5 g样品并加入磁珠以及1 mL的Buffer A试剂(深圳欣博盛生物科技有限公司)进行破碎处理,65 ℃下热浴30 min,以5 000 r/min的速度进行离心处理约5 min,取10 μL上清液加至新离心管中并加入1 mL的Buffer B试剂(上海玉博生物科技有限公司)混匀后得到DNA溶液[2] 。(2)鉴定鸡源性成分:依据说明书要求进行,其中,扩增条件:63 ℃ 45 min;扩增体系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反应液[3] 。(3)鉴定猪源性成分:依据说明书要求进行,其中,扩增条件:63 ℃ 45 min;扩增体系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反应液。(4)鉴定牛源性成分:依据说明书要求进行,其中,扩增条件:63 ℃ 45 min;扩增体系25 μL:1 μL Bst聚合酶,2 μL模板DNA,20 μL密封液,22 μL反应液。
1.2.3 PCR检测方法 (1)DNA提取及浓度测定:依据广谱型基因组DNA小量纯化试剂盒说明书中的步骤和要求提取,测定DNA浓度,记录测定结果[4] 。(2)鉴定鸡源性成分:依据试剂盒说明书中的步骤和要求进行,其中,扩增体系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),补足25 μL ddH2O;扩增条件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,扩增40个循环并于退火时收集荧光[5] 。(3)鉴定猪源性成分:依据试剂盒说明书中的步骤和要求进行,其中,扩增体系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),补足25 μL ddH2O;扩增条件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,扩增40个循环并于退火时收集荧光。(4)鉴定牛源性成分:依据试剂盒说明书中的步骤和要求进行,其中,扩增体系25 μL:12.5 μL Premix,1 μL Primer Mix,1 μL Probe Mix,l μL模板DNA(10 ng/μL),补足25 μL ddH2O;扩增条件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 30 s,扩增40个循环并于退火时收集荧光。
1.3 观察指标
(1)分析两种检测方法检测结果,在两种检测方法中,均将灭菌水作为空白对照,并且阴性对照为非目标肉中所提取的DNA,阳性对照为鸡肉、猪肉、牛肉所提取的DNA[6] 。(2)观察本研究所选13份样品提取DNA浓度的测定结果,在检测过程中取3 μL待测DNA溶液置于核酸蛋白测定仪,测定其浓度并进行对照,其中空白对照仍为灭菌水[7] 。(3)对比两种检测方法测定结果。
1.4 统计学方法
各项基线资料及研究数据均由SPSS 21.0软件进行分析。样本率、计量资料分别采用χ2、t检验,并分别采用百分率(%)、均数±标准(±s)表示,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 LAMP检测结果分析
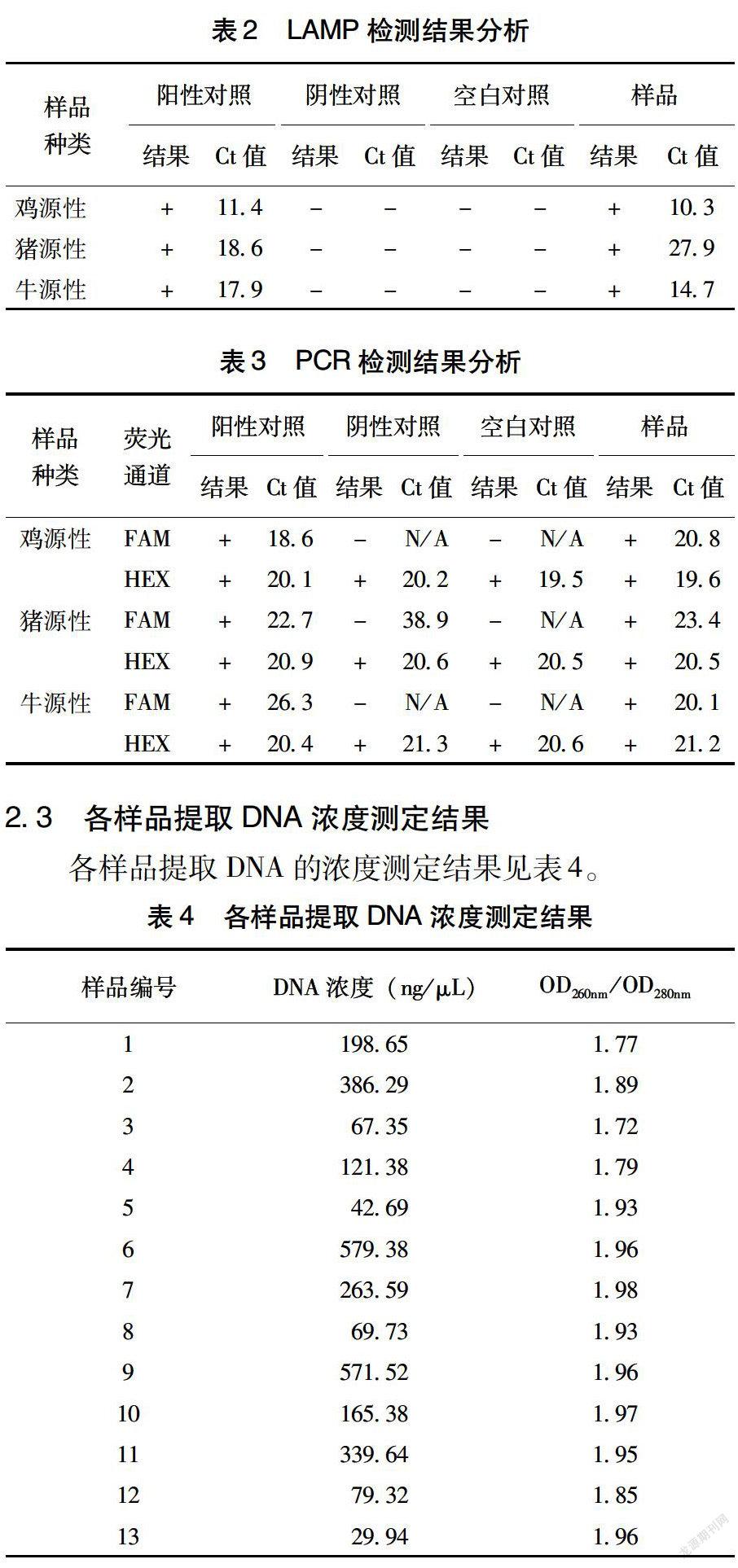
表2数据显示,3种已知动物源性成分样品检测结果均为阳性。
2.2 PCR检测结果分析
表3数据显示,3种已知动物源性成分样品检测结果均为阳性。
2.3 各样品提取DNA浓度测定结果
各样品提取DNA的浓度测定结果见表4。
2.4 LAMP法与PCR法测定结果对比
表5数据显示,13份检测样品中,LAMP法检测时13份样品中与标签明示肉源不符的样品共3份,而PCR法检测时有4份,有1份样品检测结果不同。
3 讨论
刘娜等[8]研究中曾提出,食品药品检验所等监管部门工作的落实是有效打击肉制品不法掺杂、掺假行为的基础,并认为食品动物源性成分检测具有准确的指导和判断价值。近年来,我国生物技术及现代仪器分析技术不断发展,在很大程度上指导了食品动物源性成分检测的方向。目前,食品动物源性成分检测主要是采用基于核酸的分子生物学技术进行检测,取得了较为理想的效果[9] 。LAMP与PCR技术近年来应用广泛,刘艳艳等[10]在研究中建立了驴、马、驴骡和马骡皮张四重荧光PCR检测体系,为羊肉及牛肉的源性成分检测提供了参考。PCR技术被广泛应用于动物源性成分检测中[11] 。但PCR技术对DNA模板的质量要求较高,并且检测时间长、需要昂贵的仪器设备,因此使用存在一定局限性。
LAMP是一门新兴的基因扩增技术,余艳玲等[12]研究中曾采用LAMP技术对罗非鱼无乳链球菌(GBS)进行快速检测,结果表明,LAMP技術具有较高的灵敏度、特异性、稳定性,应用效果较为理想。此外,时建立等[13]也建立了猪源性成分LAMP检测方法,发现LAMP技术灵敏度较PCR方法来说高出接近2~5个数量级,虽然该技术较qPCR方法来说低10倍,达到5.928×10-3 μg/μL,但其反应时间短,最快10 min即可完成反应,成本低,不需专门的仪器,因此更适合食品安全监管部门进行现场快速监督抽检。需要注意的是,LAMP技术虽然操作简单且准确性高,但由于该技术采用粗提方式提取DNA,而且易受样品基质及加工工艺对所提取的核酸质量的影响,因此针对部分步骤还需进一步完善,最大程度降低检测误差[14] 。本研究两种检测方法检测结果显示1份样品检测结果不同。这一研究与唐善虎等[15]为研究快速鉴别熟制牦牛肉饼中猪肉和鸡肉的成分所建立的LAMP检测体系基本一致。
综上所述,LAMP法与PCR法均可在食品动物源性成分检测中使用,但考虑到市场抽检的特殊性,一般选择耗时短且操作更简单的PCR法进行检测,实用价值更高。◇
参考文献
[1]丽牧.实时荧光定量PCR法检测新城疫病毒的方法建立[J].食品安全导刊,2017(3):136-138.
[2]刘娜,杨滴,韩东.食品中鹅源性成分实时荧光PCR检测方法的建立[J].肉类工业,2016(10):37-39.
[3]Mohon A N,Lee D Y,Bayih A G,et al.NINA-LAMP compared to microscopy,RDT,and nested PCR for the detection of imported malaria[J].Diagnostic Microbiology & Infectious Disease,2016,85(2):149-153.
[4]齐春萌,杨昕霆,薛晨玉.实时荧光PCR法检测食品中梅花鹿成分[J].食品与生物技术学报,2016,35(10):1088-1092.
[5]黄梦诗,等.海水中副溶血弧菌的可视化LAMP快速检测方法[J].中国渔业质量与标准,2017,7(6):58-65.
[6]马芳,张庆利,万晓媛.基于LAMP技术的对虾白斑综合征病毒现场快速高灵敏度检测试剂盒的评价[J].中国预防兽医学报,2016,38(4):316-321.
[7]霍胜楠,等.3种食源性致病菌的实时荧光PCR快速检测[J].食品研究与开发,2016,37(16):143-147.
[8]刘娜,赵新,陈锐.动物肌肉组织DNA的提取方法及实时荧光定量PCR检测[J].食品工业科技,2016,37(18):74-80.
[9]杨艳,等.PCR技术在肉类成分定量分析中的应用研究进展[J].食品工业科技,2016,37(17):360-365.
[10]刘艳艳,张全芳,卞如如.利用多重荧光定量PCR检测阿胶原料驴、马、驴骡和马骡皮张的源性[J].药学研究,2016,35(10):569-574.
[11]钱云开,等.实时荧光PCR法快速检测肉类中貉源性成分[J].中国食品卫生杂志,2016,28(5):602-605.
[12]余艳玲,彭昊,冯世文.罗非鱼无乳链球菌环介导等温扩增(LAMP)检测技术的建立及应用[J].江苏农业科学,2019,47(13):200-203.
[13]时建立,等.猪流行性腹泻病毒LAMP检测方法的建立及初步应用[J].中国动物检疫,2016,33(7):82-85.
[14]夏雪娟,郑炯,叶秀娟.实时荧光定量PCR技术监测腌制麻竹笋中乳酸乳球菌动态变化[J].食品科学,2016,37(4):88-92.
[15]唐善虎,李雪,王柳.用LAMP法快速鉴别熟制牦牛肉饼中的猪肉和鸡肉成分[J].西南民族大学学报(自然科学版),2018,44(3):237-242.
Abstract:Objective To explore and compare the application and value of Loop Mediated Isothermal Amplification(LAMP)and Real-time Fluorescence Quantification(PCR)in the detection of food animal derived ingredients.Method A total of 13 samples were collected from supermarkets in Miluo city in Hunan province.Sampling samples were detected by LAMP method and PCR method respectively.The detection results of DNA concentration extracted from each sample were observed and compared.Result The samples of three known animal origin components were positive by LAMP test,and PCR test was also positive.Among 13 LAMP test,there were 3 samples inconsistent with the meat source indicated by the label,while 4 samples were detected by PCR.The results of the two methods showed that the results of one sample were different.Conclusion Both LAMP method and PCR method have significant application value,high accuracy and good specificity in the detection of food animal derived ingredients,but the total time of LAMP is 80 min less than that of PCR 140 min,which is more convenient for spot rapid sampling.
Keywords:Loop Mediated Isothermal Amplification(LAMP);Real-time Fluorescence Quantitative Method(PCR);food;animal origin;component detection
