4型禽腺病毒HLJ1701株灭活疫苗的研制
2020-09-10朱庆贺苗艳杨旭东王爽张鹏宇陈曦王观悦史同瑞
朱庆贺,苗艳,杨旭东,王爽,张鹏宇,陈曦,王观悦,史同瑞
(黑龙江省农业科学院畜牧兽医分院,黑龙江齐齐哈尔 161005)
4型禽腺病毒是指禽腺病毒1亚群血清4型,能够引起鸡心包积水。该病的特征性症状为心包出现淡黄色透明液体,同时也会出现如肝脏肿胀、肾脏水肿、尿酸盐沉积等临床症状,因此临床中称为鸡心包积水综合征。该病最早在巴基斯坦的安卡拉首先被报道,因此又称安卡拉病,其后在斯洛伐克、印度、墨西哥、秘鲁、俄罗斯、孟加拉国、韩国相继出现[1]。2006年该病第一次在中国被报道[2],2015年7月开始在我国的河南、河北、新疆、安徽、山东、江西、湖北和江苏等省份迅速传播[3-4]。该病主要发生在炎热湿润的夏季,但其他季节也可零星发生,发病率和死亡率可高达40%~90%[5]。自2016年以来黑龙江省部分地区出现流行[6],给该省养鸡业造成严重经济损失。鉴于当前4型禽腺病毒的严重情况,迫切需要研发针对性疫苗,以加强对4型禽腺病毒感染的有效防控。因此,本研究利用在黑龙江省发病鸡场分离的4型禽腺病毒(HLJ1701株)进行了灭活疫苗的研制。
1 材 料
1.1 毒株 4型禽腺病毒(HLJ1701株)由黑龙江省农业科学院畜牧兽医分院兽药研究室分离并保存。
1.2 实验动物 SPF鸡胚、种蛋及SPF雏鸡购自哈尔滨维科生物技术有限公司,自行孵化至适合日龄使用。
1.3 佐剂 注射用白油、司本-80、吐温-80,均购自天津市巴斯夫化学试剂有限公司。
2 方法
2.1 抗原制备 4型禽腺病毒(HLJ1701株)用生理盐水作104倍稀释,经尿囊腔接种9日龄SPF鸡胚,0.2 mL/枚,置37 ℃孵育72 h,24 h内死亡为非特异性死亡,废弃不计,收获后测定LD50应不小于10-5.49。按照以上方法分别制备3批病毒液,批号分别为FAdV4-1、FAdV4-2、FAdV4-3。
2.2 病毒液灭活 4型禽腺病毒(HLJ1701株)病毒液中加入甲醛(终浓度0.3%),37 ℃灭活24 h,灭活后的病毒液置于2~8 ℃保存。
2.3 半成品检验
2.3.1 无菌检验 按照《中华人民共和国兽药典》(2015版)对样品进行检验,应无细菌生长,检验不合格应废弃。
2.3.2 病毒含量测定 将灭活前的病毒,做10倍系列稀释,0.2 mL/只定量接种2周龄SPF鸡,每个稀释度接种6只,观察记录实验动物死亡数,直至攻毒后14 d,计算各稀释度死亡实验动物的百分率。按Reed-Muench法计算LD50。
2.3.3 灭活检验 取灭活后的HLJ1701株病毒液,尿囊腔内接种9~11日龄SPF鸡胚10枚,每胚0.2 mL,37 ℃继续孵育,剔除24 h内死亡鸡胚,观察3日,鸡胚非特异性死亡不应超过2枚。收获所有鸡胚的胚液,颈部皮下接种10只2周龄SPF鸡胚,应全部无异常。
2.4 疫苗配制
2.4.1 油相制备 取优质注射白油96份,司本-80 4份。先将白油缓缓加温,加入4%的司本-80,边搅拌边加温,直到充分溶解至透明,高压灭菌备用。
2.4.2 水相制备 取疫苗抗原(灭活鸡胚尿囊液)96份加入灭菌后的吐温-80 4份,开始搅拌直至全部溶解为止,制成水相。
2.4.3 乳化 将油相与水相按2∶1的比例利用IKA乳化机25000 r/min乳化5 min。批号分别为20170711、20170824、20170913。
2.5 成品检验
2.5.1 性状 按照《中华人民共和国兽药典》附录对疫苗的外观、剂型、稳定性和黏度等性状进行检验。
2.5.2 装量检查 按《中华人民共和国兽药典》附录进行装量检查。
2.5.3 无菌检验 按《中华人民共和国兽药典》附录进行无菌检验。
2.5.4 安全检验 取3周龄SPF鸡15只,每只肌肉或颈部皮下注射疫苗1 mL,观察14 d,记录是否出现局部或全身不良反应。
2.5.5 效力检验
2.5.5.1 血清学方法 取3周龄SPF鸡40只,其中30只分别利用3批次疫苗进行颈部皮下接种,每批次10只,0.2 mL/只,另10只作不免疫接种对照。接种后21 d,分别采血分离血清,使用ELISA检测抗体效价。
2.5.5.2 免疫攻毒法 取3周龄SPF鸡40只,其中30只分别利用3批次疫苗进行颈部皮下接种,每批次10只,0.2 mL/只,另10只作不免疫接种对照。接种后21 d,将免疫鸡连同10只对照鸡,分别通过皮下接种病毒液,0.2 mL/只(含100 LD50),连续观察10 d后分别采集试验鸡的肝脏组织进行病毒分离。
3 结果与分析
3.1 半成品检验 在实验室条件下连续制备了3批病毒液,批号分别为FAdV4-1、FAdV4-2、FAdV4-3。检验结果显示,3批病毒液的病毒含量(LD50)在10-5.49~10-5.66之间,病毒液经0.3%甲醛液在37 ℃灭活24 h后,均可灭活完全(表1)。

表1 病毒液半成品检验结果Tab 1 The detecting result of virus antigen
3.2 性状检验 经检验,制备的3批4型禽腺病毒灭活疫苗批号分别为20170711、20170824、20170913均为乳白色乳剂,油包水型,将疫苗置3000 r/min离心15 min,管底无水相析出,3批疫苗的黏度均在50 cP以内(表2)。

表2 3批实验室制品性状检验结果Tab 2 The physical characteristics result of 3 batch of products
3.3 装量检查 经检查,所制备的3批次4型禽腺病毒灭活疫苗的装量均为250 mL以上,符合规定(表3)。
表3 装量检查结果Tab 3 Filling inspection results
3.4 无菌检验 经检验,所制备的3批4型禽腺病毒灭活疫苗均无细菌生长,检验合格。
3.5 安全检验 将所制备的3批4型禽腺病毒灭活疫苗分别经颈部皮下接种3周龄SPF鸡,试验鸡接种后均全部健活,未出现局部或全身不良反应。
3.6 效力检验 试验结果显示,3批4型禽腺病毒灭活疫苗免疫3周龄SPF鸡后21 d,抗体平均效价可达到28以上,使用4型禽腺病毒(HLJ1701株)进行攻毒,攻毒后各免疫鸡均全部存活,攻毒10 d后分别采集试验鸡的肝脏组织进行病毒分离,均为阴性,3批疫苗对免疫鸡的攻毒保护率均为100%;对照鸡在攻毒后4 d内均全部发病死亡(表4和表5)。
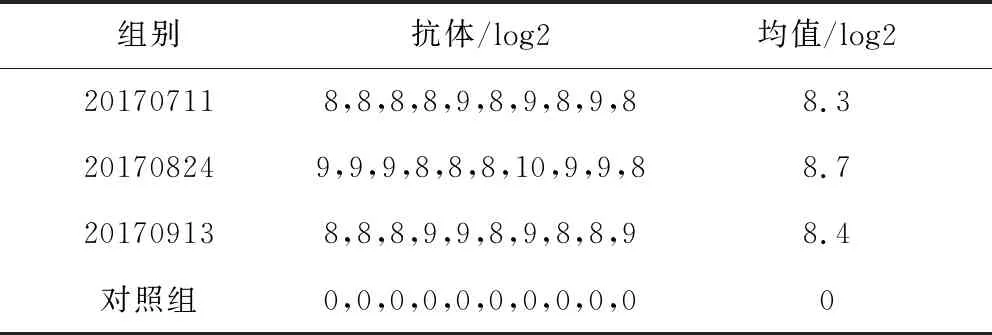
表4 抗体检测结果Tab 4 Results of Antibody test
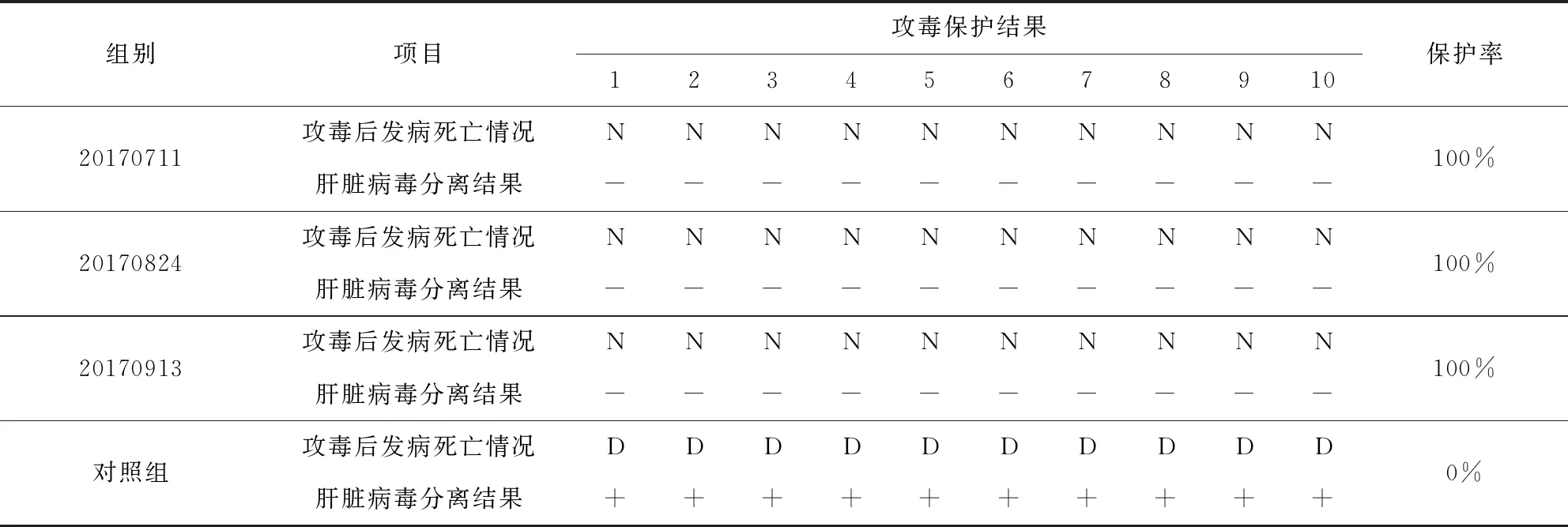
表5 3批4型禽腺病毒灭活疫苗对HLJ201701株的攻毒保护试验Tab 5 The result of virus challenge experiment with strain HLJ201701 of 3 batch virus vaccine
4 讨论与结论
不同于其他大部分禽类病毒,4型禽腺病毒不具备使鸡、大鼠和小鼠红细胞凝集的能力[7],不过Manzoor S 利用人O型红细胞血凝抑制试验进行了野生鸟类中4型禽腺病毒的血清抗体情况调查[8],说明4型禽腺病毒能够使人O型红细胞凝集,但是人O型红细胞获取较为困难,不适宜生物制品生产的实践应用,因此本研究未应用凝集试验进行抗体滴度检测。ELISA方法是实验室诊断中常用的抗体检测方法[9-10],本研究中利用黑龙江省农业科学院畜牧兽医分院兽药研究室建立的ELISA方法对疫苗抗体进行了检测[10],结果表明ELISA检测方法可以完成疫苗抗体检测任务,而且灵敏度高,测定准确。
目前已有其他4型禽腺病毒灭活疫苗制备的报道[11-13],但疫苗免疫成功最主要的因素之一就是免疫毒株基因型的吻合。本研究利用黑龙江地区4型禽腺病毒分离株HLJ1701进行了灭活疫苗的研制,利用MEGA7软件进行分离株HLJ1701遗传进化分析,结果显示分离株序列与国外的分离株同源性差异较大,与加拿大分离株(GenBank: GU188428.1)核苷酸序列同源性仅为96.00%,氨基酸同源性仅为88.70%;与Meng K等[13]用于制备灭活疫苗的中国山东分离株(GenBank: MN102413.1,分离于2017年8月)核苷酸同源性较高,为98.80%,但氨基酸同源性仅为91.40%,其中hexon蛋白第367-395位氨基酸序列有明显差异。不同地区分离毒株序列可能具有地域特异性,基因序列的差异引起氨基酸序列的改变,进而影响蛋白质结构,尤其是具备抗原决定簇的hexon蛋白的改变极大可能影响疫苗的免疫效果,因此利用本地区毒株进行疫苗制备更具地域优势,也更具有针对性。本研究利用黑龙江地区分离毒株制备疫苗可能更适于黑龙江地区4型禽腺病毒的免疫防治。
本研究利用分离株HLJ1701进行了灭活疫苗的研制,结果表明自制的灭活疫苗均符合药典规定,而且疫苗的保护率达到100%,可以为临床4型禽腺病毒的疫苗制备及临床防控提供参考。
