2种试剂对水中亚硝酸盐氮的测定方法分析
2020-09-03杨凌烽
杨凌烽
(福建省安溪县自来水公司 福建泉州 362400)
1 前言
亚硝酸盐氮是水中含氮有机物氧化分解成硝酸盐的中间产物,若水中发现亚硝酸盐,则代表水中的含氮有机物分解过程仍在局限;若水中亚硝酸盐的含量过高,代表水中含氮有机物的氧化分解过程极为强烈,表明水中可能存在有机物污染。
2 试验原理及设备
2.1 试验材料及设备
试验材料:自来水;氨基苯磺酰胺;N-(1-萘基)-乙二胺。
设备:752紫外分光光度计。
2.2 试验原理
试验中采用二者的混合试剂对自来水中的亚硝酸盐氮进行测定,且所采用的试剂组成大致相同,区别仅在于pH的差异性。试剂1的pH为1.8,试剂2的pH则在1.7以下。
其中,试剂1中的氨基苯磺酰胺可以在磷酸介质中及pH为1.8时,与自来水中的亚硝酸盐氮发生反应,进而产生重氮盐,之后重氮盐将会与N-(1-萘基)-乙二胺发生偶合反应生成红色染料,最后,将紫外分光光度计的测定波长调整到540 nm,对红色颜料的浓度进行测定分析。
在试剂2中,自来水中的亚硝酸盐将会先与氨基苯磺酰胺发生化学反应,生成重氮盐,然后再与N-(1-萘基)-乙二胺发生偶合反应,生成紫红色的染料,最后将紫外分光光度计的测定波长调整到540 nm,对紫红色染料的浓度进行测定分析[1]。
3 试验方法及过程
3.1 试剂制备
3.1.1 试剂1制备
在烧杯中加入250 mL纯净水、50 mL磷酸和20 g氨基苯磺酰胺,用搅拌棒充分搅拌,在烧杯中加入1 g N-(1-萘基)-乙二胺,继续进行搅拌,待溶液内没有明显的固体物质后,将溶液转移到容量瓶中,并向容量瓶中加入纯净水,轻轻摇匀,最后将摇匀后的溶液转移到棕色试剂瓶中保存待用[2]。
3.1.2 试剂2制备
在烧杯中加入350 mL盐酸溶液,将5 g氨基苯磺酰胺溶解到盐酸溶液中,并向加入氨基苯磺酰胺的盐酸溶液中加入纯净水进行稀释,直至水位线达到 500 mL即可停止,将0.2 g N-(1-萘基)-乙二胺溶入到200 mL的纯净水中,制备N-(1-萘基)-乙二胺溶液,之后将溶液转移到棕色瓶中,置于冰箱中保存待用。在配制N-(1-萘基)-乙二胺溶液时,若发现配制成的溶液颜色比较深,应重新进行N-(1-萘基)-乙二胺溶液配制工作,以保证试验结果的科学性与精准性。
3.2 试验方法及过程
3.2.1 试剂1的试验方法及过程
取8个容量瓶,分别在5个容量瓶中加入浓度为0.1 g/mL的亚硝酸盐溶液,为确定不同亚硝酸盐浓度下试剂所产生的变化情况,在5个容量瓶中分别加入0、0.5、2.5、5.0、7.5 mL 的亚硝酸盐溶液,之后分别在容量瓶中加入纯净水,使容量瓶中的水位达到50mL。之后在完成稀释的5个容量瓶中分别加入1 mL N-(1-萘基)-乙二胺溶液,将溶液摇匀混合,静置20min,最终通过紫外分光光度计测定试剂1溶液在10 min~2 h内的吸光度,确定测定效果,与试剂2所得结果进行分析对比。
3.2.2 试剂2的试验方法及过程
取8个容量瓶,并分别在5个容量瓶中加入浓度为0.1 g/mL的亚硝酸盐溶液,具体加入量分别为0、0.5、2.5、5.0、7.5 g/mL。 利用纯净水将容量瓶中的溶液水位稀释到50 mL的位置,充分摇匀。在自来水中加入前期所制备待用的氨基苯磺酰胺溶液1 mL,之后将其摇匀,静置2~8 min,再加入制备完成的N-(1-萘基)-乙二胺溶液,加入后立即摇匀,确保溶液的均匀分布性。最后,通过紫外分光光度计测定试剂2溶液在10 min~2 h内的吸光度,确定测定效果,并将结果与试剂1的结果进行对比分析[3]。
3.2.3 亚硝酸盐氮的计算方法
亚硝酸盐氮的计算公式为:

其中:ρ—水中亚硝酸盐氮的含量,mg/L;A—水样在经过测量后所获取到的水样吸光度减去空白吸光度后所得到的值;C—亚硝酸盐的标准溶液浓度,mg/L;b—标准曲线的相关系数;V—水样的体积,L。
4 2种试剂对比试验分析
4.1 2种试剂吸光度的空白对比试验
在试验过程中,为有效确保试验的精准性和科学性,在氨基苯磺酰胺溶液加入完成的10 min后再加入N-(1-萘基)-乙二胺溶液,有效平衡2组试验的反应时间,2种试剂的对比结果详见表1。
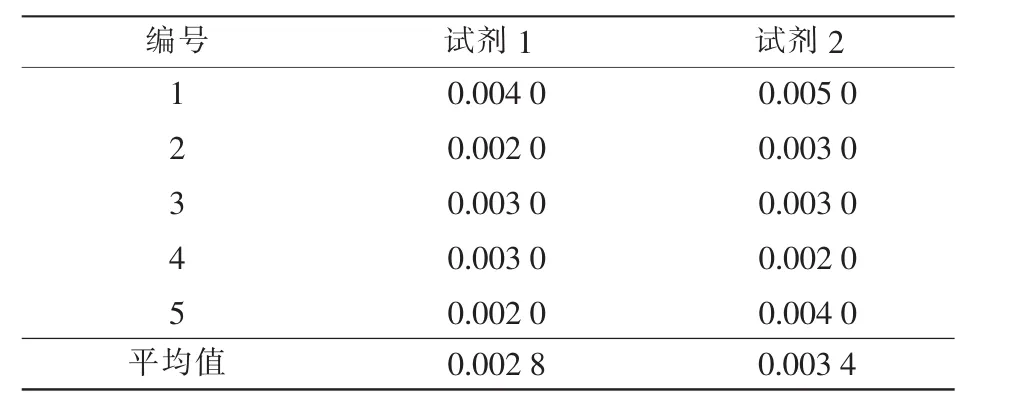
表1 2种试剂吸光度的空白对比试验结果
由表1可知,2种试剂的吸光度空白对比试验结果差异不大,从实际操作方法及流程来看,试剂1的操作流程更少,在试验过程中仅需要加入一种试剂,从操作便捷性和成本性考虑,应在试验中尽可能选用试剂1作为试验试剂。
4.2 2种试剂标准曲线对比分析
根据GB/T 5750.1—2006《生活饮用水标准检验方法 总则》[4]的相关规定,要求所检验的试验样本应确保标准曲线和标准溶液体积保持一致,且所获得数据的相关系数要符合要求标准,以确保研究的科学有效性,2种试剂标准曲线值详见表2、表3。
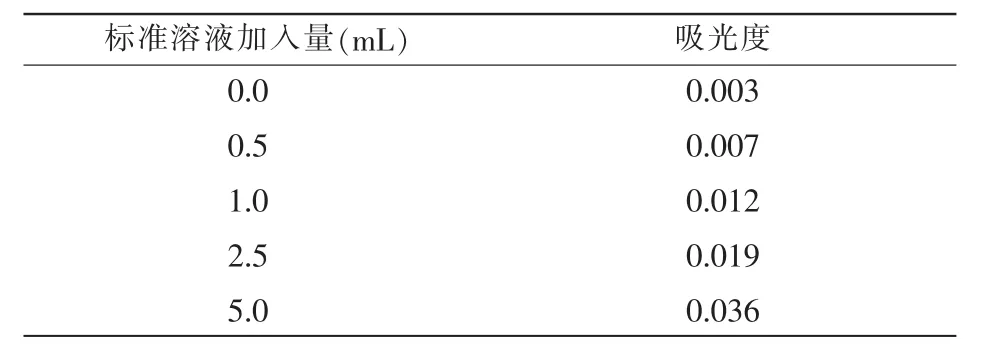
表2 试剂1实际工作曲线值
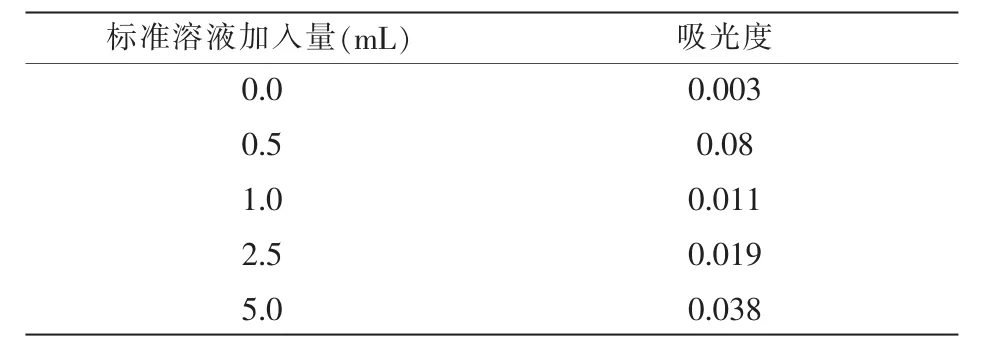
表3 试剂2实际工作曲线值
表2中,试剂工作曲线的斜率r=0.999 3;标准曲线的相关系数b=0.007;基于t分布理论推导出相关数据发现差异性的概率t=0.327 9;标准曲线的浓度 c=0.10 mg/L。 表 3 中,r=0.9992;b=0.007;t=0.6812;c=0.10 mg/L。由表2和表3可知,2种试剂的试验标准曲线和标准溶液体积基本保持一致,从b值和t值来看,2种数据的相关数值符合规定要求,由此可以推断,2种试剂均适用于对水中用硝酸盐氮的测定工作,并能够取得良好的测定效果。
4.3 标准样本检验
为进一步确定标准样品的实际检验效果,还需要对标准样的精密度进行确定。从5组试验中选取出4组具有代表性的试验结果作为验证标准值,并以此为基础来进行精密度检测,具体检验结果详见表4。

表4 标准样品检验结果
根据我国现行法律法规来看,对于标准样品真值范围应控制在(0.068 4±0.004 2)mg/L以内,由表4可知,2种试剂的标准样品检验结果平均值分别为0.067 2 mg/L和0.071 1 mg/L,二者均处于标准样品真值范围内,可以确定测得的标准样本参数均符合我国现行法律法规要求。
4.4 普通水样测定
为进一步确定2种试剂在实际水样测定过程中的应用效果,试验选取5种来自不同检测点的水样,分别使用2种试剂依据上文中的试验方法及流程进行操作,完成水样的实际测定工作,最终获得普通水样测定结果,详见表5。

表5 2种试剂对普通水样的检验结果
由表5可知,在实际应用过程中,2种试剂所得的最终检测结果差异不大。但对上文进行归纳汇总后可以发现,试剂2在实际测定过程中需要加入2种试剂,而试剂1在实际测定过程中仅需要加入一种试剂,试剂2的操作流程要比试剂1复杂,2种试剂对水中亚硝酸盐氮含量值的测定也均处于国家现行标准的允许误差范围内[5],试剂1中所使用的试剂溶液为磷酸,相对于试剂2中所选用的盐酸溶液对环境的污染性更小,最终在多方面综合考虑之后可以确定,试剂1的应用范围比试剂2的应用范围更广,所以在进行实际水样测定时,应首先选用试剂1作为试验检测试剂,而试剂2则作为备用选项或者对比选项。
5 结语
随着社会经济的不断发展,当今社会对生活用水的实际需求也在不断提升,在此背景下,相关工作人员必须要提高对水样检验的精准度,并严格遵循现行行业标准进行操作,确保检验结果的科学合理性。且应确保溶液稀释用水为不含亚硝酸盐氮的纯净水,在试验过程中,由于亚硝盐酸盐氮为中间产物,状态极不稳定,所以需要在最短的时间内完成测定工作。在进行N-(1-萘基)-乙二胺溶液配制时,若所配制完成的溶液颜色比较深,为保证试验结果的科学性与精准性,应重新进行N-(1-萘基)-乙二胺溶液的配制工作。
