盐度对仿刺参免疫指标的影响
2020-08-31王玉凤胡雅潇张红斌仇雪梅
王玉凤,杨 金,胡雅潇,张红斌,丁 君,王 荦,仇雪梅
盐度对仿刺参免疫指标的影响
王玉凤1,杨 金1,胡雅潇1,张红斌1,丁 君2,王 荦2,仇雪梅1
(1.大连海洋大学水产与生命学院,辽宁 大连 116023;2. 大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
【】研究不同盐度下对攻毒灿烂弧菌()前后的仿刺参免疫指标的影响。将平均体质量(6.16 ± 1.86)g的仿刺参150头随机分为5组,分别置于盐度25、27、29、31、33的海水中暂养,注射200 μL 3.98×108CFU/mL致病菌,在0、6、12、24、48 h采集体腔液,测定相关免疫指标。攻毒前,各盐度下仿刺参超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、过氧化氢酶(CAT)、呼吸暴发力(RB)差异不显著(> 0.05)。仿刺参吞噬活力在盐度25、27、29、31条件下,随盐度的升高吞噬活力显著升高(< 0.05),盐度33条件下,仿刺参吞噬活力随盐度的升高而降低;仿刺参酚氧化物(PO)活力在盐度25、27、29条件下,随盐度的升高PO活力显著升高(< 0.05),盐度31、33条件下,仿刺参PO活力随盐度的升高而降低。攻毒后,仿刺参SOD活力变化明显,盐度25、27、33条件下,仿刺参SOD活力在48 h显著降低(< 0.05),盐度29、31条件下,攻毒后仿刺参SOD活力显著降低时间提前;仿刺参ACP活力变化明显,盐度25、27条件下,攻毒后仿刺参ACP活力在12 h显著升高(< 0.05),盐度29、31、33条件下,攻毒后仿刺参ACP活力在6 h显著升高(< 0.05);CAT活力无变化规律;盐度25、27条件下,攻毒后仿刺参吞噬活力在6 h显著升高(< 0.05),盐度29、31条件下,攻毒6、12、24、48 h后与0 h相比仿刺参吞噬活力无显著性差异(> 0.05);盐度对仿刺参RB有显著性影响(< 0.05),但无变化规律;攻毒后,不同盐度下的仿刺参PO活力在不同时间点较0 h均有升高,但没有规律性。盐度对仿刺参的吞噬活力、PO的影响,可以为选择适宜盐度水域养殖仿刺参提供依据;仿刺参在攻毒灿烂弧菌后SOD、ACP具有较高的敏感性。
仿刺参;免疫相关酶;盐度;灿烂弧菌
仿刺参()属于棘皮动物门,海参纲,循手目,刺参科,仿刺参属,其性温补,足敌人参,是药食两用的海珍品[1]。仿刺参作为我国北方沿海地区重要的经济品种,其养殖现已成为辽宁和山东省重要的支柱产业之一。仿刺参养殖业在迅速发展的过程中,病害问题频发,严重制约产业的可持续发展[2-3]。近年来,在我国辽宁大连、山东荣成、蓬莱等养殖区常常暴发明显的腐皮溃烂症,导致仿刺参大规模死亡[4]。
仿刺参健康状态主要受到环境因子和病害的影响。环境因子对水生动物的摄食、生长发育、代谢和免疫等方面有很大的影响。常见的环境因子如:盐度、温度、pH、光照、溶解氧等[5]。其中,盐度是影响水生生物生长、发育、繁殖以及分布的重要环境因子[6]。在自然环境中,由于养殖海域位于潮间带、可流淡水的流入、夏季汛期的来临造成盐度波动变化,而仿刺参体腔中不具有特定的器官来调节渗透压[7],导致渗透压的改变,进而引起免疫力下降,增加感染病原微生物的几率[8-9]。外来入侵的微生物致病菌对机体的致病影响是直接的。Deng等[10]发现“腐皮综合征”是由不同种类的病原菌共同引起。李强等[11]列举了9种与仿刺参患病有关的细菌性病原致病菌。其中,由灿烂弧菌引起的“腐皮综合征”最为严重[12];灿烂弧菌具有强致病力、传染性和死亡率,患病仿刺参出现肿嘴、黏附力下降、皮肤溃烂最后死亡,溶化为鼻涕状的胶体等症状[13]。
仿刺参的免疫防御主要是通过体液和细胞免疫协同介导,即机体对外来入侵物进行识别、吞噬、包裹、分泌一些免疫因子完成自身防御功能以及对创口进行修复[14-15]。可用来衡量仿刺参生长状况的免疫指标主要有酸性磷酸酶(ACP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酚氧化酶(PO)、吞噬活力和呼吸暴发力[16]。
为了解盐度对仿刺参免疫力的影响,本研究对不同盐度条件下,攻毒灿烂弧菌前后的仿刺参进行免疫指标的测量和分析。旨在发现盐度对仿刺参免疫指标影响的变化规律,找到适合仿刺参生存的盐度范围,以及在感染灿烂弧菌后仿刺参不同时间的各项免疫指标的变化规律,为建立仿刺参抗灿烂弧菌病害预警模型提供参考。
1 材料与方法
1.1 实验材料
健康养殖仿刺参150头,7月龄,体质量约(6.16 ± 1.86)g,购自于鑫玉龙生物有限公司。所用致病菌灿烂弧菌()菌株,由辽宁省农业科学院大连生物技术研究所提供。
1.2 方法
1.2.1 实验设计 实验在大连海洋大学农业部北方海水增养殖重点实验室,规格为290 mm × 220 mm × 337 mm,15 L的水族箱中进行。
实验设33、31、29、27、25等5个盐度梯度;实验用水为盐度31.5的天然海水,用经充分曝气的自来水、海水晶调盐度,经便携式溶解氧测量仪(YSI)测量与校对,配制48 h后使用。水温12 ℃,密度为15头/箱,饲养3 d,连续充气。
暂养结束后,采用体腔注射方式,注射经2216E培养基活化后的200 μL灿烂弧菌,菌液浓度为3.98×108CFU/mL。在注射后0(未攻毒前记为0 h)、6、12、24、48 h分别采集体腔液,每次取3头,用于免疫指标的测定,并比较攻毒前及攻毒后各时间点、各盐度之间的变化情况。
1.2.2 样品的制备 采用“断尾法”[17],在冰浴条件下,5个时间点分别采集仿刺参的体腔液,部分体腔液加入等体积的抗凝剂(0.48 mol/L NaCl,0.019 mol/L KCl,0.02 mol/L EGTA,0.068 mol/L Tris-HCl,pH = 7.6),制成仿刺参体腔细胞抗凝液[18-19],用于吞噬活力和呼吸暴发力的测定;另一部分以4 ℃、3 000离心10 min,取上清液分装,制得无细胞体腔液,保存于-20 ℃,用于其他免疫酶活力的测定。
1.2.3 免疫酶活力测定 使用南京建成生物工程研究所的试剂盒(编号分别为A001-1-2,A060-2-2,A007-1-1)测定超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、过氧化氢酶(CAT)免疫酶活力,SOD活力的测定采用羟胺法,ACP活力的测定采用磷酸苯二钠法,CAT活力的测定采用钼酸铵比色法,均按试剂盒说明书操作,每个样本重复3次。酚氧化物酶(PO)活力的测定参考Ashida M[20]和张琴[21]的方法,每个样本做3次重复。
1.2.4 吞噬活力的测定 仿刺参体腔细胞的吞噬活力采用吞噬中性红的方法测定[19,22],在96孔细胞培养板中加入100 μL仿刺参体腔细胞抗凝液,培养30 min,弃上清液,加入预先配置好的中性红溶液,培养30 min,使体腔细胞吞噬中性红,再用磷酸缓冲盐溶液(PBS)洗去未被吞噬的中性红,最后加入细胞裂解液(冰乙酸∶无水乙醇的体积比为1∶1)[23],裂解20 min,每个样本重复做3次,使用酶标仪在波长540 nm下测定光密度值,以每106个体腔细胞的光密度值表示仿刺参体腔细胞吞噬活力。
1.2.5 呼吸暴发力的测定 参考Song[24]的方法并稍作修改,在96孔细胞培养板中先加入50 μL体积分数为0.2%的多聚赖氨酸,后加入100 μL体腔细胞抗凝液,离心,去除上清,加入100 μL丙二醇甲醚醋酸酯(PMA),37 ℃温育30 min后加入100 μL体积分数为0.3%的氮蓝四唑(NBT),37 ℃温育30 min;离心去除上清后加入200 μL纯甲醇终止反应,离心去除上清,再用体积分数为70%的甲醇洗涤3次,离心去除上清后,室温下晾干。干燥后,加入120 μL 2 mol/L KOH和140 μL二甲基亚砜(DMSO),充分溶解孔内物质,每个样本重复做3次,在630 nm下测量光密度值,以每106个体腔细胞的光密度值表示仿刺参体腔细胞呼吸暴发活力。

2 结果与分析
2.1 盐度变化对仿刺参攻毒前后SOD活力的影响
图1可见,攻毒前(0 h),盐度25、27、29条件下,仿刺参SOD活力随盐度的升高而升高,无显著性差异(> 0.05);盐度31、33条件下,仿刺参SOD活力随盐度的升高而降低,无显著性差异(> 0.05)。
盐度25条件下,攻毒灿烂弧菌6、12、24 h后与0 h相比仿刺参的SOD活力无显著性差异(> 0.05),但仿刺参SOD活力在48 h显著降低(< 0.05);盐度27、33条件下,攻毒6、12、24、48 h后与0 h相比SOD活力降低,48 h SOD活力显著降低(< 0.05);盐度29条件下,攻毒6、12、24、48 h后与0 h相比SOD活力降低,6 h SOD活力显著降低(< 0.05);盐度31条件下,攻毒6、12、24、48 h后与0 h相比SOD活力降低,24 h SOD活力显著降低(< 0.05)。

小写字母表示相同盐度、不同时间差异显著性的比较;大写字母表示相同时间、不同盐度差异显著性的比较;凡含一个相同字母者表示不同处理组间差异不显著(P > 0.05)。
综上,攻毒前(0 h),随盐度的变化,仿刺参SOD活力无显著性差异(> 0.05)。攻毒后盐度25、27、33条件下,仿刺参SOD活力在48 h显著降低(< 0.05);盐度29、31条件下,攻毒后仿刺参SOD活力显著降低时间提前。
2.2 盐度变化对仿刺参攻毒前后ACP活力的影响
图2可见,攻毒前(0 h),盐度25、27条件下,仿刺参ACP活力随盐度的升高而升高,无显著性差异(> 0.05);盐度29、31、33条件下,仿刺参ACP活力随盐度的升高而降低,无显著性差异(> 0.05)。
盐度25、27条件下,攻毒6 h后与0 h相比ACP活力差异不显著(> 0.05),攻毒12、24、48 h后与0 h相比ACP活力显著升高(< 0.05);盐度29、31、33条件下,攻毒6、12、24、48 h后与0 h相比ACP活力升高,6 h ACP活力显著升高(< 0.05)。
综上,攻毒前(0 h),随盐度的变化,仿刺参ACP活力无显著性差异(> 0.05)。盐度25、27条件下,攻毒后仿刺参ACP活力在12 h显著升高(< 0.05);盐度29、31、33条件下,攻毒后仿刺参ACP活力在6 h显著升高(< 0.05)。
2.3 盐度变化对仿刺参攻毒前后CAT活力的影响
图3可见,攻毒前(0 h),随盐度的升高仿刺参CAT活力变化无规律,无显著性差异(> 0.05)。
盐度25条件下,攻毒6、24、48 h后与0 h相比CAT活力无显著差异(> 0.05),但仿刺参CAT活力在12 h显著降低(< 0.05);盐度27、29、31条件下,攻毒6、12、24、48 h与 0 h相比CAT活力差异不显著(>0.05);盐度33条件下,攻毒6、12 h与0 h相比CAT活力差异不显著,但24 h时CAT活力显著降低(< 0.05)。

小写字母表示相同盐度、不同时间差异显著性的比较;大写字母表示相同时间、不同盐度差异显著性的比较;凡含一个相同字母者表示不同处理组间差异不显著(P > 0.05)。
综上,攻毒前(0 h),随盐度的变化,仿刺参CAT活力无显著性差异(> 0.05)。在盐度27、29、31条件下,攻毒后仿刺参CAT活力无显著性差异(>0.05),无变化规律;盐度25、33条件下,攻毒后仿刺参CAT活力有显著性降低(< 0.05),但无变化规律。
2.4 盐度变化对仿刺参攻毒前后吞噬活力的影响
图4可见,攻毒前(0 h),盐度25、27、29、31条件下,仿刺参吞噬活力随盐度的升高而升高,盐度31与25~27 相比,仿刺参吞噬活力显著升高(< 0.05);盐度33条件下,仿刺参吞噬活力随盐度的升高而降低,无显著性差异(> 0.05)。
盐度25、27条件下,攻毒6、12、24、48 h后吞噬活力均高于0 h,攻毒6 h吞噬活力显著升高(< 0.05);盐度29、31条件下,攻毒6、12、24、48 h后与0 h相比仿刺参吞噬活力先升高后降低,但差异不显著(> 0.05);盐度33条件下,攻毒6、12、24 h后与0 h相比仿刺参吞噬活力无显著性差异(> 0.05),攻毒48 h吞噬活力显著降低(< 0.05)。

小写字母表示相同盐度、不同时间差异显著性的比较;大写字母表示相同时间、不同盐度差异显著性的比较;凡含一个相同字母者表示不同处理组间差异不显著(P > 0.05)。
综上,攻毒前(0 h),在25~31盐度的范围内随着盐度的升高仿刺参吞噬活力有显著性升高(< 0.05)。盐度25、27条件下,攻毒后仿刺参吞噬活力在6 h显著升高(< 0.05);盐度29、31条件下,攻毒6、12、24、48 h后与0 h相比仿刺参吞噬活力无显著性差异(> 0.05)。
2.5 盐度变化对仿刺参攻毒前后RB的影响
图5可见,攻毒前(0 h)时,随盐度的升高,仿刺参RB无显著性变化(> 0.05)。
盐度25条件下,攻毒6、12、24 h后与0 h相比仿刺参RB无显著性差异(> 0.05),48 h RB显著降低(< 0.05);盐度29条件下,攻毒6、12、24 h后与0 h相比仿刺参RB无显著性差异(> 0.05),48 h RB显著升高(< 0.05);盐度27、31条件下,攻毒6、12、24、48 h后仿刺参RB 无变化规律,但有显著性差异(< 0.05),盐度27条件下攻毒24 h与0 h相比仿刺参RB显著升高,盐度31条件下攻毒12 h与0 h相比仿刺参RB显著升高(< 0.05);盐度33条件下,攻毒6、12、24、48 h后与0 h相比仿刺参RB无显著性变化(> 0.05)。
综上,攻毒前(0 h)时,随盐度的升高,仿刺参RB无显著性变化(> 0.05)。攻毒后,盐度对仿刺参RB有显著性影响(< 0.05),但无变化规律。
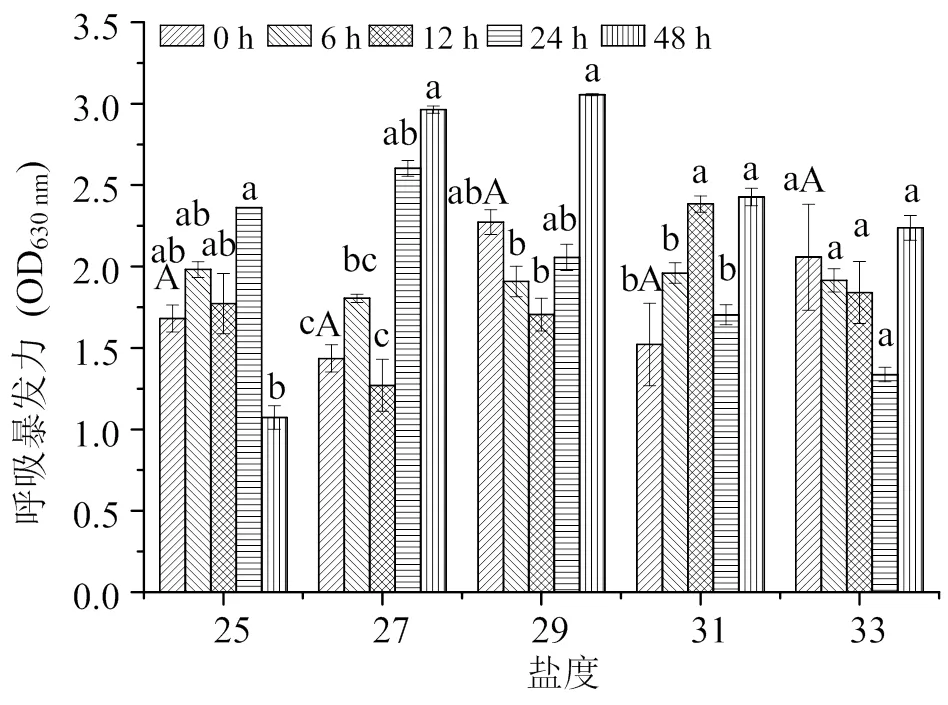
小写字母表示相同盐度、不同时间差异显著性的比较;大写字母表示相同时间、不同盐度差异显著性的比较;凡含一个相同字母者表示不同处理组间差异不显著(P > 0.05)。
2.6 盐度变化对仿刺参攻毒前后PO活力的影响
图6可见,攻毒前(0 h),盐度25、27、29条件下,仿刺参PO活力随盐度的升高而升高,盐度29与25相比,PO活力显著升高(< 0.05);盐度29、31、33条件下,仿刺参PO活力随盐度的升高而降低,无显著性差异(> 0.05)。
盐度25条件下,攻毒6、12、24、48 h仿刺参PO活力先升高后降低,6 h与0 h相比PO活力显著升高(< 0.05);盐度27条件下,攻毒后48 h与0 h相比显著升高(< 0.05);盐度29、33条件下,攻毒后6、12、24、48 h与0 h相比仿刺参PO活力无显著性差异(> 0.05);盐度31条件下,攻毒6、12、24、48 h仿刺参PO活力先升高后降低,12 h与0 h相比PO活力显著升高(< 0.05)。
综上,攻毒前(0 h),盐度25、27、29条件下,随盐度的升高仿刺参PO活力升高(< 0.05)。盐度29条件下仿刺参PO活力达到最大值。攻毒后,不同盐度下的仿刺参PO活力在不同时间点较0 h均有升高,但没有规律性。

小写字母表示相同盐度、不同时间差异显著性的比较;大写字母表示相同时间、不同盐度差异显著性的比较;凡含一个相同字母者表示不同处理组间差异不显著(P > 0.05)。
3 讨论
3.1 盐度变化对未攻毒仿刺参免疫指标的影响
海洋生物病害的产生与生活环境密切相关。仿刺参是狭盐性海洋动物,盐度是仿刺参养殖过程中重要的环境因子之一,盐度的改变直接或间接引起海洋动物免疫机能的改变,进而造成病原微生物的感染。
攻毒前,各盐度下仿刺参SOD、ACP、CAT、RB差异不显著(> 0.05),说明这四个免疫酶对盐度变化不敏感,盐度的改变不会导致它们产生显著性变化。
攻毒前,盐度25、27、29、31条件下仿刺参吞噬活力随盐度的升高而升高,说明一定范围内随着盐度的升高仿刺参体内吞噬细胞的吞噬能力变强,盐度31条件下吞噬能力最强。王方雨在刺参盐度(20、25、30)胁迫实验中发现,刺参体腔液内吞噬活力随盐度的升高而升高,与本研究结果相似[25]。盐度33条件下,仿刺参吞噬活力降低,可能是由于仿刺参长时间处于高盐条件下细胞失水,渗透压升高,造成仿刺参吞噬细胞吞噬能力降低。
盐度25、27、29、31、33 条件下仿刺参PO活力,随盐度的升高先升高后降低,在盐度29条件下PO活力达到最大值,说明随着盐度的升高,在盐度29条件下仿刺参免疫力最强。盐度31、33条件下随盐度的升高仿刺参PO活力降低,可能是因为盐度升高造成酚氧化物酶应答系统受到抑制。
综上,本实验结果表明,从低盐到适盐时,盐度升高仿刺参的吞噬能力增强;盐度胁迫下,影响仿刺参的吞噬活力。也提示我们在选择海域养殖仿刺参时,选择适宜盐度水域,仿刺参机体免疫力最强,利于其生长发育。另外,依据盐度对酚氧化物酶(PO)的影响,可以选其用作监测养殖海域海水适宜度的指标。
3.2 盐度变化对攻毒后仿刺参免疫指标的影响
仿刺参作为海洋底栖生物,能够在高密度病原微生物致病菌环境中生存与它特有的免疫机制不无关系[26]。其免疫系统主要是由体壁防御和体内免疫共同作用。体内免疫防御机制主要是以细胞免疫和体液免疫为基础的先天性免疫,也叫非特异性免疫[27];在免疫系统中,体腔液是抵抗外源病原菌的重要防线,在免疫屏障方面发挥着至关重要的作用;它自身可以吞噬、内陷和清除病原微生物,也可分泌免疫因子(各种酶)来抑制杀伤病原菌[28-29]。
超氧化物歧化酶(SOD)具有抗菌、抗病毒、抗衰老等作用[26];它既可以直接参与病原菌的杀伤,也可以清除体内多余的自由基,起到自我保护的作用。在超氧化物歧化酶(SOD)活力的测定中,攻毒后,盐度25条件下,在24 h前SOD活力差异不显著(> 0.05),之后活力随时间的延长显著降低(< 0.05),可看出当注射灿烂弧菌后激活了仿刺参自身的免疫系统,免疫活性提高以抵抗致病菌的蔓延。但由于长时间处于盐度较低的环境中造成机体吸水,体内的渗透压降低,进而影响了免疫相关的细胞活性,削弱了仿刺参SOD系统的应答能力,导致SOD活性在48 h下降[28-29]。盐度29、31条件下,攻毒后仿刺参SOD活力较盐度25、27、33条件下活力显著降低时间提前,说明盐度29、31条件下仿刺参免疫能力最强,且盐度29条件下最先(6 h)显著降低(< 0.05)(袁秀堂在盐度对刺参呼吸和排泄影响的研究中认为,刺参最适的生长盐度为盐度29~31.5)[8]。盐度27、29、31、33条件下,攻毒后仿刺参SOD活力降低,与蒋经伟对仿刺参攻毒灿烂弧菌后,体内SOD活力降低的结果相一致[29];在盐度25条件下,SOD响应的时间较其他几个盐度迟缓,但也参与到免疫应答中。无论高盐还是低盐环境下,感染灿烂弧菌后仿刺参体内的SOD活力均呈下降趋势,这与廖明玲研究仿刺参人工感染灿烂弧菌时,体内SDO活力下降的结果相一致[30]。超氧化物歧化酶是反应机体免疫抵抗力的重要指标,是急性应激类蛋白[29];研究结果表明盐度胁迫下,应激活力持续升高,增强机体的抗菌、抗病毒、抗衰老等作用。在适宜的29、31盐度下,可以迅速消除应激高活力。
在海参()的吞噬细胞中有多种溶酶体酶类,其中酸性磷酸酶(ACP)被认为是溶酶体中的标志酶,协助吞噬细胞完成防御外源异物入侵和消化表面带有磷酸基团的异物,从而达到预防感染的目的[31];Dybas等在加州刺参()体内的吞噬细胞中检测到了酸性磷酸酶[32]。在酸性磷酸酶(ACP)活力的测定中,攻毒后,其中盐度29、31、33条件下仿刺参ACP活力首次在6 h时显著升高,而盐度25、27条件下仿刺参ACP活力首次在12 h显著升高。说明盐度29、31、33条件下,仿刺参ACP免疫反应更为迅速。这与丛聪和蒋经伟的研究结果一致,丛聪和蒋经伟在研究仿刺参体腔液抗菌性的实验中发现,仿刺参在受到灿烂弧菌刺激后,ACP活力显著升高[33-34]。攻毒后仿刺参会产生一种应激和保护反应,加强自身免疫能力,在盐度31条件下免疫应答迅速。
仿刺参喜栖环境中分布着高密度的微生物致病菌,而仿刺参的体腔内可以保持无菌,这与它所具有的吞噬作用不无关系。体内的吞噬细胞可以直接或间接的对外来物进行清除、抑制[35]。在吞噬活力的测定中,攻毒后,随着时间的延长,盐度29和盐度31条件下吞噬活力无显著性变化。细胞的吞噬活力在盐度29时差异较小,是因为在适宜环境下,仿刺参自身的免疫能力和生存状态能够及时抵抗外源物的入侵。盐度25、27条件下,攻毒后仿刺参吞噬活力首次在6 h时显著升高(< 0.05);盐度29、31、33条件下,攻毒6、12、24、48 h后与0 h相比仿刺参吞噬活力无显著性差异(> 0.05)。说明在盐度25、27条件下,仿刺参吞噬活力能力较强。盐度低时,仿刺参吞噬活力应激能力更强,能够在更短时间内消灭等量的病原微生物。
酚氧化物酶(PO)又称酪氨酸酶,是酚氧化酶原级联系统的主要组成成分,一般以无活性酶原(PPO)的形式存在[23]。系统作用时产生的中间免疫活性物质可直接参与机体免疫,起快速清除病原菌的作用[9]。在酚氧化物酶(PO)测定中,攻毒后,在前述5个盐度条件下,6、12、24、48 h仿刺参PO活力均高于0 h值。说明当灿烂弧菌入侵仿刺参时,仿刺参体内的酚氧化物酶能够产生免疫应答。其中,盐度25、31时,攻毒后仿刺参PO活力在12 h达到最高值后降低,而盐度27、29、33分别在48 h、48 h和24 h达到最高值,说明盐度25、31胁迫下,仿刺参PO免疫能力更强,能够提前启动酚氧化物酶原级联系统,增强机体免疫力。
综上,仿刺参在攻毒灿烂弧菌后免疫相关酶发生了明显的变化,其中SOD、ACP活力敏感性较其他免疫酶迅速灵敏,可以作为监测养殖仿刺参是否感染灿烂弧菌的预测指标,为仿刺参的健康养殖提供参考。
[1] 王清印. 中国海水养殖科技进展[M]. 北京: 海洋出版社, 2015.
[2] 廖玉麟. 我国的海参[J]. 生物学通报, 2001, 36(9): 1-3.
[3] 陈济丰, 郭超, 魏亚南, 等. 海参养殖池塘异养菌与弧菌数量变化特征分析[J]. 现代农业科技, 2018, 47(3): 231-234.
[4] 王印庚, 荣小军. 我国刺参养殖存在的主要问题与疾病综合防治技术要点[J]. 齐鲁渔业, 2004, 21(10): 29-31.
[5] SONG Y L, HSIEH Y T. Immunostimulation of tiger shrimp () hemocytes for generation of microbicidal substances: Analysis of reactive oxygen species [J].Dev Comp Immunol, 1994, 18(3): 201-209.
[6] 李乐, 王宇辰, 高磊, 等. 影响仿刺参生长的主要因子研究进展[J]. 水产科学, 2015, 34(1): 58-65.
[7] DONG Y W, DONG S L, JI T T. Effect of different thermal regimes on growth and physiological performance of the sea cucumberSelenka [J]. Aquaculture, 2008, 275(1-4): 329-334.
[8] 袁秀堂, 杨红生, 周毅, 等. 盐度对刺参()呼吸和排泄的影响[J]. 海洋与湖沼, 2006, 37(4): 348-354.
[9] 田丹. 不同体重和不同盐度条件下仿刺参()免疫活性的研究[D]. 青岛: 中国海洋大学, 2013.
[10] DENG H, HE C B, ZHOU Z C, et al. Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumber[J]. Aquaculture, 2009, 287(1): 18-27.
[11] 李强, 孙康泰, 张显昱. 刺参“腐皮综合征”研究进展[J]. 中国农业科技导报, 2013(6): 40-45.
[12] 王印庚, 荣小军, 张凤萍, 等. 养殖刺参“腐皮综合征”致病菌——灿烂弧菌的原位杂交检测方法的建立与应用[J]. 渔业科学进展, 2013, 34(2): 114-118.
[13] 王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病"腐皮综合征"病原及其感染源分析[J]. 中国水产科学, 2006, 13(4): 610-616.
[14] 白楠. 凡纳滨对虾、仿刺参免疫增强剂使用频率和免疫疲劳的研究[D]. 青岛: 中国海洋大学, 2010.
[15] DOLMATOVA L S, ELISEIKINA M G and ROMASHINA V V, Antioxidant enzymatic activity of coelomocytes of the far east sea cucumber[J]. Journal of Evolutionary Biochemistry and Physiology, 2004. 40(2): 126-135.
[16] WEI Z H, YI L , WEI X, ZHOU H H, ZHANG Y J, et al. Effects of dietary nucleotides on growth, non-specific immune response and disease resistance of sea cucumber[J]. Fish & Shellfish Immunology, 2015, 47(1): 1-6.
[17] 孙永欣. 黄芪多糖促进刺参免疫力和生长性能的研究[D]. 大连: 大连理工大学, 2008.
[18] ZHAO Y C, ZHANG W B, XU W, et al. Effects of potential probiotic Bacillus subtilis T13 on growth, immunity and disease resistance againstinfection in juvenile sea cucumber[J]. Fish Shellfish Immunol, 2012, 32(5): 750-755.
[19] 赵彦翠. 刺参(Selenka)多糖类免疫增强剂及微生态制剂的研究与应用[D]. 青岛: 中国海洋大学, 2011.
[20] ASHIDA M, SÖDERHÄLL K. The prophenoloxidase activating system in crayfish [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1984, 77(1): 21-26.
[21] 张琴. 刺参(Selenka)高效免疫增强剂的筛选与应用[D]. 青岛: 中国海洋大学, 2010.
[22] CAO Q Z, LIN Z B. Antitumor and anti-angiogenic activity ofpolysaccharides peptide [J]. Acta Pharmacologica Sinica, 2004, 25(6): 833-838.
[23] 韩丽蓉. 壳寡糖、稀土及壳寡糖稀土配合物对刺参生长、免疫反应和抗病力的影响[D]. 青岛: 中国海洋大学, 2014.
[24] SONG Y L, HSIEH Y T. Immunostimulation of tiger shrimp () hemocytes for generation of microbicidal substances: Analysis of reactive oxygen species [J].Dev Comp Immunol, 1994, 18(3): 201-209.
[25] 王方雨. 刺参生态免疫与夏眠的基础研究[D]. 青岛: 中国科学院研究生院(海洋研究所), 2008.
[26] 王淑娴, 叶海斌, 于晓清, 等. 海参的免疫机制研究[J]. 安徽农业科学, 2012, 40(25): 12553-12555.
[27] 张峰, 宫晶, 王海峰, 等. 仿刺参补体类似物活性的测定[J]. 大连海洋大学学报, 2007, 22(4): 246-248.
[28] XUE Z, LI H, WANG X L, et al. A review of the immune molecules in the sea cucumber [J]. Fish & Shellfish Immunology, 2015, 44(1): 1-11.
[29] GROSS P S, AL-SHARIF W Z, CLOW L A, et al. Echinoderm immunity and the evolution of the complement system[J]. Developmental & Comparative Immunology, 1999, 23(4): 429-442.
[30] 廖明玲, 刘晨敏, 孙爱杰, 等. 饲料虫草培养基水平对人工感染灿烂弧菌后刺参非特异性免疫指标及肠道菌群数量的影响[J]. 饲料工业, 2015, 36(12): 21-26.
[31] 刘志鸿, 牟海津, 王清印. 软体动物免疫相关酶研究进展[J]. 渔业科学进展, 2003, 24(3): 86-90.
[32] DYBAS L, FANKBONER P V. Holothurian survival strategies: Mechanisms for the maintenance of a bacteriostatic environment in the coelomic cavity of the sea cucumber,[J]. Developmental and Comparative Immunology, 1986, 10(3): 311-330.
[33] 丛聪. 仿刺参()体腔液的抗菌特性[D]. 大连: 大连海洋大学, 2015.
[34] 蒋经伟, 丛聪, 董颖, 等. 不同细菌刺激后仿刺参体腔液中免疫相关酶的应答变化[J]. 动物学杂志, 2015, 50(6): 947-956.
[35] 孟繁伊. 仿刺参(, Selenka)体腔液中调理素样分子的研究[D]. 青岛: 中国海洋大学, 2009.
Effects of Salinities on Immune-related Indicators of Sea Cucumber ()
WANG Yu-feng1, YANG Jin1, HU Ya-xiao1, ZHANG Hong-bin1, DING Jun2, WANG Luo2, QIU Xue-mei1
(1.,,116023,; 2.,116023,)
To study the effects of different salinities on immune-related indicators of sea cucumber challenged with.We randomly divided 150 sea cucumbers with an average body weight of (6.16 ± 1.86) g into 5 groups. Each group was placed in seawater with salinity 25, 27, 29, 31 and 33 for temporary cultivation. Each sea cucumber was injected with 200 μL 3.98×108CFU/mL. The cavity fluid was collected after 0, 6, 12, 24 and 48 hours and the relevant immune indicators were determined.When not challenged, there were no significant differences in superoxide dismutase (SOD), acid phosphatase (ACP), catalase (CAT), and respiratory burst (RB) at each salinity (> 0.05). Under salinity of 33, the phagocytic activity of the sea cucumber decreased as the salinity increased. Under salinity of 25, 27 and 29, PO activity increased significantly with the increase of salinity (< 0.05). Under salinity of 31 and 33, PO activity decreased with increasing salinity. After challenge, SOD activity changed apparently. Under salinity of 25, 27, and 33, SOD activity decreased significantly at 48 h (< 0.05). Under salinity of 29 and 31, the time for SOD activity to decrease significantly was advanced. ACP changed obviously after challenge. Under salinity of 25 and 27, ACP activity increased significantly at 12 h (< 0.05). Under salinity of 29, 31, and 33, ACP activity increased significantly at 6 h (< 0.05). The change in CAT activity is irregular. Under salinity of 25 and 27, the phagocytic activity of sea cucumber was increased significantly after challenge (< 0.05). Under salinity of 29 and 31, there was no significant difference in phagocytic activity between 6, 12, 24, 48 h and 0 h (> 0.05). The salinity had a significant effect on the RB of the sea cucumber (< 0.05), but the change was irregular. After challenge, the PO activity of the sea cucumber in different salinities increased compared with 0 h, but there was no regularity.The effect of salinity on the phagocytosis activity and PO activity of sea cucumbers can provide a basis for selecting appropriate salinity water for sea cucumber breeding. After challenge, the SOD activity and ACP activity of the sea cucumber have quick responses.
;immune-related enzymes; salinity;
Q175
A
1673-9159(2020)03-0022-08
10.3969/j.issn.1673-9159.2020.03.004
2019-09-19
国家重点研发计划重点专项(SQ2017YFSF070158)
王玉凤(1993-),女,硕士研究生,主要研究方向为海洋生物学。E-mail: wangyufeng0901@outlook.com
仇雪梅(1964-),女,博士,教授,主要研究方向为海洋生物学。E-mail: xmqiu@dlou.edu.cn
王玉凤,杨金,胡雅潇,等. 盐度对仿刺参免疫指标的影响[J]. 广东海洋大学学报,2020,40(3):22-29.
