甜茶叶多糖的表征、体外抗氧化活性与体内毒性
2020-08-22教小磐
教小磐,刘 云
(北京化工大学生命科学与技术学院,北京市生物加工过程重点实验室,北京 100029)
多糖通常是由多个单糖分子聚合、脱水形成的一类分子结构复杂的多羟基聚合物。多糖来源广泛,根据来源不同可分为植物多糖、细菌多糖、真菌多糖和动物多糖。植物多糖普遍存在于自然界中,研究者已从各类植物中提取并分离出不同结构的多糖[1]。近年来,对植物多糖的研究逐渐增多,主要集中在多糖的提取、分离纯化、含量测定、结构分析、药理及生物学功能等方面。植物多糖研究的深入为活性多糖产品的生产开发奠定了基础[2]。
甜茶(Rubus suavissimusS.Lee),又名甜叶悬钩子,为蔷薇科悬钩子属多年生有刺灌木,因其叶片味甜,故称为甜茶,是广西、贵州、湖南等地区长期以来食用的甜味品种茶[3-4]。甜茶中含有茶多酚、黄酮、多糖及糖苷类等多种物质,杜晋伟[5]从甜茶叶中分离出多种二萜(苷)类化合物和三萜类化合物,其中,甜叶悬钩子苷具有一定的药理活性。鲍晨阳[6]对甜茶中甜茶苷、总多酚和总黄酮3 种主要成分的提取纯化工艺进行了深入研究。吴玉婷[7]初步研究了甜叶悬钩子多糖的结构,揭示了多糖的结构与其生物活性的关系。关于甜茶叶的研究主要集中在甜茶苷、多酚等物质,其多糖组分的研究相对空缺。甜茶作为“茶、糖、药”的植物来源,具有重要的研究价值。
因此,本实验提取了甜茶叶中的多糖组分,测定了其总糖含量及单糖组成,并对其体外抗氧化活性及生物体内毒性进行了相关研究,以期为甜茶多糖的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
甜茶叶购于湖南省永州市道县;葡萄糖(glucose,Glu)、半乳糖(galactose,Gal)、甘露糖(mannose,Man)、阿拉伯糖(arabinose,Ara)、鼠李糖(rhamnose,Rha)、岩藻糖(fucose,Fuc)、葡萄糖醛酸(glucuronic acid,Glu UA)、半乳糖醛酸(galacturonic acid,Gal UA)标准品、三氟乙酸、乙腈(色谱纯)、1-苯基-3-甲基-5-吡唑酮(5-methyl-2-phenyl-1,2-dihydropyrazol-3-one,PMP) 美国Sigma公司;无水乙醇、乙酸乙酯、三氯甲烷、正丁醇、丙酮、乙醚、甲醇均为国产分析纯。
1.2 仪器与设备
UV-756CRT型紫外-可见分光光度计 上海佑仪仪器仪表有限公司;HH-ZK4型恒温水浴锅 北京星德仪器设备有限公司;RE-52型旋转蒸发仪 上海亚荣生化仪器有限公司;3K15型台式高速冷冻离心机 北京五洲东方科技发展有限公司;真空冷冻干燥机 北京博医康实验仪器有限公司;Alltech Series 1500型高效液相色谱仪美国奥泰公司;VERTEX 70v傅里叶变换红外光谱仪德国Bruker公司;SZ61体视显微镜、E330数码单反相机日本奥林巴斯公司;斑马鱼养殖系统 北京爱生公司。
1.3 方法
1.3.1 甜茶中多糖的提取和精制
精密称取50 g甜茶粉末,乙醇/乙酸乙酯(1∶2,V/V)浸泡过夜脱脂;脱脂后的甜茶粉末以料液比1∶10 用80 ℃热水浸提3 h,收集提取液,滤渣重复提取3 次;合并3 次提取液并浓缩;提取液加入4 倍体积的无水乙醇,4 ℃过夜沉淀,5 000 r/min 离心15 min 得沉淀,沉淀分别用无水乙醇、丙酮、乙醚洗涤2~3 次,经干燥得粗提物。
粗提物重新溶于水,过滤去杂质;用Sevag法[8](V(氯仿):V(正丁醇)=4∶1)脱蛋白,重复8~10 次,采用紫外分光光度计测定溶液吸光度,直至260~280 nm波长处无明显吸收峰;透析(截流分子质量8 000~12 000 Da)48 h 除去小分子物质;采用活性炭脱色工艺[9]对多糖溶液进行脱色,脱色温度为50 ℃;脱色液加入4 倍体积无水乙醇二次沉淀过夜,5 000 r/min 离心15 min得沉淀;沉淀依次用无水乙醇、丙酮、乙醚洗涤2~3 次;最后冷冻干燥,得精提物。
1.3.2 总糖质量分数及甜茶多糖提取率的测定
总糖质量分数的测定参考文献[10]。
1.3.2.1 总糖标准曲线绘制
精密称取鼠李糖5 mg,溶解后定容至100 mL,即得质量浓度为0.05 mg/mL的鼠李糖标准溶液。然后分别稀释至0.04、0.03、0.02、0.01 mg/mL。分别吸取0.01、0.02、0.03、0.04、0.05 mg/mL的葡萄糖溶液2 mL,加入体积分数5%苯酚溶液1 mL,再加入5 mL 浓硫酸,室温下显色30 min,使用紫外-可见分光光度计,测定溶液在490 nm波长处的吸光度,以鼠李糖质量浓度为横坐标,吸光度为纵坐标绘制得标准曲线。
1.3.2.2 甜茶多糖提取率的测定
精密称取5 mg甜茶多糖样品溶于100 mL去离子水中,吸取甜茶多糖样品溶液2 mL,加入体积分数5%苯酚溶液1 mL,再加入5 mL浓硫酸,室温下显色30 min,使用紫外-可见分光光度计测定溶液在490 nm波长处的吸光度,根据鼠李糖标准曲线和甜茶多糖样品的吸光度计算出甜茶多糖中总糖质量分数。甜茶多糖提取率按式(1)计算。
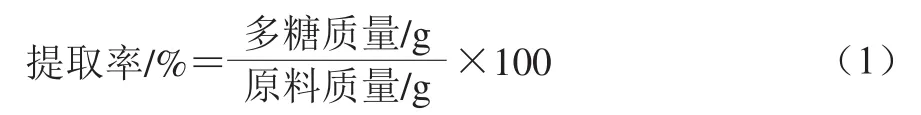
1.3.3 单糖组成的分析
单糖组成按照文献[11-13]进行分析。
酸水解[14]:精密称取甜茶多糖10 mg,溶解于2 mL 2 mol/L的三氟乙酸溶液中,121 ℃水解1 h;50 ℃旋转蒸发除酸,加入1 mL超纯水,得甜茶多糖水解液。
标准品处理:首先配制各单糖标准品母液,其中甘露糖、葡萄糖醛酸、半乳糖醛酸、半乳糖、阿拉伯糖、岩藻糖的质量浓度均为1.25 mg/mL,鼠李糖质量浓度为7.0 mg/mL,葡萄糖质量浓度为1.75 mg/mL,取各单糖标准品母液0.125 mL,得到混合单糖标准品溶液1 mL待用。
PMP衍生化:分别取1 mL各单糖标准品溶液、1 mL混合单糖标准品溶液与1 mL甜茶多糖水解液,依次加入0.3 mol/L NaOH 500 μL和0.5 mol/L PMP-甲醇溶液500 μL混匀,70 ℃水浴反应40 min,冷却至室温后加入0.3 mol/L HCl溶液中和,用1 mL CHCl3萃取3 次,分别取上层水相用去离子水定容至10 mL,即得各单糖标准品衍生液、混合单糖标准品衍生液及衍生化的甜茶多糖水解液,过0.22 μm滤膜,进行高效液相色谱检测。
先将各单糖标准品衍生液分别进样,根据每种单糖标准品的色谱图来确定每种单糖的出峰时间,再将混合单糖标准品衍生液进样,得到混合单糖标准品的高效液相色谱图,根据各单糖出峰时间、峰面积绘出各单糖的标准曲线,衍生化的甜茶多糖水解液在相同的色谱条件下进行测定,根据甜茶多糖水解液高效液相色谱图中各峰的保留时间,利用计算机积分得到各峰的峰面积,并将峰面积代入各单糖标准曲线中即可得出甜茶叶多糖的单糖组成及物质的量比。
仪器条件:色谱柱为COSMOSIL 5C18-MS-II柱(4.6 mm×250 mm);流动相为0.1 mol/L pH 6.8的磷酸盐缓冲液-乙腈(83∶17,V/V);流速为1.0 mL/min;柱温为25 ℃;进样量为20 μL;波长为245 nm;时间为60 min。
1.3.4 傅里叶变换红外光谱的测定
采用KBr压片法。取100 mg干燥KBr粉末研细,加入甜茶多糖样品混合研细,压成透明薄片。采用VERTEX 70v傅里叶变换红外光谱仪进行测定。
1.3.5 抗氧化能力的测定
1.3.5.1 总还原力的测定
总还原力测定参照文献[15]。分别取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖水溶液各1.0 mL,依次加入0.2 mol/L磷酸盐缓冲液、质量分数1%K3Fe(CN)6溶液各1.0 mL,混合液50 ℃水浴反应20 min,冷却后,向混合物中加入1.0 mL体积分数10%的三氯乙酸溶液,3 000 r/min离心10 min,取2.5 mL上清液依次加入2.5 mL去离子水、1.0 mL体积分数0.1% FeCl3溶液。以去离子水为参比,在700 nm波长处测定吸光度。取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的VC进行同样处理作为阳性对照。以吸光度表征总还原力。
1.3.5.2 DPPH自由基清除能力的测定
1,1 -二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力的测定参照文献[16]进行。分别取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖水溶液各2.0 mL,分别加入0.1 mmol/L的DPPH-乙醇溶液2 mL混匀,室温避光反应30 min,在517 nm波长处测定不同质量浓度多糖溶液的吸光度。空白组以2 mL的去离子水代替多糖溶液。本底用去离子水代替DPPH-乙醇溶液。取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的VC进行同样处理作为阳性对照。按公式(2)计算多糖溶液对DPPH自由基清除率。

式中:A0为空白管吸光度;Aa为测定管吸光度;Ab为测定管本底吸光度。
1.3.5.3 ·OH清除能力的测定
羟自由基(·OH)清除能力的测定参照文献[17-18]。分别取质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的多糖水溶液各1.0 mL,分别依次加入9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液、9 mmol/L的H2O2溶液各1.0 mL,混匀后37 ℃反应30 min,于510 nm波长处测定吸光度。空白组用去离子水代替多糖溶液,本底用去离子水代替H2O2溶液。取质量浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL的VC进行同样处理并作为阳性对照。按公式(3)计算多糖溶液对·OH清除率。
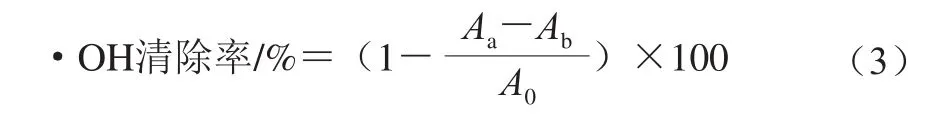
式中:A0为空白管吸光度;Aa为测定管吸光度;Ab为测定管本底吸光度。
1.3.6 多糖的毒性测定
1.3.6.1 斑马鱼的饲养与胚胎的收集
斑马鱼(Brachydanio rerio)生长周期短、发育快速,比传统的啮齿类动物模型具有更大的优势。本实验选用斑马鱼受精后6 h(6 hours post-fertilization,6 hpf)的胚胎和斑马鱼受精后3 d(3 days post-fertilization,3 dpf)的幼鱼为研究对象[19-20]。斑马鱼养殖于(28.5±1.0)℃的人工海水中,斑马鱼养殖室内采用人工光源对斑马鱼的生活周期进行光调控,照明周期为14 h光照,10 h黑暗交替。饵料选用孵化48 h的丰年虾,每日中午饲喂1 次。
胚胎收集:当天开灯后立即将收卵皿置于鱼缸底部,斑马鱼受光刺激开始出现明显的追尾现象,产卵后受精卵会由纱网的网眼漏到平皿底,即刻将平皿提出,取出纱网,将沉在平皿底部的鱼卵吸出,每20~30 min收集鱼卵1 次,冲洗几次后转至盛有人工海水的小平皿中继续培养。
1.3.6.2 斑马鱼毒性实验
依据斑马鱼药物毒性实验[21]中药物(头孢唑啉)质量浓度的范围(胚胎在头孢唑啉给药质量浓度高于0.3 mg/mL时全部致畸;幼鱼在头孢唑啉给药质量浓度高于0.3 mg/mL时全部死亡)确定在低、中、高3 个甜茶多糖质量浓度下进行测定。甜茶多糖(给药组)母液质量浓度为5 mg/mL,将母液用人工海水分别稀释至0.1、1.0、2.5 mg/mL。
采用斑马鱼野生型TU品系。分别取6 hpf的斑马鱼胚胎和3 dpf的斑马鱼幼鱼,每组各30 枚置于2 mL含0.1、1.0、2.5 mg/mL甜茶多糖的人工海水中,每个甜茶多糖质量浓度组重复3 次。显微镜下观察斑马鱼胚胎和幼鱼在接触多糖溶液后,连续3 d的表型和存活率。
1.4 数据处理与分析
采用Excel 2010、OriginPro 2017C软件进行数据处理,结果以平均值±标准差表示。
2 结果与分析
2.1 甜茶多糖总糖含量与单糖组成分析结果
冷冻干燥后的水提甜茶多糖为浅黄色的絮状物,多糖的得率为0.6%,相比文献[8]中甜茶多糖得率(3.4%)及文献[22]中普洱茶多糖得率(1.25%)而言较低。分析原因可能是本实验中采用了二次醇沉,多糖纯度进一步提高,因此得率较低。进一步地将所测得甜茶多糖的吸光度代入鼠李糖标准曲线回归方程y=14.975x+0.098 9(R2=0.996 4),即得甜茶多糖的总糖质量分数。甜茶多糖的总糖质量分数为70.2%,其结果高于文献[7]中总糖质量分数。

图1 8 种单糖标准品混合物(A)和甜茶多糖水解液(B)的高效液相色谱图Fig.1 High performance liquid chromatograms of mixture of eight standard monosaccharides (A) and hydrolysate of polysaccharides from Rubus suavissimus S.Lee (B)
混合单糖标准品衍生液的高效液相色谱图如图1A所示,8 种单糖混合标准液衍生物在该色谱条件下实现了较好的分离。根据各单糖出峰时间、峰面积绘出各单糖的标准曲线,结果见表1,所测定的8 种单糖标准品的峰面积与标准品质量浓度呈良好的线性关系,拟合度较高。衍生化的甜茶多糖水解液在相同的色谱条件下进行测定,结果见图1B。结果表明,甜茶多糖主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖组成,其物质的量比为1.17∶21.79∶3.54∶1.00∶1.33∶2.86。其中鼠李糖含量最高,半乳糖含量最低。图1B中30.50 min的新峰已验证不是葡萄糖醛酸和半乳糖醛酸,分析可能是一种新的糖醛酸,与傅里叶变换红外光谱结果中含C=O的伸缩振动峰相对应。由于其含量较低,因此未做进一步检测。
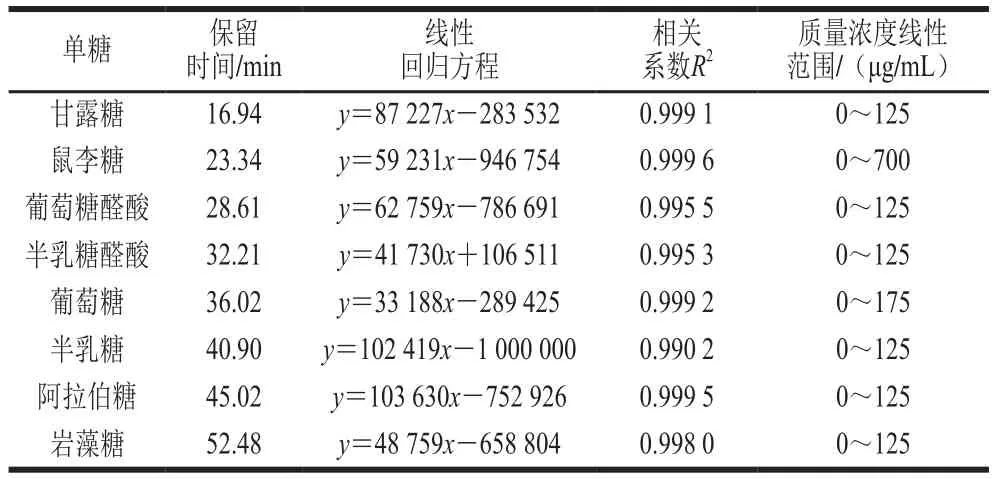
表1 8 种单糖的标准曲线方程Table 1 Calibration curves of eight monosaccharides
2.2 甜茶多糖的傅里叶变换红外光谱分析结果
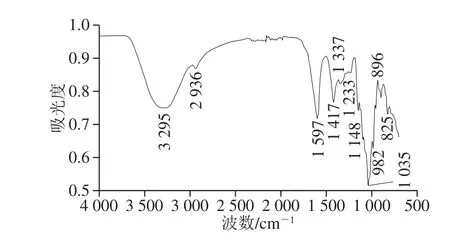
图2 甜茶多糖的傅里叶变换红外光谱Fig.2 Fourier transform infrared spectra of Rubus suavissimus S.Lee polysaccharides
如图2所示,甜茶多糖样品在4 000~500 cm-1区具有多糖类物质的一般特征。3 295、2 936、1 597、1 417、1 337、1 233、1 148、1 035、982、896、825 cm-1均有特征吸收。3 295 cm-1附近的强宽谱带是糖类—OH的伸缩振动吸收峰,2 936 cm-1附近的吸收峰是甲基或亚甲基的C—H伸缩振动峰,1 200~1 420 cm-1附近的吸收峰是C—H的弯曲振动峰,与C—H的伸缩振动构成了糖环的特征吸收[23]。1 597 cm-1附近的吸收峰是C=O的伸缩振动峰,同时与吸收的水相关,说明甜茶多糖对水有较强的亲和力[24]。980~1 200 cm-1的吸收峰为吡喃糖环的伸缩振动峰,证明甜茶多糖样品中单糖以吡喃糖苷的形式存在,与单糖组成结果一致。825 cm-1和896 cm-1的吸收峰分别代表α与β类型的糖苷键[25]。
2.3 甜茶多糖的抗氧化能力分析结果
2.3.1 总还原力分析结果
还原力是评价天然产物抗氧化能力的重要指标。溶液的吸光度越大,其还原力越强。
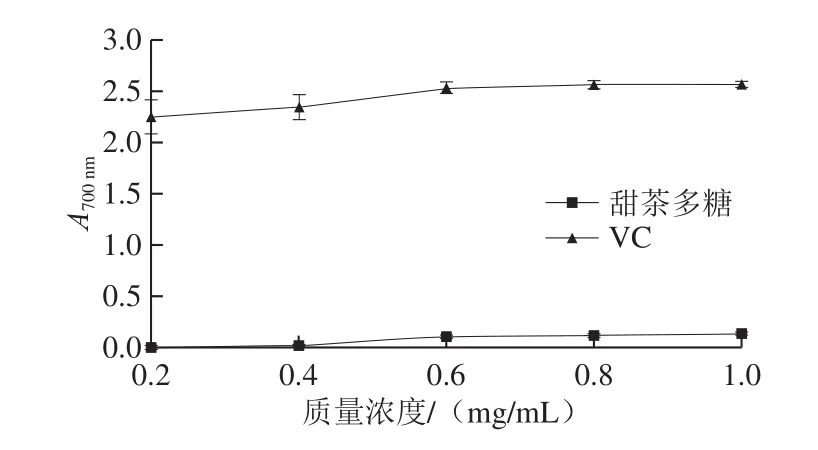
图3 VC和甜茶多糖的还原力Fig.3 Reducing power of VC and polysaccharides from Rubus suavissimus S.Lee
由图3可知,随着多糖质量浓度的增加,吸光度增大,其还原力增强,但均低于同等质量浓度VC的还原力。任嘉兴等[18]对羊肚菌多糖的抗氧化活性进行研究,发现羊肚菌多糖在质量浓度1.0 mg/mL时,吸光度为0.25,略高于本实验结果。Zhang Zuofa等[26]研究了金针菇多糖的还原能力,在质量浓度为5 mg/mL时,其多糖吸光度低于0.2,与阳性对照丁基羟基茴香醚同样具有较大差异,这与本实验结果较为一致。由此可知,甜茶多糖具有一定的还原力,但与VC相比较弱。
2.3.2 甜茶多糖DPPH自由基清除能力分析结果
DPPH法是评价抗氧化活性的常用方法,多糖作为抗氧化物质可直接作用于DPPH自由基,使其颜色变浅,从而引起吸光度的变化[27]。
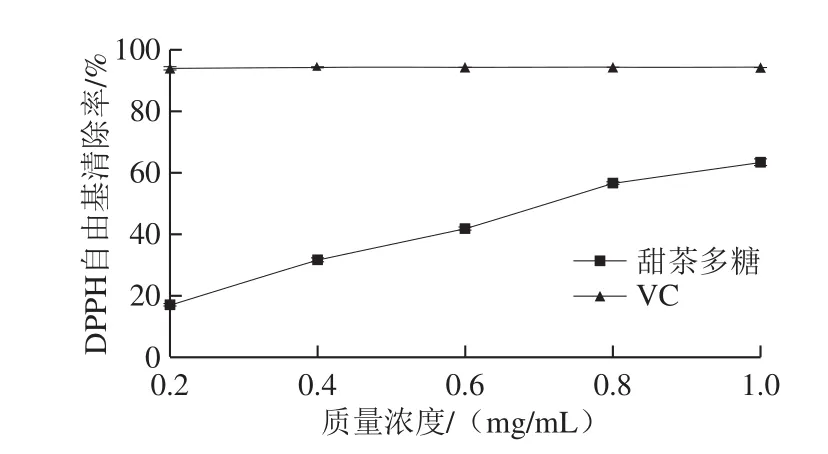
图4 VC和甜茶多糖的DPPH自由基清除能力Fig.4 DPPH radical scavenging activity of VC and polysaccharides from Rubus suavissimus S.Lee
由图4可知,在0.2~1.0 mg/mL的质量浓度范围内,甜茶多糖对DPPH自由基清除能力呈现出剂量依赖性,在质量浓度为1.0 mg/mL时,甜茶多糖的DPPH自由基清除率达到63.7%,低于1.0 mg/mL VC的清除率(94.5%),但甜茶多糖来源于天然产物,相比而言其清除能力较强。李月等[28]研究苦胆草多糖的DPPH自由基的清除能力,在质量浓度0.5 mg/mL时,其清除率为24.0%,低于相同质量浓度甜茶多糖的清除率(36.0%)。Bi Hongtao等[17]研究真菌多糖的抗氧化活性,其结果显示,在质量浓度1 mg/mL时,真菌多糖的DPPH自由基清除率为55%,低于本实验相同质量浓度甜茶多糖的清除率。结果表明,水提甜茶多糖具有较强的DPPH自由基清除能力。
2.3.3 甜茶多糖·OH清除能力分析结果
·OH是活性氧中对生物体毒性最强的一种自由基,过量的·OH可以损伤细胞膜、杀死红细胞、降解DNA等[29]。
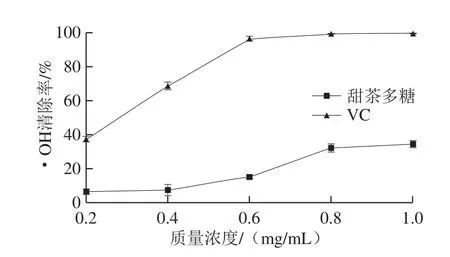
图5 VC和甜茶多糖的·OH清除能力Fig.5 ·OH radical scavenging activity of VC and polysaccharides from Rubus suavissimus S.Lee
如图5所示,随着多糖质量浓度的增加,其·OH清除能力增强,并呈现一定的剂量依赖性。在质量浓度为1.0 mg/mL时,甜茶多糖的·OH清除率为34.5%,与VC在0.2 mg/mL时的清除率相当,证明甜茶多糖具有一定的·OH清除能力。分析其机制可能是多糖组分通过提供氢原子来终止自由基链反应[30]。Chen Fang等[31]研究了山楂多糖的·OH清除能力,在质量浓度为0.8 mg/mL时,其清除率为75%,高于本实验结果。朱娇娇等[32]研究了3 种天然植物多糖的抗氧化作用,在质量浓度为2 mg/mL时,3 种植物多糖的·OH清除率均低于20%,低于本实验中1.0 mg/mL的甜茶多糖清除率(34.5%)。
2.4 甜茶多糖对斑马鱼胚胎和幼鱼毒性分析结果
受精后发育至6 h的斑马鱼胚胎和受精后发育至3 d的幼鱼(图6)分别置于不同质量浓度的甜茶多糖溶液的毒性表型和毒性实验结果如表2所示。
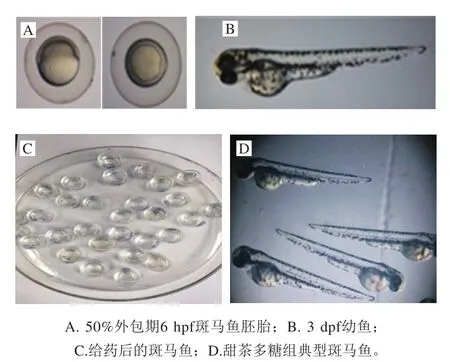
图6 斑马鱼胚胎和幼鱼暴露于甜茶多糖的毒性实验结果Fig.6 Toxicity results of zebrafish embryos and juveniles exposed to polysaccharides from Rubus suavissimus S.Lee
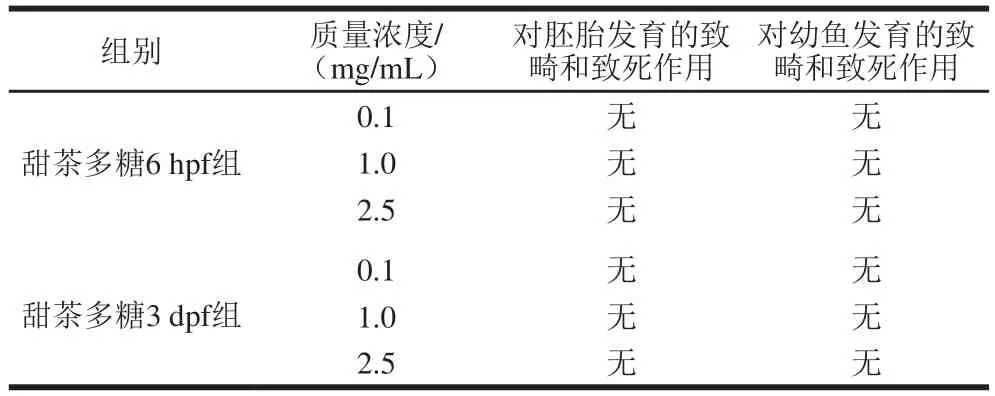
表2 斑马鱼胚胎和幼鱼毒性实验结果Table 2 Results of zebrafish embryos and juveniles toxicity study
由表2、图6可知,在0.1、1.0、2.5 mg/mL的质量浓度下,甜茶多糖均未表现出对斑马鱼胚胎和幼鱼的致畸和致死作用,表明甜茶多糖具有一定的安全、低毒特点。丁兴杰等[33]以受精后48 h发育正常的斑马鱼胚胎作为心脏毒性模型,研究了附子多糖的毒性。结果表明,附子多糖干预后,斑马鱼心率、胚胎死亡率无明显变化,与本实验结果一致。同时,程祖春等[34]也将斑马鱼胚胎模型作为抗肿瘤药物的毒性评价方法。Sarmah等[35]以斑马鱼为模型,评估了环境毒物对心脏发育和功能的影响。采用斑马鱼作为模型生物简便可行、稳定可靠、预测性好,能够为甜茶多糖的生物应用提供理论依据。
3 结 论
本实验以甜茶叶为材料,采用水提醇沉法提取了多糖成分,研究了其组成、体外抗氧化及体内毒性作用。采用苯酚-硫酸法和衍生化高效液相色谱法分别测定了总糖质量分数和单糖组成,并结合傅里叶变换红外光谱进一步证实了多糖组分。结果表明,在甜茶多糖中,总糖质量分数为70.2%,主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、岩藻糖6 种单糖组成,其物质的量比为1.17∶21.79∶3.54∶1.00∶1.33∶2.86。体外抗氧化实验结果表明,甜茶多糖作为天然活性成分,具有一定的抗氧化能力,其中DPPH自由基清除能力相对较强。以斑马鱼为模型生物的体内毒性实验表明,甜茶多糖未表现出对斑马鱼胚胎和幼鱼的致畸和致死作用,证明其具有安全、低毒的特点,本实验为甜茶多糖的进一步开发和应用提供了依据。
