利用E.coli评价铁碳微电解处理印染废水的生物毒性变化
2020-08-19贾艳萍张真佟泽为王嵬张兰河
贾艳萍,张真,佟泽为,王嵬,张兰河
(1 东北电力大学化学工程学院,吉林省吉林市132012; 2 长春工程学院能源动力工程学院,吉林长春130012)
引 言
纺织工业每年产生约2.2×109t 的废水,其中约80%为印染废水[1-6]。随着新型染料、助剂的应用,印染废水成分日趋复杂,处理难度不断加大,亟需开发工艺简单、运行费用低的印染废水处理工艺。铁碳微电解工艺是将铁屑与活性炭浸没于废水中,利用铁屑内部和铁碳之间的电位差形成电池,产生微型电解电路与废水中的污染物发生反应,提高废水可生化性,这种工艺流程简单、管理方便、运行成本低[7-12]。许多学者利用铁碳微电解工艺处理印染废水,污染物去除率较高。例如,Edison 等[13]采用零价铁结合石墨工艺处理印染废水,当进水pH为3.5、零价铁投加量为3.5 g/L 时,色度、COD 和TOC 去除率分别为100%、67%和59%。Xingu-Contreras 等[14]采用沸石负载纳米铁工艺处理甲基橙废水,当纳米铁与沸石比为0.06∶1、反应时间为16 h时,甲基橙去除率80%。王悦[15]采用铁碳微电解工艺处理印染废水,当进水pH 为3,气水比为3∶1,铁碳填料投加量为600 g/L 时,COD 去除率最高为67%。张禾[16]采用铁碳微电解-Fenton 组合工艺处理印染废水,进水pH 为4,铁投加量为25 g/L,铁碳质量比为1∶2,H2O2投加量为130 mg/L,COD 去除率可达80%。这些研究主要探讨了运行工艺参数对污染物去除率的影响,尚不明晰铁碳微电解工艺处理前后印染废水生物毒性的变化。本课题组[17]前期研究发现,与进水相比,铁碳微电解工艺出水的乳酸脱氢酶(LDH)和活性氧物质(ROS)含量分别下降77%及25%,细胞膜破损率及死亡率降低,对数生长期延长,初步证明了铁碳微电解工艺影响印染废水的可生化性和生物毒性。E.coli是生态系统的重要组成部分,具有生长繁殖快、生物机体小、种群数量大、保存方便等优点,它与高等动物有相似的物理化学特性及酶作用过程[18]。通过分析有毒污染物对E.coli 生物转运和转化的影响,可以反映微生物新陈代谢过程中物质、能量传递与生物群落的变化[19]。目前,尚缺乏利用E.coli 生物学指标的变化评价印染废水生物毒性的系统研究。
本研究采用铁碳微电解工艺处理实际印染废水,利用E.coli 的形态、抗氧化酶系统、生物标志物等的变化,分析实际印染废水经铁碳微电解工艺处理前后的生物毒性变化,从而为实际印染废水中的污染物达标排放提供科学依据。
1 材料与方法
1.1 实验材料
预处理实验、实验装置见课题组前期发表文章[17,20]。
1.2 实验用水
利用E.coli 分析对照组、进水组和出水组生物毒性的变化,对照组采用超纯水配制LB 培养基,实验组分别采用铁碳微电解工艺的进水、出水配制LB培养基,其中铁碳微电解工艺的进、出水组的水质指标如表1所示。

表1 进、出水组的水质指标Table 1 Water quality index of influent and effluent
1.3 分析项目和检测方法
pH 采用pH 计(pHSJ-3F 型,上海仪电科学仪器有限公司)测定;COD、氨氮、色度及浊度采用紫外可见智能型多参数水质测定仪(LH-3BA 型,兰州连华环保科技有限公司)测定;TOC 采用总有机碳分析仪(liqui TOC Ⅱ型,德国Elementar 公司)测定;BOD5采用BOD 测定仪(M7-50A型,兰州连华环保科技有限公司)测定[21];采用紫外-可见分光光度计(UV1700 型,上海奥析科学仪器有限公司)测定MDA、GSH、SOD、CAT及T-AOC[22]。
扫描电子显微镜(SEM)观察采用场发射环境扫描电子显微镜(XL-30 ESEM FEG 型,美国FEI 公司),分析细胞的形态变化[23]。将超纯水、铁碳微电解工艺的进水和出水分别作为对照组、进水组和出水组。将水样8000 r/min 离心15 min,使E.coli 的菌体沉降为菌团,弃上清液;然后加入2.5%戊二醛溶液,振荡菌体,使之均匀分散,置于4℃环境固定2 h,8000 r/min 离心1 min 后弃上清液,采用0.2 mol/L PBS 溶液洗涤3 次;依次加入30%、50%、70%、80%、90%的乙醇,静置15 min,8000 r/min 离心1 min,加入100%乙醇脱水2 次,静置15 min,8000 r/min 离心1 min;将样品置于30℃烘箱内干燥;将样品粘于样品台上喷镀金属膜,置于样品架上观察细胞的形态变化。
采用N800-M生物显微镜(DFM55型,宁波永新光学股份有限公司)观察吖啶橙荧光强度[24]。配制0.01 g/ml 吖啶橙溶液,加入LB 培养基稀释为10-3、10-4、10-5,取E.coli 菌液1 ml 加入到1 L 的LB 培养基中,37℃水浴恒温振荡培养过夜,采用荧光显微镜观察吖啶橙荧光强度。
E.coli 存活率采用台盼蓝拒染法分析[25]。接种处于对数生长期的E.coli,培养24 h,利用台盼蓝进行染色,采用光学显微镜(XSP-BM13C型,上海光学仪器厂)观察,计算细胞存活率。
采用血糖仪(GA-3 型,长沙三诺生物传感股份有限公司)测定葡萄糖含量[26]。将对照组、进水组和出水组制成1 ml的LB培养基,接种处于对数生长期的E.coli,加入0.1 ml 葡萄糖,30℃培养,9000 r/min离心1 min,取上清液测定葡萄糖浓度,并计算进水组和出水组的葡萄糖消耗量抑制率。
采用等温量热仪(KDHW-800A 型,深圳市万博仪器仪表有限公司)测定热值[27]。将E.coli于37℃培养24 h,以2%接种量分别接种于对照组、进水组和出水组培养基中,取5 ml 接种过的培养基加入到25 ml安瓿瓶,测定其热值变化。
采用荧光分光光度计(RF-5301PC 型,日本岛津公司)测定内源荧光蛋白和细胞膜电位。采用核酸蛋白检测仪(HD-3001 型,上海市嘉鹏科技有限公司)测定核酸蛋白含量[28]。将对照组、进水组和出水组分别加入50 μl 菌液,37℃恒温振荡培养,每隔2 h 取样,500 r/min 离心3 min 取上清液,2000 r/min离心5 min 取下层菌体漂洗,稀释至OD600为0.3,取5 ml 菌液,加入250 μl 的罗丹明123,37℃恒温振荡培养30 min,2000 r/min 离心5 min,洗涤,分别于525 nm和340 nm测定荧光发射光谱,测得内源荧光蛋白和细胞膜电位,再将得到的E.coli 菌液,稀释至OD600为0.1,冷冻破碎,测定核酸蛋白含量。
2 结果与分析
根据课题组前期的研究基础[20],铁碳微电解工艺处理印染废水的优化条件为:初始pH 为4、铁投加量为80 g/L、铁/碳质量比为0.8、反应时间为90 min 时,COD、浊度、色度、氨氮及TOC 去除率达到最高,分 别 为75.48%、87.88%、75.34%、92.01% 及81.09%。在最优工艺条件下进行E.coli 生物毒性实验。
2.1 细胞形态分析
将超纯水作为对照,在对照组、进水组和出水组中分别接种等量的E.coli,采用SEM 分析E.coli 表面形态的变化,结果如图1(a)所示。由图1(a)可知,对照组中的E.coli 呈钝圆杆状,细胞饱满,细胞壁紧密,表面光滑,轮廓清晰,形态完整,细胞之间存在大量发丝状细线连接的菌毛,加强了菌体间的机械结合力,有助于致密生物膜形成和电子传递[29]。进水组中的E.coli 呈破碎状态,出现明显的损伤性褶皱及孔洞,细胞两端严重皱缩,毒性强的进水破坏了细胞壁和细胞膜的双重屏障,胞内物质泄漏,细胞坏死;出水组中的E.coli 大部分为正常形态,表面略出现褶皱,可维持正常生命代谢活动。
吖啶橙是一类碱性荧光染色剂,具有价格低廉、可多次染色观察及荧光强度大等优点。吖啶橙可以透过细胞膜进入细胞内,当吖啶橙进入坏死细胞后,细胞呈橘红色,可以根据荧光颜色的变化反映细胞的状态[30-31]。采用吖啶橙标记的E.coli,如图1(b)所示。对照组中荧光极少,即细胞基本无死亡;出水组中荧光较少,即细胞死亡较少,说明铁碳微电解工艺具有降低印染废水生物毒性的作用;进水组中荧光极多,死亡细胞发出荧光,细胞边界不清,已解体或接近解体,说明未经处理的印染废水毒性极强。

图1 E.coli的微观结构Fig.1 Microstructure image of E.coli
2.2 抗氧化系统分析
2.2.1 MDA 和GSH 含量 E.coli在有毒废水中会产生高浓度的氧自由基,可攻击细胞膜中的多不饱和脂肪酸,最终产物是MDA。MDA 可与硫代巴比妥酸发生反应,生成红棕色的3,5,5-三甲基唑-2,4-二酮,该化合物在532 nm 处有最大吸收峰,吸收峰强度的变化可反映MDA 含量变化程度[32]。E.coli 在对照组、进水组及出水组中的MDA 含量如图2(a)所示。由图2(a)可知,对照组中MDA 含量无明显变化,细胞处于正常生理代谢状态。进水组中MDA含量急剧上升,说明印染废水中有毒污染物含量高,大量污染物附着在细胞表面并与细胞上的不饱和脂肪酸反应,生成含有醛基、羟基和酮基等过氧化物,使细胞发生脂质过氧化反应并产生氧化损伤,因此产生大量MDA,MDA 可导致蛋白质、核酸等交联聚合,影响膜系统的稳定性及流动性,其含量可反映过氧化水平,与细胞防御机制破坏程度呈正相关;后期MDA含量略有下降,细胞功能受损,与脂质过氧化作用有关的酶类被分解。出水组中MDA 含量明显下降,铁碳微电解工艺去除了部分有毒污染物,降低了E.coli的氧化损伤及死亡率。
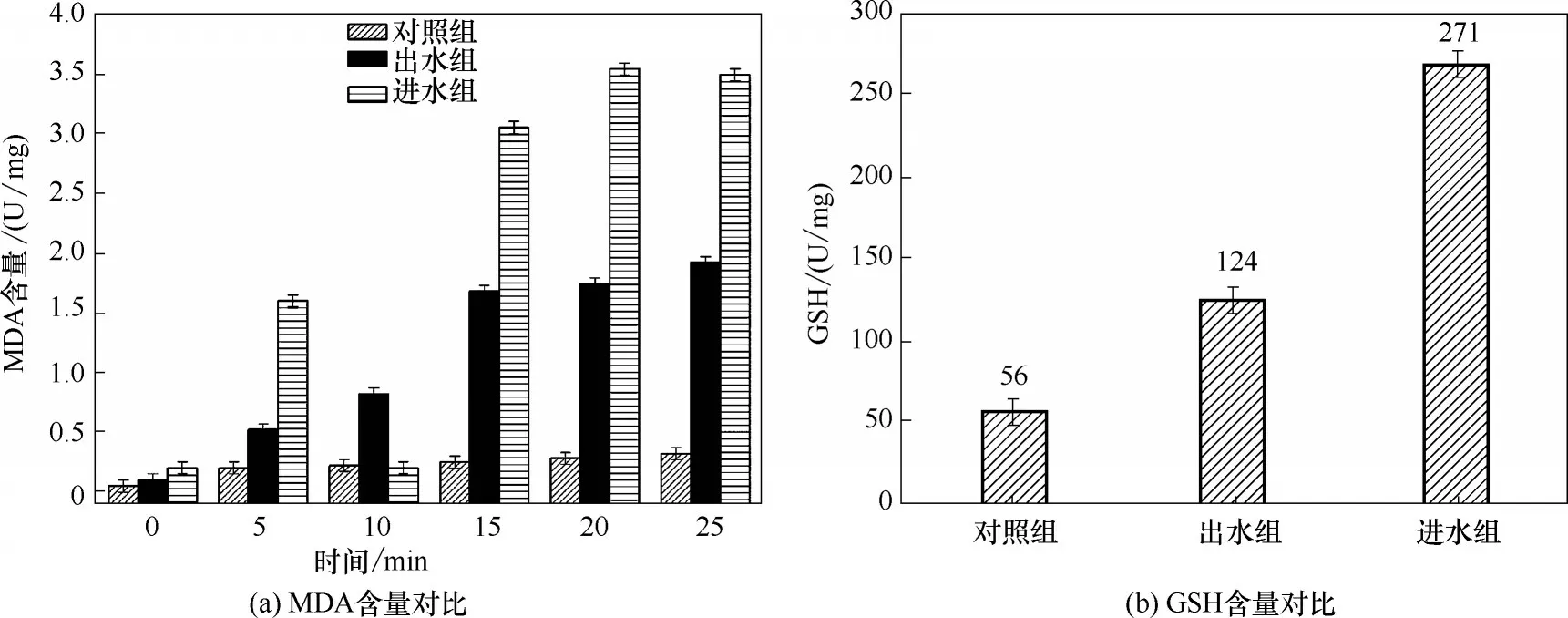
图2 MDA和GSH含量Fig.2 Content of MDA and GSH
GSH 可催化去除H2O2、超氧阴离子自由基(·)等,降低细胞氧化损伤程度[33-34]。E.coli 在对照组、进水组及出水组中的GSH含量如图2(b)所示。由图2(b)可知,出水组中GSH含量降低,这说明通过铁碳微电解工艺,细胞中含巯基的酶处于较高的稳态,避免血红蛋白被氧自由基破坏;然而进水组中GSH 含量最高,进水污染物引起细胞的H2O2、O-2·含量升高;还原型GSH 可与5,5'-二硫代-双-(2-硝基苯甲酸)反应,生成谷胱甘肽二硫化物(GSSG)和黄色的2-硝基-5-巯基苯甲酸,GHS 含量与被氧化程度呈负相关。
2.2.2 抗氧化酶活性分析 SOD 属于抗氧化酶系统,在细胞内的活性高低可反映生物的衰老与死亡程度。SOD 活性变化可反映细胞清除氧自由基的能力。E.coli 在对照组、进水组及出水组中的SOD活性变化如图3(a)所示。由图3(a)可知,对照组中SOD 活性保持稳定,出水组SOD 活性居中,经过铁碳微电解工艺处理后的印染废水生物毒性在一定程度上降低。而进水组中SOD 活性先是急剧上升,在有毒有害环境的胁迫下,细胞短时间之内即可作出相应的应激机制,快速合成大量SOD;SOD可清除细胞内的·、羟基自由基(HO·)及氢过氧自由基(HOO·)等,并将其歧化为H2O2和O2,即:+2H+H2O2+ O2。降低细胞内的氧自由基含量,特定抑制·的产生,对细胞的氧化及抗氧化平衡存在重要作用[35-36]。随着时间的延长,活性氧活性升高,SOD 活性逐渐降低,细胞结构被破坏,SOD的氨基酸残基被·OH 或H2O2氧化,产生羰基,影响细胞正常生理功能[37]。
CAT 是一种含巯基的抗氧化酶,可与谷胱甘肽过氧化物酶协同清除H2O2,减少或阻止·OH 的产生,此外可与SOD 协同降低细胞的氧化损伤[38-39]。E.coli 在对照组、进水组及出水组中的CAT 活性变化如图3(b)所示。对照组中CAT 活性波动较小。进、出水组中CAT 活性呈先升高后降低的趋势,这表明E.coli 在受到有毒污染物刺激后,首先产生一定的应激反应,激活CAT 活性来对抗应激反应导致的自由基增加。但是,随着反应时间的延长,CAT活力受到抑制,从而降低了机体清除自由基和抗氧化损伤的能力[40]。CAT与SOD 活性变化趋势基本保持一致,这也反映了在抗氧化反应中两者协同氧化分解活性基团(ROS)的关系,这与张晶[41]的研究结论相似,其研究结果表明:SOD 和CAT 活力变化趋势相近且联合分解ROS。
细胞的抗氧化力与细胞生理状态高度相关,分为以微量元素为活动中心的酶促体系和氨基酸、维生素、金属蛋白质组成的非酶促体系,T-AOC 是评价细胞总抗氧化能力的标志物。E.coli在对照组、进水组及出水组中的T-AOC 活性变化如图3(c)所示。由图3(c)可知,对照组中T-AOC 活性无显著变化。进水组、出水组的T-AOC 均出现先升高后降低的现象,这说明有毒污染物可以通过影响E.coli 的抗氧化能力而产生毒性效应。铁碳微电解工艺通过降解污染物、减弱细胞膜受损程度及减少脂质过氧化物的产生来降低细胞损伤,主要包括3条途径:①消除活性氧、自由基,降低脂质过氧化发生概率;②通过分解过氧化物阻断过氧化链;③去除催化过程中的金属离子[42-43]。
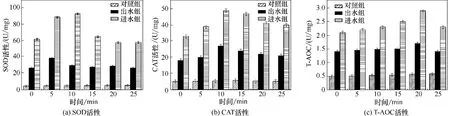
图3 抗氧化酶活性对比Fig.3 Comparison of antioxidant enzyme activity
2.3 生物标志物分析
2.3.1 E.coli 存活率和跨膜电位分析 台盼蓝可与丧失活性或细胞膜不完整的细胞中的DNA 进行结合,将细胞染成蓝色,而正常活细胞可排斥台盼蓝将其染色,因此在显微镜下可以快速、简便的计数细胞的存活率。对照组、进水组及出水组E.coli 存活率的变化见图4(a)。由图4(a)可知,对照组、进水组及出水组的存活率约为89%、23%及61%,铁碳微电解工艺能高效地分解酯类、醇类等污染物,将其转化为易生化处理的小分子污染物,通过降低印染废水中污染物的毒性,来减弱对细胞的膜系统及整体状态的损害,提高细胞的存活率[20]。
E.coli细胞膜的内外电势存在跨膜电位,罗丹明123 作为阳离子亲脂性荧光染料可透过细胞膜,与细胞内膜特异性结合。罗丹明123的最大发射波长为525 nm,因此通过荧光光谱及525 nm处的荧光强度反映细胞膜电位的变化。罗丹明123染色荧光光谱如图4(b)所示。由图4(b)可知,对照组、出水组及进水组的最大荧光强度为103、249、445,且进水组中荧光强度最高,其原因是废水中污染物与细胞表面接触,发生反应使细胞膜受损或使细胞代谢紊乱死亡,细胞内容物流出,导致膜电位较高,这与万嫦玉[28]的研究结论相似,其研究结果表明:实验组较对照组的细胞膜电位有较大提升,其原因是细胞膜受损,溶出的Zn2+进入细胞,导致细胞膜电位上升。
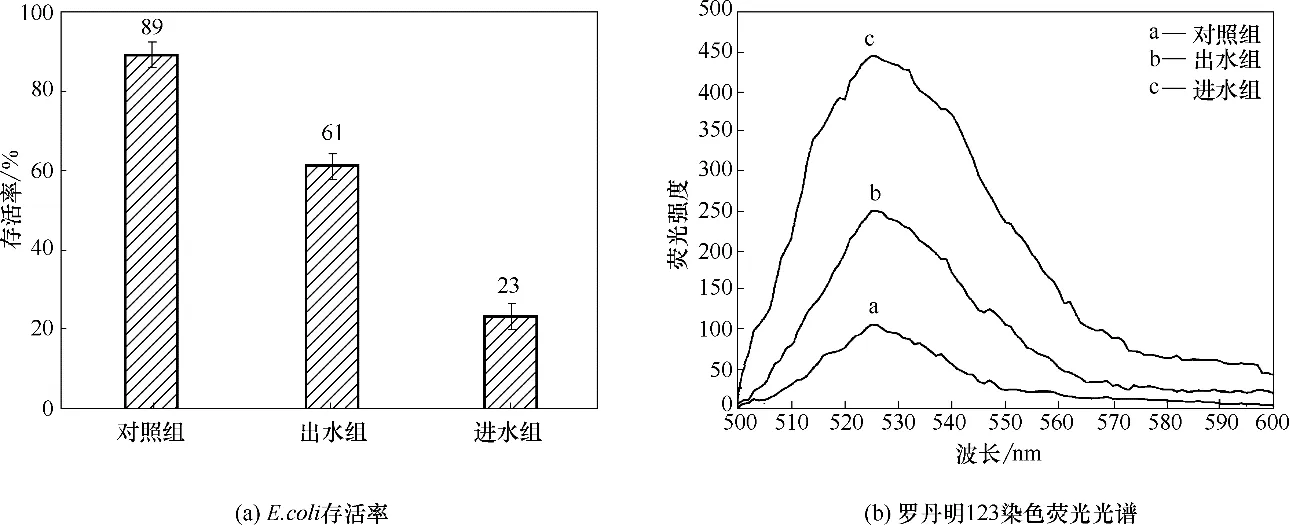
图4 E.coli存活率和罗丹明123染色荧光光谱Fig.4 E.coli survival rate and rhodamine 123 staining fluorescence spectrum
2.3.2 核酸蛋白含量和内源荧光蛋白分析 E.coli
为原核生物,拟核及细胞膜上存在少量具有转运、孔道及调控膜通透性的蛋白质等,与细胞生命活动密切相关,因此通过测定核酸、蛋白质含量变化,可反映细胞的完整程度。细胞的核酸蛋白含量见图5(a)。由图5(a)可知,由于铁碳微电解工艺降解了大部分有毒污染物,与进水组相比,出水组核酸含量升高、蛋白质含量降低;进水组中污染物引起细胞核酸损伤,导致核酸含量降低,同时污染物与蛋白质发生反应,使其空间结构发生变化,导致其变性失活,蛋白质含量升高[44]。由于核酸、蛋白质是细胞生长代谢的关键物质,因此废水中有毒污染物导致细胞的物质合成能量代谢受损。
E.coli细胞内存在大量蛋白质,部分蛋白质含有可发射荧光的氨基酸即称内源荧光,例如色氨酸、苯丙氨酸及酪氨酸等,在270~340 nm 间存在荧光吸收情况,在约340 nm 处存在最高荧光发射峰[45]。内源荧光蛋白荧光光谱如图5(b)所示。由图5(b)可知,对照组、出水组及进水组的最大荧光强度为719、526、247,且对照组及出水组中荧光光谱趋势一致,进水组中荧光强度最弱,其原因可能是污染物进入细胞,与蛋白质中的氨基(—NH2)、巯基(—SH)发生反应,使得蛋白质空间结构发生变化甚至变性失活,导致其荧光特性减弱[46]。

图5 核酸蛋白含量和内源荧光蛋白荧光光谱Fig.5 Nucleic acid protein content and endogenous fluorescent protein fluorescence spectrum
2.3.3 葡萄糖消耗量和热值测定 葡萄糖是E.coli的主要营养物质,当暴露于有毒污染物时,细胞代谢会受到严重影响,此时葡萄糖消耗量会降低。采用血糖仪检测培养液中的葡萄糖消耗量,得出对照组<出水组<进水组,与对照组相比,进水组与出水组葡萄糖消耗量抑制率分别为85%和47%。E.coli细胞表面带负电荷,可与带正电荷的污染物发生吸附作用,使细胞膜的黏滞性发生改变,导致细胞膜通透性和物质运输交换速率发生改变,对细胞生长产生抑制作用。这与Fang 等[47]的研究结论相似,其研究结果表明:根据E.coli 的葡萄糖消耗量可准确评估其急性生物毒性,对照组中E.coli 消耗大量葡萄糖,而存在重金属的实验组中,E.coli代谢紊乱、葡萄糖消耗量降低。
采用等温量热法检测细胞的热值变化,37℃时E.coli 的代谢产热曲线如图6 所示。由图6 可知,E.coli 发生分解、合成及其他反应的生长代谢过程中,热量发生变化。活细胞的热量释放值远大于吸收值,当处于有毒有害环境中时,可影响细胞的生长。E.coli达到放热峰值之前处于对数生长期,细胞快速生长繁殖。对照组、出水组和进水组中代谢产热曲线的变化规律相似,即均呈先升高后降低的趋势,进水组和出水组热值分别为对照组的71.20%和86.83%。因此进水组中的细胞生长最为缓慢,有毒污染物对E.coli 的代谢存在抑制作用,导致其产热减弱,出现停滞期延长、生长峰后移及最大发热功率降低的现象。

图6 E.coli在37℃时代谢产热曲线Fig.6 Metabolic heat curve of E.coli at 37℃
3 结 论
(1)通过SEM 和吖啶橙标记分析可知,进水组中的E.coli 呈破碎状态,而出水组中的E.coli 多数为正常形态;出水组抗氧化酶系统中MDA、GSH、SOD、CAT、T-AOC等指标均显著低于进水组。
(2)出水组和进水组E.coli 的葡萄糖消耗量抑制率分别为47%和85%;出水组中E.coli 的热值和内源荧光蛋白分别升高21.95%和112.96%,核酸含量降低44.04%;进水组中E.coli 的热值、内源荧光蛋白及核酸含量均低于出水组,蛋白质含量高于出水组。
(3)铁碳微电解工艺能降低实际印染废水中的生物毒性,减少细胞破损量、降低氧化损伤程度,提高废水的可生化性。
