CO2催化氢化制清洁能源的研究进展及趋势
2020-08-19周柒丁红蕾郭得通潘卫国杜威
周柒,丁红蕾,2,3,郭得通,潘卫国,2,3,杜威
(1 上海电力大学能源与机械工程学院,上海200090; 2 上海发电环保工程技术研究中心,上海201600;3 机械工业清洁发电环保技术重点实验室,上海200090)
引 言
能源作为社会发展的基石,是推动现代科技发展的重要保障,自工业革命以来,大量的化石燃料在燃烧过程中过量排放的CO2是引发全球温室效应的主要原因[1]。图1 所示为自1960 年以来全球CO2含量变化趋势,由图可知大气中CO2的含量从1960 年的575 mg/m3,快速增长到2019年的745 mg/m3,同比增长约29.51%,年平均增长值为2.83 mg/m3。值得注意的是,近十年的平均年增长值达到了3.92 mg/m3,速长率为38.85%。因此,为抑制温室效应带来的影响,联合国政府间气候变化专门委员会(IPCC)最近建议到2100 年将温升控制在1.5℃以下,为此需要在2030 年之前减少45%的温室气体排放量,2050 年实现零排放。在此背景下,如何高效、经济、环保地降低大气中的CO2含量越发成为人们关注的热点。

图1 全球CO2含量变化趋势Fig.1 Variation trend of global CO2 content
目前,CO2的处理方式主要分为碳捕集与封存技术(carbon dioxide capture and storage,CCS)[2]和碳捕集与利用技术(carbon dioxide capture and utilization, CCU)[3]。CCS 可在短期内有效降低大气中CO2含量,但是并不能根本性解决问题,且存在经济效益低、潜在长期储存能力的不确定性等缺点,发展存在明显的不足;CCU 从根本上解决问题,将CO2转化为高价值的化合物或燃料,在降低大气中的CO2含量同时实现碳资源化的循环利用,这对于未来化工与能源行业的可持续低碳经济的发展具有重要的意义,因此CCU 逐渐成为处理CO2的主要方式[4]。
目前常用的CCU 技术包括热催化、光催化、电催化、生物催化以及等离子体催化等。其中,热催化技术作为传统技术在近年来取得了极大的进展,反应温度显著降低。图2 为热转化(无催化剂)CO2的转化效率与能量效率。由图可知受限于CO2自身的强热稳定性,在无催化剂条件下,热转化CO2的能耗极高,导致单纯热转化CO2技术的经济性差,若采用化石能源作为能源,还易造成二次温室气体的排放。热催化是热转化添加催化剂演变而来。近年来,热催化技术在高效催化剂作用下,使CO2分解反应所需的温度降至200~300℃,但是热催化所用能源普遍是非可再生能源,不具有环保性,在此不作过多阐述。目前,较新型的CO2氢化技术有光催化、电催化、生物催化以及等离子体催化等,这些催化方法可脱离化石能源发生反应,有良好的发展前景[5]。
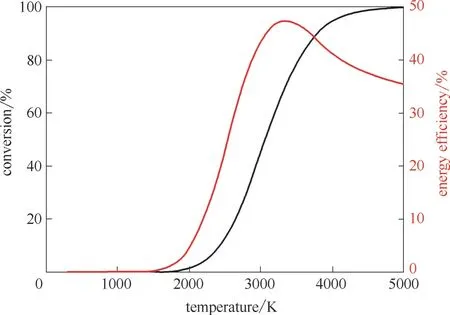
图2 热转化CO2反应转化率与能源效率[5]Fig.2 Conversion efficiency and energy efficiency of CO2 thermal conversion reaction [5]
当前CO2转化利用的方法主要有CO2分解、CO2甲烷重整和CO2氢化等。其中,CO2氢化在实现CO2减排的同时,结合H2生成CH4、CH3OH、HCOOH 等高价值的清洁能源[6],并解决了H2的安全运输问题。此外,H2自身的强还原性以及甲醇经济[7]的发展使得CO2氢化越发受到人们的关注。但目前综合多种新型催化技术对CO2氢化进行探讨的文献较少。因此,本文总结近五年来光催化、电催化、生物催化以及等离子体催化等相关的主要研究成果,从反应机理、催化剂等方面综合分析多种技术催化CO2氢化的发展现状以及各自的优缺点,并对CO2氢化的发展方向作出展望。
1 光催化CO2氢化技术
光催化CO2氢化技术的反应机理如图3 所示。当照射在催化剂(如Pd/TiO2)表面的光的能量(hν)高于带隙(Eg)时,会激发价带(valence band, VB)上的电子跃迁到导带(conduction band,CB)上,同时在VB 上形成的氧化性空穴将H2氧化为H+,CB 上的光生电子跃迁到催化剂表面,作为还原剂将CO2与H+转化为CO、CH4、CH3OH、HCOOH 等C1产物,产物类型由参与反应的光电子数决定,例如:2e-生成CO 或HCOOH,6e-和8e-分别生成CH3OH和。该技术利用光能将CO2转化为高价值的化合物和燃料,成本低,是一种很有前景的绿色转化技术,符合可持续发展战略的思想,在未来的CO2处理市场中具有强力的竞争力。然而,该技术目前还存在一些不足,如能源利用效率低、CO2吸附性能差、光生电子空穴分离效率低等,有待进一步的研究。由于催化剂是光催化转化CO2氢化的研究核心,是决定该技术得以实际运用的重要因素之一,所以本文以催化剂为核心介绍近年来光催化CO2氢化的研究进展。
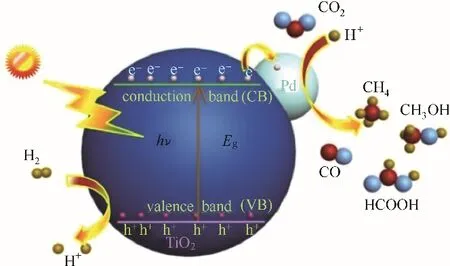
图3 光催化CO2氢化反应机理Fig.3 Mechanism of photocatalytic CO2 hydrogenation
1.1 金属氧化物
TiO2是一种N 型半导体,具有电子迁移率高、稳定性强等特点,被广泛应用于光催化领域[9]。但TiO2电子空穴的快速复合使其催化CO2氢化制备C1 化合物的产率较低[10-11]。研究发现TiO2表面掺杂Ce[10]、Cu[12]、Au[13]等,可改善TiO2光响应范围;掺杂Cu[12]与Pd[11]能抑制电子空穴复合,提高催化剂比表面积;掺杂Ti3C2可优化界面微观结构,诱导产生晶格空位,抑制电子空穴复合,增强多电子反应的电子积累与光生电子转移范围,提高光催化活性[14]。此外,在TiO2/Ti3C2异质结构中引入亚胺配体与Pd,可进一步功能化为Pd/N-TiO2/Ti3C2,增强对CO2的催化性能[15]。对于相似的TiO2-Ti3C2Tx纳米复合材料,在EtOH-H2O 混合溶液中加入乙醇,可增强水热反应的空间位阻效应,抑制TiO2纳米颗粒尺寸的生长[16];TiO2中掺杂CuInS2可产生Z 型异质结,促进电荷分离与提取,提高光吸收能力、比表面积与催化活性[17]。此外,使用石墨烯氧化物/还原石墨烯氧化物层包裹TiO2纳米管,二者相互桥接的独特结构有助于光生电子空穴对的分离以及电子的转移[18]。
近年来,黑色TiO2因其外层缺陷能产生中间带隙,使得TiO2价带边缘上升,促进了对光的吸收,提供更多的捕获位点以分离光生载流子,促进电子转移,表现出更高的光催化活性而备受关注。Fu 等[19]采用硫氰酸钾(KSCN)改性黑色TiO2,发现表面钝化诱导的界面偶极效应改善了电荷的动力学行为,使得催化剂表面携带更多的负电荷,并通过DFT 证明了SCN-H-Ni-TiO2具有能带能量转移和界面偶极子效应。Ye 等[20]使用负载Ni 的反蛋白石结构黑色TiO2(IO-BTiO2/Ni)还原CO2,发现反蛋白石结构具有缓慢的光子效应,无序层与引入的Ni 使得IOBTiO2/Ni 具有较高的光捕捉能力与催化性能。Zhao等[21]研究发现在黑色TiO2引入Cu 可增强催化剂吸收可见光的能力,产生更多的氧空位,并抑制电子空穴复合,从而增强催化活性。
Cu/ZnO 是光催化CO2氢化中最有效的光催化剂之一。因为ZnO提高了Cu粒子的分散度,两者之间的强金属载体相互作用(strong metal support interaction,SMSI)能显著提高甲醇的选择性。SMSI具有显著的形状效应,板状的ZnO(002)极性面与Cu 的SMSI 远高于非极性面,对甲醇选择性也更高[22]。进一步研究发现,Cu/ZnO 催化剂中引入适量的CdSe、g-C3N4和Al3+等,可加强Cu/ZnO 的催化活性与产物选择性,其中g-C3N4价格最便宜、无毒、最易与ZnO 发生杂化反应。Deng 等[23]通过g-C3N4对ZnO 改性制备得到的Cu/g-C3N4-ZnO/Al2O3相较于传统的Cu/ZnO/Al2O3的催化性能更强。Li 等[24]发现在Cu/ZnO催化剂的前体中引入少量的Ca3+会形成镓尖晶石ZnGa2O4,产生具有催化活性的CuZn 双金属纳米颗粒,能显著提高CO2转化率与甲醇的选择性[25]。
In2O3是一种新的N 型半导体材料,其禁带宽度较宽。近年来的研究表明In2O3负载ZrO2,可以增加活性空穴的数量,表现出优于Cu-ZnO-Al2O3的催化性能[26];In2O3负载WO3可形成Ⅱ型异质结,抑制电子空穴复合,增强光催化性能[27];In2O3负载CeO2制备异质结催化剂,可促进光生电子的分离与转移,提高催化剂活性[28];在In2O3表面负载碳纳米涂层,可促进对可见光的吸收,增强CO2吸附性,促进CO2转化[29]。Wang 等[30]研究具有负载缺陷的棒状纳米超晶格结构的In2O3-x(OH)y催化CO2氢化制备甲醇,在模拟常压太阳光辐射下的选择性为50%,甲醇产率为60 μmol/(g cat·h)。
1.2 金属硫化物
金属硫化物由于带隙小、催化活性高、能吸收可见光等优点被广泛应用于光催化CO2领域。然而,由于金属硫化物的稳定性较差,转换效率较低,适用性受到限制,可通过耦合其他半导体、金属、金属氧化物作为助催化剂以增强催化性能[31]。
CdS 是一种传统的Ⅱ-Ⅵ半导体,带隙为2.42 eV,聚光能力强[32]。然而,由于电子空穴快速复合和材料光腐蚀,使得CdS表现出不稳定的光催化性能,可通过沉积助催化剂进行形貌调整与改性,如CdS沉积、可抑制电子空穴复合;沉积、可协同促进Z 型异质结结构转移,从而提高CdS 光催化活性。此外,Ijaz 等[37]研究表明花束状CdS/CdV2O6复合材料催化剂的表面能提供大量活性位点,使得光催化性能增强。
ZnS是一种宽带隙(3.6 eV)半导体,还原电位为1.8~2.0 V[38],具有较高的CB 电位与表面活性,可高效转化CO2。然而,胶状的ZnS 禁带过宽,只能在紫外光条件下工作。Meng 等[39]研究表明Cu 作为ZnS的掺杂剂可在CB 上形成电子给体能级,将ZnS的吸收光谱扩展至可见光区域;Cd 作为ZnS 的助催化剂,可对催化剂表面进行修饰,从而显著提高CO2还原能力与甲酸选择性,并发现Cd 的s 轨道在带边缘的能级密度远高于Zn的s轨道,且能带中心较低,从而显著促进电荷从ZnS 的CB 转移到Cd2+修饰的表面促进CO2转化。
除上述硫化物之外,Sharma 等[31]研究了Cu3SnS4光催化CO2氢化制备CH4,发现Cu-Sn 端(001)表面对CO2的转化与吸附具有显著的促进作用。Primo等[40]通过热解(NH4)2MoS2,制备负载石墨烯的MoS2以催化CO2制备CH4,发现MoS2/G 外部MoS2局部转化为MoO3的催化活性虽然较低,但表现出更高的甲烷选择性。
1.3 其他新型光催化剂
g-C3N4是一种无金属聚合物半导体材料,具有耐化学性、耐热性、制备成本低等优点[41]。然而,由于光生电子的快速复合、光吸收效率低以及电荷分布等因素限制了g-C3N4在CO2氢化方向的应用,可通过负载金属、调整电子结构以及改进催化剂制备方法等措施提高其催化性能[42]。Mondelli 等[43]研究了g-C3N4负载不同金属纳米材料的催化活性,发现负载Pd 可提高CO2活性位点附近的H2分裂位点,表现出最高的催化剂活性。此外,有研究表明g-C3N4掺杂Cu 可产生更多的CO2吸附活性位点[44];g-C3N4掺杂S,可减小g-C3N4带隙,使得吸收光谱发生红移,并促进电荷分离,抑制电子空穴复合,延长载流子的使用寿命,从而提高光催化效率[45]。Wang 等[46]研究三嗪基和庚嗪基的g-C3N4(t-g-C3N4和h-g-C3N4)催化CO2氢化,发现h-g-C3N4具有更低的反应势垒、更窄的带隙与更广离域电子分布,从而增强对可见光的吸收以及电子的流动性,促进CO2的转化。
石墨烯是一种二维材料,具有较高的比表面积与禁带宽度接近于零等特性而被应用于光催化CO2领域[47]。Ahmed 等[48]考察了TiO2纳米盒、TiO2/rGO 以及TiO2-(Fe3O4@SiO2)-rGO 的缺陷对光催化CO2氢化制备CH4的影响,发现降低TiO2纳米盒的体/表面缺陷的相对密度比可以显著提高CO2转化率,TiO2与rGO 偶联表现出最高的光催化活性。Wang 等[49]发现多孔复合光催化剂HCP-TiO2-FG 具有良好的催化性能、较高的比表面积、优异的CO2吸附和扩散性能,能提高可见光吸收效率和光电分离效率,从而促进CH4的生成。
金属有机框架(metal organic frame, MOF)是由金属原子或原子团簇有机配体构成的新兴晶体多孔材料,具有催化活性高、可调节性好、分子可修饰性强等优点[50]。Ye等[51]设计UiO-66-P-BF2催化CO2氢化制备HCOOH,发现催化剂经过官能化以及化学吸附CO2和H2后,保持稳定的多孔结构,且通过解离吸附活化H2和CO2的氢化反应所需的能量远低于化学吸附H2与CO2的氢化反应。
近几年,光催化研究主要是通过掺杂、负载、沉积等方法来改善光催化剂的光谱吸收能力、电子-空穴分离效率等。此外,光催化的表面反应动力学也得到进一步研究。催化剂作为光催化CO2氢化的主要研究内容,涉及了金属氧化物、金属硫化物、有机金属复合物以及石墨烯、MOF等多种材料(表1)。然而,目前光催化中催化剂的研究仍处于基础研究阶段,所以研发高性能催化剂,进一步改善光谱吸收能力、电子-空穴分离效率等光催化剂的性能等将是光催化CO2氢化技术未来发展的主要方向。
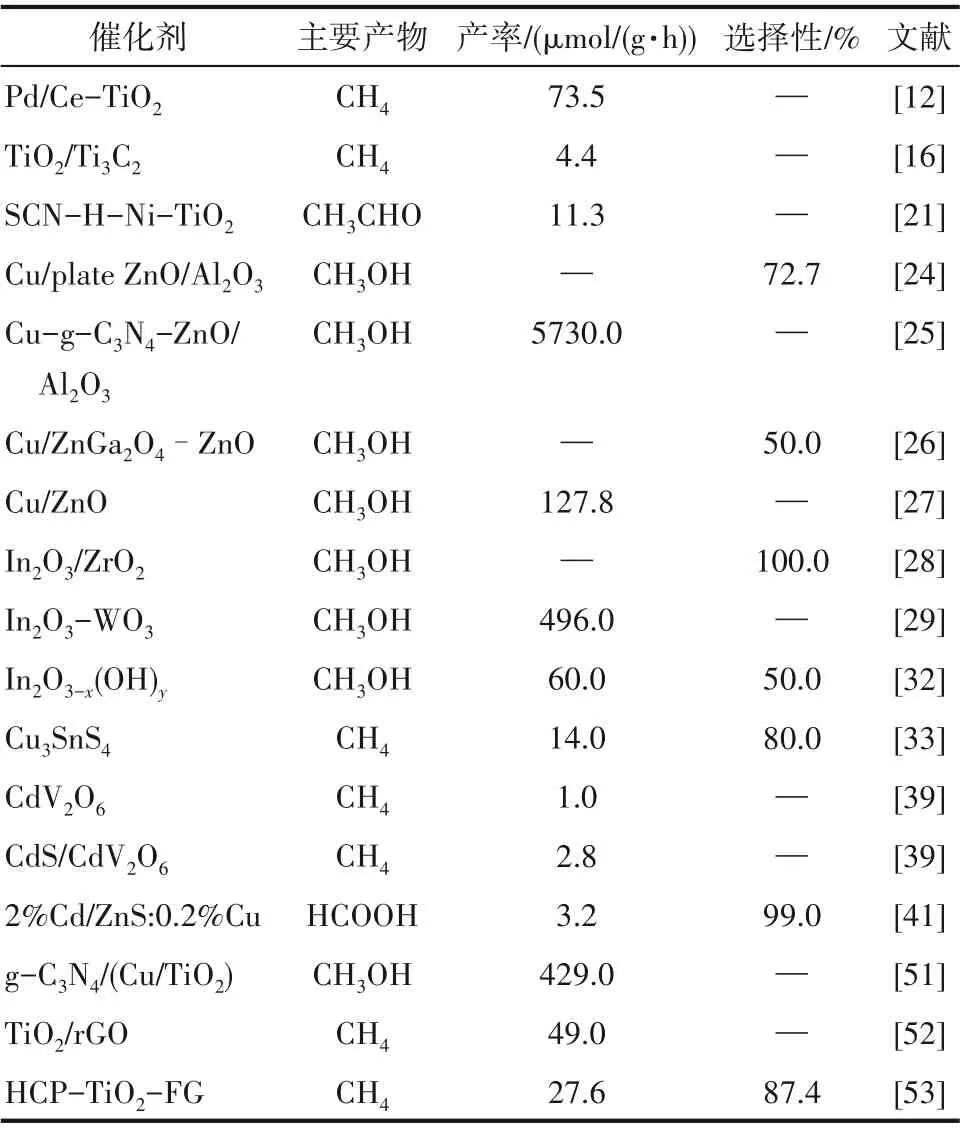
表1 不同光催化剂的活性对比Table 1 Comparison on activities of different photocatalysts
2 光热催化CO2氢化技术
光热催化CO2氢化技术是由传统热催化耦合光催化形成的新型催化技术(图4)。该技术利用纳米材料吸收的光能转化为电子或空穴谐振的动能或电子跃迁能,产生表面局域等离子体共振效应,通过晶格散射的振动产生快速热弛豫现象,迅速将光能转化为热能,从而使得纳米金属局部温度显著升高,产生光热效应。该技术相较于传统热催化或光催化的区别在于充分利用太阳辐射的光和热,使得能耗显著降低,从而获得更高的能源效率[54],在未来的CO2市场中具有一定的竞争力。然而,该技术作为新兴技术,目前存在着反应机理不明确、反应体系有待优化以及催化剂性能较低等问题有待于进一步的改进。目前的研究领域涉及纳米材料如窄带隙半导体材料、金属纳米晶体、层状双氢氧化物等。

图4 光热催化CO2氢化反应机理Fig.4 Mechanism of photothermal catalytic CO2 hydrogenation
窄带隙半导体材料(如CuS、MoO3-x等)对红外光具有较强的吸收能力。采用CuS 与TiO2合成CuS/TiO2复合材料催化剂比单独用TiO2表现出更高的CO2转 化 率[55]。Li 等[54]通 过MoO3捕 捉 红 外 区 域(NIR)光子,在MoO3上诱导产生氧空位激发MoO3-x局部表面等离子体共振,从而有效捕捉红外光子,获得更高的CO2转化效率,CH4的产率提高了52 倍。
金属纳米晶体可通过表面等离子体共振(surface plasma resonance, SPR)、非辐射弛豫、光生载流子带内或带间的非辐射弛豫等方式,产生光热效应[56]。Jia等[52]研发了能够响应可见光与近红外光的催化剂Pd@Nb2O5,证明了光热效应是由Pd 纳米晶体的带内或带间的光激发与非辐射弛豫驱动的,同时纳米晶体尺寸也是影响光热转化CO2的重要因素。
层状双氢氧化物(layered double hydroxide,LDH)也被称为水滑石,具有热稳定性、层间离子可交换性与红外吸收性能[53]。Ren 等[57]将Ru 纳米颗粒嵌入LDHs 上制备Ru@FL-LDHs 光热催化CO2氢化制备CH4,发现该催化剂表现出卓越催化活性的原因之一是CO2和H2在超薄LDHs和Ru纳米颗粒组分上的靶向活化。Zhao 等[58]使用LDH/MOF 复合材料制备Cu/Zn/Al 纳米催化剂催化CO2制备甲醇,发现丙酮预处理会显著提高CuAl LDH 的比表面积,有利于甲醇的形成,原因在于ALDH 的微观结构提高了Zn-BTC的活性位分散性。
光热催化CO2氢化技术是近年来的研究热点,涉及半导体、金属纳米晶体、LDH 等多种材料,不同材料的催化性能差异显著(表2)。光热催化技术还处于基础研究阶段,开发新型高效催化剂、对反应机理进行分析并对反应体系进行优化以提高反应效率是光热催化CO2氢化技术未来发展的主要方向。
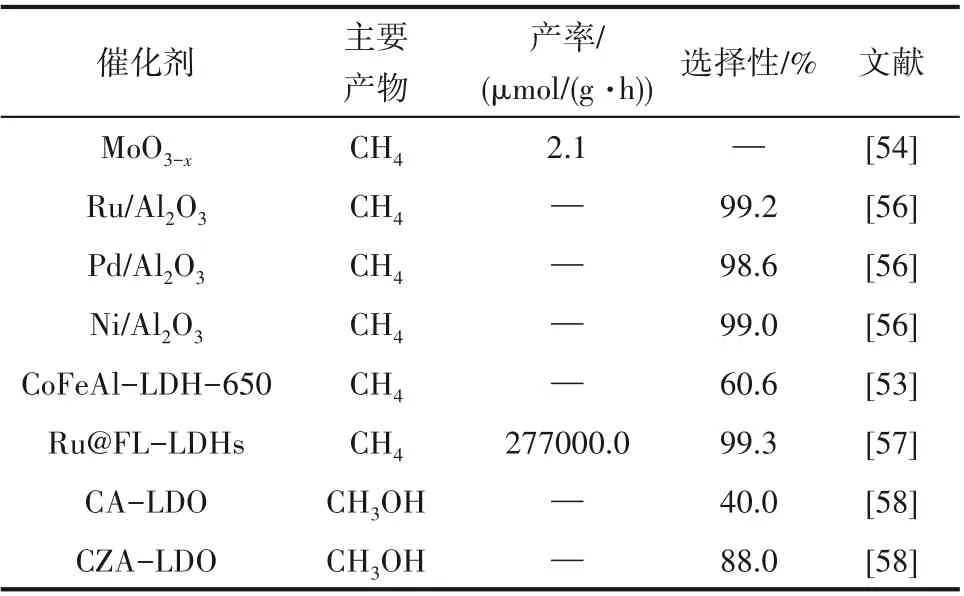
表2 光热催化中催化剂活性对比Table 2 Comparison of catalyst activity in photothermal catalysis
3 电催化CO2氢化技术
电催化CO2氢化的反应原理如图5 所示。在电极与电解质的界面,固体电催化剂作为电极,饱和CO2水溶液作为电解质,催化剂化学吸附CO2后通过电子转移或者质子迁移形成C—O 键或C—H 键,然后产物重新排列,在脱离催化剂后扩散到电解质当中[59]。由于反应过程中水不可避免地被电离,发生析氢反应,使得电催化CO2氢化反应不需要额外加入H2,但是会导致制备烃类产物的法拉第效率较低[60]。该技术可利用间歇可再生能源的过剩能量作为能源,反应条件温和,无须高温高压,反应系统模块化易于规模化推广,是目前最有发展前景的CO2转换技术之一[61]。

图5 电催化CO2氢化反应机理Fig.5 Mechanism of electrocatalytic CO2 hydrogenation
3.1 Cu基催化剂
铜(Cu)是电催化CO2氢化过程中可生成各种碳氢化合物的单金属催化剂[62],通过研究Cu 原子表面特性、电子结构、催化剂组分混合方式、铜与金属物质之间的结合性质等,可提高Cu基催化剂的催化性能。Cu 的不同晶面表现出不同的CO2催化特性[63],Cu(111)促进中间产物COH*的形成,可在高电位条件下结合CH2生成甲烷与乙烯;Cu(100)趋向于形成中间产物CHO*,在较低的过电位条件下两个CHO*发生C—C 耦合[64]。Jiao 等[65]以g-C3N4为分子支架,适当改变Cu-C3N4中Cu 的电子结构,使得Cu 的d 带提升至费米级,从而显著提高Cu 对CO2活化以及中间反应物吸附能力,并首次在Cu-C3N4表面发现具有双活性中心的分子内协同催化作用。Ma 等[66]比较了有序、无序以及相分离Cu-Pd 催化剂,发现C1中间产物在铜原子相邻的表面上发生二聚反应的可能性更高,并分析认为几何效应才是决定双金属CuPd 催化剂选择性的关键。Kattel 等[67]通过比较TiO2/Cu 与ZrO/Cu 的活性与选择性,发现反应界面上的Zr3+对*CO2、*CO、*HCO、*H2CO 等关键中间反应物进行微调,从而提高稳定性,促进了甲醇生成。Ning 等[68]制备复合催化剂Cu2O/NCS,发现NCS 超薄的壳层结构与较高的N 掺杂量提高了Cu2O 的分散性,产生丰富的活性位点,同时促进CO2在催化剂表面的吸附和质子化,进一步提高Cu2O对C2H4的选择性。目前的Cu 基催化剂的研究还处于基础研究阶段,着重于解决反应所需过电位较高、法拉第效率较低、产物选择性低以及快速失活等问题。
3.2 Ti基催化剂
在电催化CO2氢化的反应中,单独Ti 金属的催化活性非常微弱,其氧化物TiO2具备一定的催化活性,而经过金属或金属氧化物改性的TiO2具有更高的活性。Nolan[69]研究表明Bi2O3纳米团簇修饰TiO2表面产生的异质结构经氧化后可增强CO2吸附性。Zhai 等[70]构建(TiO2)3/Ag(110)电催化模型,发现Ag负载在TiO2上会提供电子转移到被吸附的CO2上,促进CO2进一步还原为CO2*,但Ti 的高亲和力使得中间产物通过O 固定在催化剂上,导致OH*难以去除。Yang等[71]比较Au/TiO2与Au/CeOx/TiO2的催化性能,发现覆盖率低的CeOx(0.1 ML)稳定了Ag 纳米颗粒的形成,显著提高催化剂对CO和甲醇的选择性。
3.3 碳基材料
碳纳米管(carbon nanotubes,CNT)具有比表面积大、热稳定性好、表面化学可调等优点[72],能有效改善活性组分的分散,提高反应物的吸附能力,防止材料迁移和团聚,同时具有良好的导电性,可以促进电子从活性物质转移到反应载体上[73],具有良好的吸附和溢出氢的性能,所以在CO2氢化方面表现出良好的催化活性[74]。Wang等[74]以MCNT 为载体研究发现MCNT 的约束作用与Ce 的促进作用有效抑制活性物质的迁移与烧结,抑制碳沉积反应。Kangvansura 等[72]研究了K 与Mn 对负载掺杂N 的碳纳米管NCNTs 的铁纳米粒子(K/Mn/Fe/NCNTs)催化CO2氢化的影响,发现K 作为电子助催化剂修饰Fe纳米粒子的表面活性,降低催化剂的还原性;Mn 作为结构助催化剂能防止催化剂烧结,使得双助催化剂K/Mn/Fe/NCNTs表现出最佳催化性能。Li等[75]在Ni-CNT 上负载Mn,发现热处理温度越高,Ni-CNT相互作用越弱,分析认为是CNTs 表面氧基团(SOGs)界面上的共价键在相互作用中起到了关键作用。Nguyen 等[76]首次在石墨烯纳米管-石墨烯(CNT-GR)上负载PdNi 合金,电催化CO2氢化反应制备甲酸,发现CNT-GR 复合材料作为载体改善了Pd-Ni合金颗粒的分散性,表现出更好的稳定性。
碳纳米纤维(carbon nanofiber,CNF)是活性炭和石墨结合体,具有良好的导热性与孔隙结构,是一种优异的催化剂载体[77]。Roldan 等[78]研究结果表明,相较于Al2O3负载的催化剂,Ru 负载在NCNF 上表现出显著的CH4产率和稳定性,这是由于NCNF具有存储大量COad反应中间物种的能力,从而增强催化剂活性。Castelo-Quibén 等[79]发现CNF 的数量、类型和最终碳相的含量取决于所用的热解金属(Fe、Co、Ni),其中镍催化剂在复合材料中产生大量CNF 与碳相,是最活跃的催化剂。Díaz 等[80]比较CNF与碳纳米球(CNS)负载Co与Fe的催化性能,发现CNF 较弱的金属载体相互作用有利于反应物的吸附,使得CoFe/CNF 对CO2氢化的催化活性较高,CoFe/CNS 金属相互作用较强,会阻碍费托合成反应,但是却有利于碳氢化合物链的生长。
石墨烯是一种单层二维纳米片材料,导电性强,在电催化CO2氢化领域内常作为金属催化剂载体来提高催化剂活性与稳定性[81]。Rogers 等[82]采用Au 纳米粒子与石墨烯纳米带制备GNR-AuNP 电催化还原CO2,发现GNR 的复合矩阵结构和电子性能提高了Au 纳米粒子电化学活性表面积,降低了CO2还原过电位,从而提高了法拉第效率、催化剂稳定性与产率。Huang 等[83]通过涂覆单层氮掺杂石墨烯改进锡箔(SL-NG@Sn)电催化CO2制备甲酸盐的法拉第效率(FE)达到了92.0%,证明了SL-NG 与Sn 箔之间存在协同效应。Han 等[84]通过脱氮方法论证了有缺陷的石墨烯作为电催化剂,具有丰富的催化活性位点、较高的电导率和很强的CO2吸附能力。Wu等[85]报告了不同N 缺陷对N 掺杂三维石墨烯泡沫催化还原CO2的影响,发现相较于普通的石墨烯,表现出更高的选择性、稳定性以及优于Au 和Ag 的催化活性。
表3 是不同电催化剂的活性对比。由表可知,Cu 作为用于电催化CO2氢化的代表金属,在近年来得到了深入的发展,各项性能得到了提升,反应机理推理也进一步深入,同时研究还涉及Ti 基催化剂与碳基材料等多种材料,这为降低反应所需过电位以及开发高性能催化剂提供了参考。然而,目前的电催化技术还处于基础研究阶段,研发更高催化性能的催化剂、对反应体系的优化以及反应机理的进一步深入研究、降低过电位的同时提高产物选择性是该技术未来发展的主要方向。
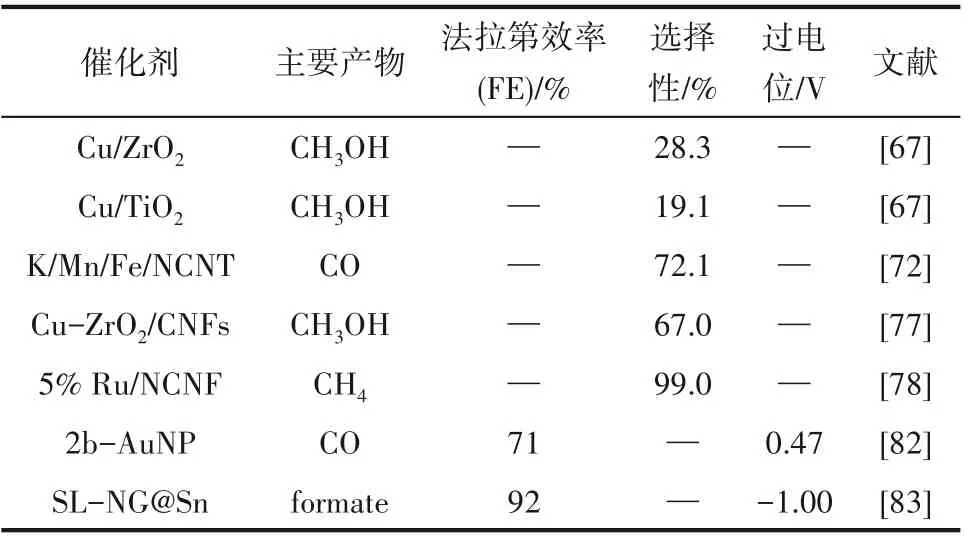
表3 不同电催化剂的活性对比Table 3 Comparison of activities of different electrocatalysts
4 生物催化CO2氢化技术
生物催化CO2氢化技术可在温和条件下利用全细胞作用与固定酶催化CO2氢化,将CO2转化为更低价态的碳化合物,具有较高的时空产率与选择性[86]。然而,由于生物催化系统使用的酶和辅助因子的成本太高以及CO2水溶性较差,使得生物催化的发展在现阶段受到一定限制[87]。结合近年来生物催化的发展情况,本文将从酶、微生物工艺以及酶电催化等三个方面进行讲述。
4.1 酶
在生物催化过程中,酶是非常重要的催化剂,可降低反应的活化能,提高产物的选择性与产率。CO2氢化生成CH3OH 的级联反应通过三种酶和一种辅助因子完成(图6),依次为甲酸脱氢酶(FDH)、甲醛脱氢酶(FaldDH)、醇脱氢酶(ADH),它们分别催化CO2氢化为甲酸、甲酸氢化为甲醛、甲醛氢化为甲醇,在所有的步骤中,NADH 都被用作辅助因子,通过两个电子还原来提供电子和氢。酶优越的催化性能取决于酶的催化基团以及酶活性位点的独特性质。酶的表达、表征、工程以及优化方法的发展是未来所有生物催化CO2氢化反应技术的基础[88]。
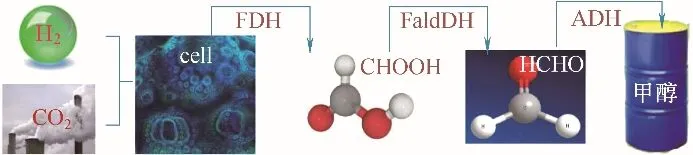
图6 生物催化CO2氢化反应机理Fig.6 Mechanism of biocatalysis CO2 hydrogenation
FDH 在结构、亚基组成以及代谢功能方面具有多样性。针对FDH催化CO2还原为甲酸酯的可逆向相互转化特点,Nielsen 等[89]通过蛋白质序列比对和基因组织分析方法,认为FDH 多样性是由于亚基组成、基因片段组织、酶的结构与机制的不同所导致。Yu[90]使用一种耐氧型甲酸脱氢酶(FdsABG)催化CO2制备甲酸,发现该酶具有可逆性,且所有含钼、钨的甲酸酯脱氢酶,可能也包括甲氧基甲烷呋喃脱氢酶,都是通过简单的氢化物转移机制进行催化。Shiekh 等[91]利用DFT 模拟FDH 活性位点,设计MoIII(tBu)(CO)和WIII(tBu)(CO)用于CO2氢化和HCOOH脱氢,计算表明钼和钨配合物催化CO2氢化反应对应的自由能分别为24.03 kcal/mol 和21.31 kcal/mol(1 cal=4.18 J)。
碳酸酐酶(carbonic anhydrase,CA)通过两步催化反应:(1)氢氧根离子对CO2的亲核攻击;(2)通过电离锌键水分子与去除活性位点的质子实现活性位点的再生,利用游离细胞、酶和固定化系统将CO2转化为碳酸氢盐[86]。CO2本身溶解速度缓慢是限制生物催化CO2氢化反应的重要因素,采用多孔结构的CA,能提高CO2的溶解速度。Wang等[87]研究发现随着CA 的加入,FDH 的底物可能从CO2转化为更易溶的HCO3,从而提高CO2的溶解速率、甲酸生成速率,同时CA 会促进反应过程中相关氢离子的释放,降低pH,通过调节CA/FDH 的比例协调反应速率,避免氢离子的聚集。Piazzetta 等[92]提出了一种新型人工碳酸酐酶,使用Rh(I)替代Zn,发现这种人造酶可以通过直接有效催化CO2氢化制备HCOOH。此外,CA 也会用于CO2捕捉,但是其传质能力差且形成的H2CO3会抑制酶的活性,为提高酶的稳定性与可重复使用性,需寻找新型的固定材料。
在生物催化CO2氢化中,氢化酶可以促进H2的裂解,提高氢化反应速率,常结合Fe 形成高催化活性的铁配合物以催化CO2氢化反应。Chen 等[93]基于[FeFe]氢化酶的活性结构,构建了含有链胺的二羧基二膦铁配合物用于催化CO2氢化,发现[(PH)FeH(CO)2(COOH)]+(5COOH)活性最强,总自由能势垒为23.7 kcal/mol,能在温和条件下高效催化CO2氢化制备甲醇。Dubey 等[94]在铁氢化酶中利用邻羟基取代吡啶基序开发一种Mn配合物Mn2(bipy)2(CO)6催化CO2氢化,证明了[Fe]氢化酶中存在的邻羧基是催化剂高催化活性的关键因素。Yang 等[95]通过DFT计算研究[FeH(PP3)]BF4(PP3= P(CH2CH2PPh2)3)催化CO2加氢的反应机理,发现CO2的还原通过高自旋(HS)三重态和低自旋(LS)单线态两种自旋态进行,并分为CO2活化、CO2插入和异构化三个阶段。
4.2 微生物工艺
微生物工艺催化CO2氢化技术是一种新型生物技术,该技术具有长期稳定、可持续和生物相容等优点,通过调节微生物的种类、生长环境以及生物催化剂等,使得微生物通过新陈代谢作用直接产生目标产物。 硫酸盐还原菌(sulfate-reducing bacterium, SRB)是厌氧菌,被广泛应用于重金属和废水的生物修复,它的氧化还原电位较低,FDH 和氢化酶含量较高,适用于CO2氢化制备甲酸盐,Mourato 等[96]利用SRB 的全细胞催化作用,研究CO2氢化制备甲酸盐的微生物工艺,发现脱硫弧菌的活性最高,开发了能批量生产甲酸盐的生物工艺,该工 艺 的 甲 酸 产 率 为90 μmol/(g dcw·h)。Blanchet等[97]研究利用多种微生物群落结合金属催化剂混合催化CO2氢化制备丁酸和乙酸等产物的生物工艺,发现适当添加FeCl3,使得乙酸产率提升265%,丁酸产率提升73%。Roger 等[98]利用高压反应器中大肠杆菌进行高效的全细胞生物催化作用催化CO2氢化,证明了在1.0 MPa 压力下甲酸产率高于0.5 mol/L,每升每小时超过1 g,同时实现100%的CO2生物转化。
上述生物工艺为多级酶促反应,若简单混合多种酶进行催化反应,会导致效率较低,通过对酶进行固化,以保持酶的稳定性和催化活性,可提高催化产率。Luo等[99]使用共固定化与顺序固定化系统,利用聚合物膜上的FDH、FaldDH 和ADH催化CO2制备甲醇,发现两种酶固定系统具有相似的催化效率,并表明顺序固定系统可用于多级酶联反应,能够在固定酶的期间以及反应过程中优化每个单一步骤的操作条件,同时压力传质的流动模式可以克服酶之间的扩散阻力;共固定系统由于无法有效减缓产物的抑制效果以及相邻酶的底物浓度低的问题,所以不适用于多级酶促反应。
4.3 酶电催化
酶电催化技术相较于生物催化技术,避免了过程中使用昂贵的酶和辅助因子,若采用可再生能源的过剩产能作为能源载体,可进一步降低电源成本。由于生物催化所需的催化剂可以直接从自然界大量获取,对产物具有高选择性与高产率,能在相对温和条件下进行催化反应,使得CO2的转化成本降低了几个数量级,从而具有良好的发展前景[100]。 Kuk 等[101]从 永 达 尔 梭 菌(Clostridium ljungdahlii)中得到含有金属钨的强还原性甲酸脱氢酶CIFDH 结合导电的聚苯胺(PANi)水凝胶建立了电酶平台,发现通过PANi 水凝胶,可以有效地将电子注入到CIFDH 中,在没有NADH 的情况下,PANi-ClFDH 电极在低位过电压下增加了电流密度,从而表现出较强的CO2还原能力。Jang 等[102]采用扭脱甲基杆菌AM1 进行基因工程研究和培养条件优化,提高了生物电催化CO2制备甲酸盐的产量。研究表明MeFDH1 是催化CO2生成甲酸酯的关键酶,重组MeFDH1的表达水平和钨酸盐浓度会显著影响微生物甲酸盐的产量。
生物催化中不同酶活性对比如表4 所示,可以看出甲酸是主要产物,而且产率极高。作为生物催化CO2氢化的主要研究方向,酶以及生物工艺与酶电催化技术等在近年来受到研究者的重视。由于该技术还处于基础实验阶段,所以研发高效稳定的低成本酶、辅助因子再生以及提高CO2的水溶解性成为了生物催化CO2氢化技术未来发展的主要方向。
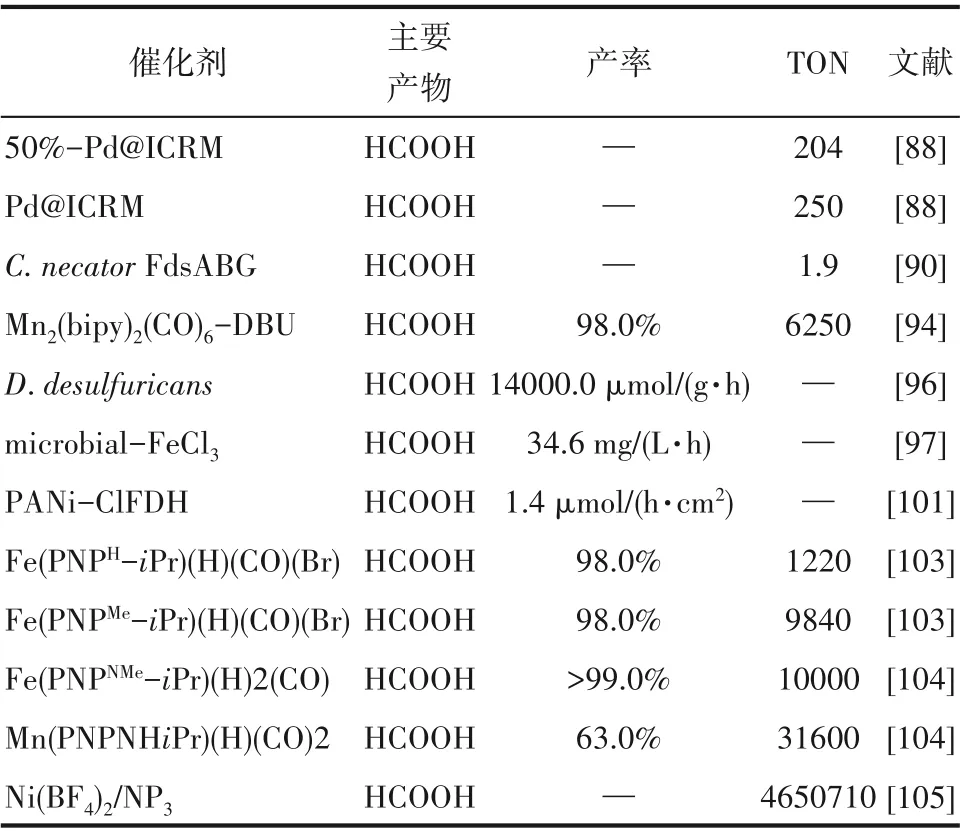
表4 生物催化中不同酶活性对比Table 4 Comparison of different enzyme activities in biocatalysis
5 冷等离子体催化CO2氢化技术
等离子体被认为是物质存在的第四种形态,由电子、自由基、离子、激发态和光子等活性物质组成[106]。等离子体分为热等离子体与非热等离子体(冷等离子体)。由于冷等离子体(nonthermal plasma,NTP)在实验室或工业规模上都比热等离子体更容易获得,因此受到广泛研究[107]。产生冷等离子体的方式有介质阻挡放电(dielectric barrier discharge, DBD)[108-109]、电 晕 放 电(corona discharge plasma)、滑动弧放电(gliding arc, GA)、射频放电(radio frequency, RF)与微波放电(microwave, MW)等,不同方式产生的等离子体表现出不同的CO2转化性能,本文主要对DBD、GA、MW以及RF等4种等离子体进行探讨。
DBD 反应机理如图7所示。反应器的内外金属电极之间介入绝缘物质(如石英玻璃)作为阻挡介质,电极连接高频高压电源。在高压下空气被击穿产生离子、电子等活性物质,质量较轻的电子会被选择性加热形成高能电子与反应气体碰撞,从而激发、电离和解离反应气体以产生离子或自由基等高活性的物质,然后与催化剂表面及其吸附的物质发生相互作用[110],最后迅速地反应生成新的分子如CO、CH4、CH3OH等[111]。

图7 DBD等离子体催化CO2氢化反应机理Fig.7 Mechanism of DBD plasma catalyzed CO2 hydrogenation
近年来,DBD 反应机理已成为此类研究的难点与重点之一。通过建立模型,改变参数进行模拟的研究方式也受到了研究者们的重视。De Bie等[112]采用一维模型,模拟了不同CO2/H2气体混合比例下CO2氢化生成CO、CH4、CH3OH 的反应机理,证明了中间产物对CO2氢化反应具有非常重要的影响。Aerts 等[113]建立了一个等离子体解离CO2的化学模型,发现相较于放电频率以及介质材料,放电间隙与分子停留时间对CO2转化率的影响更大。Zhou等[114]研究发现缩小填充材料的粒径、增大介电常数可使丝状放电转变为丝状放电和表面放电相结合,增加电场强度和电子能量,从而提高CO2转化效率与能源效率。此外,CO2氢化反应过程中生成的水会降低催化剂活性,影响CO2转化率与能源效率,可通过持续高压脉冲,促进催化剂的水分解吸与CO2的吸附,产生的等离子体可以进一步促进催化剂中水分的解吸与反应物的活化,提高反应物在催化剂上的解离吸附[115]。为进一步提高等离子催化CO2氢化的CO2转化效率与能源效率,可采用添加稀释气体、改进反应器以及研发新型催化剂等方法。Ray等[116]研究了三种稀释气体(N2、He、Ar)对CO2氢化的影响,发现Ar 对应的CO2转化效率最高,分析认为是Ar的存在降低了原料气的击穿电压,并促进了电极之间的电荷转移[117]。
贵金属由于其优越的催化活性常作为掺杂剂以提高催化剂活性。Li 等[118]研究表明掺杂的Pd 与ZnO 的强相互作用会形成PdZn 合金,促进ZnO 还原为ZnOx,提高CO2的活化量并降低反应温度,从而增强对CO2转化性能。然而,贵金属价格昂贵限制了其运用,所以另寻高效稳定催化剂是必然趋势。Ni作为非贵金属却具有与贵金属相似的性质,从而成为催化剂中的一颗新星。Zhou 等[119]研究发现Ni/TiO2催化CO2甲烷化反应是通过中间体CO 进行的,在350℃条件下得到73.2%的CO2转化率,Ni(111)是Ni/TiO2的主要暴露面。
GA 等离子体是一种瞬时电弧放电(图8),具备低温等离子体与热等离子体的优点,可在常温下产生周期性摆动的低温等离子体。气体流经高电压圆弧电极,在间距最短处电离,产生弧光等离子体,电弧随着气流推动逐渐拉长直至熄灭,同时新的电弧又在最短间距处产生,从而形成连续的弧光等离子体[120]。相较于DBD 等离子体,GA 等离子体的能效更高,但是GA 等离子体电流密度高和气体流速快,会导致电极老化、有效活化气体含量低的问题。为解决GA 等离子体催化过程中电极老化的问题,Heijkers 等[120]开发了一种圆柱形电极与切向进气口的新型GA 反应器,通过振动激发的氧原子与CO2之间的碰撞,使得转化CO2的能效在23%~33%之间。Zhang 等[121]开发了一种旋转滑动弧等离子体,发现当SEI>3.5 kJ/L 时,CO2的转化率与能效随SEI 的增大而逐渐增大;当SEI≤3.5 kJ/L 时,CO2的转化率与能效随着SEI 值的增大而逐渐减小。Li等[122]优化设计了一种GA 等离子体反应器,发现当流速较低时,CO2转化率随着温度的升高而升高;当流速较高时,CO2转化率随着温度的升高而降低,分析原因可能是由于气体温度与分子停留时间的变化。相较于DBD 等离子体,GA 等离子体虽然具备更高的能源利用效率[123],但是CO2的转化效率太低,这是因为分子停留时间太短以及气体处理不均所致,加入稀释气体(如Ar 或N2)可以提高CO2的转化率,但是会降低能效[124]。

图8 滑动弧放电等离子体催化CO2氢化反应机理Fig.8 Mechanism of GA plasma catalyzed CO2 hydrogenation
MW 等离子体不需要电极,避免了电极对CO2氢化的影响(图9),相较于其他类型的冷等离子体技术,MW 等离子体催化还原CO2具有最高的能源效率(50%~90%),但是该技术目前只适用于低压环境,在工业化应用方面受到限制。Chen 等[125-126]采用NiO/TiO2研究MW 等离子体催化CO2,发现通入Ar可提高TiO2表面的氧空位密度,提高CO2吸附率,并使得NiO 分布更加均匀,从而显著增加CO2的转化率与能源利用效率。Belov 等[127]研究了三种气体流动模式(直流、反向、涡流)对应的CO2转化情况,发现造成转化率与能效随压力的升高而逐渐降低的主要原因是因为压力升高使得等离子体热化,导致反应温度上升,VT弛豫现象增强,振动能级降低,以及CO 氧化重组加强。De La Fuente 等[128]研究不同气体流量、进气组分比以及比能量输入(SEI)对CO2转化率与能源利用效率的影响:提高SEI 值会使得CO2的转化率升高与能效降低,原因为H 原子的电离所需能量低于CO2;提高H 原子比例可增强等离子的电离过程,提高电子密度,且H 原子不能被电子以振动和/或旋转的方式激发,这使得电子获得更高的动能,进而增加电离反应速率。因此高H2/CO2比,对应高CO2转化效率。为进一步提高CO2的转化效果,他们[129]在MW 等离子体反应器的下游处加入一个外圆波导管提高粒子对能量的吸收率以及等离子体分布的均匀性。
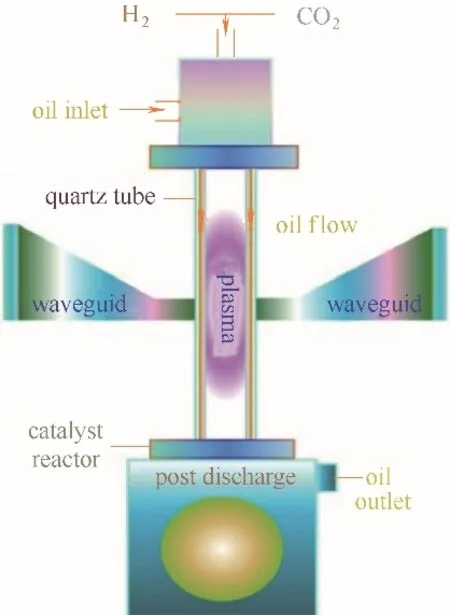
图9 微波等离子体催化CO2氢化反应机理Fig.9 Mechanism of MW plasma catalyzed CO2 hydrogenation
RF等离子体也被称为高频辉光放电等离子体,通过振动激发CO2,使得CO2发生附着解离与碰撞解离。Yang等[130]研究RF等离子体催化CO2氢化,发现引入H2可以抑制CO的复合反应,缩短CO2达到分解平衡的时间,但是会使得CO2的转化率先减小后增大,这是因为H2刚开始加入会减少CO2与高能电子之间的碰撞次数,导致转化率下降,但是随着H2含量的逐渐增大,H2产生的催化作用会逐渐增强,使得CO2转化率回升。Huang 等[131]在低压条件下,采用RF 等离子体耦合MW 等离子体解离CO2,发现加入Ar 可调节电子能量分布,提高CO2的转化率;反应区域内的大部分能量通过等离子体碰撞激发转移到分子的振动,弛豫引起的振动能量损失速率较为缓慢,受振动激发的分子通过进一步相互作用或与其他等离子体电子发生碰撞,由于它们的非谐性,导致连续振动向着更高振动能级的方向变化,并达到离解极限后解离CO2,获得最高CO2能量效率59.3%、转化率80.6%。
表5 是等离子体催化中不同催化剂活性对比。由表可知,近年DBD 的催化性能得到了提升,CO2转化率提升显著,但是较低的能源效率仍是其重大的挑战,开发同时获得高CO2转化效率以及能源效率的催化系统是该技术未来的主要发展方向。相较于DBD 催化技术,GA 等离子体催化技术具有更高的能源效率,但是CO2转化效率远低于DBD,可通过研发高性能催化剂与反应体系的优化以提高对CO2的转化能力,是该技术未来发展的主要方向。相较于DBD 与GA 催化技术,MW 同时具有较高的CO2转化率与能源效率,但是苛刻的反应条件是该技术的重大挑战,所以研发高性能催化剂以及反应体系的优化,是其未来发展的主要方向。相较于其他等离子体技术,RF 等离子体在CO2氢化反应方面的研究非常少,有待于进一步的研究。
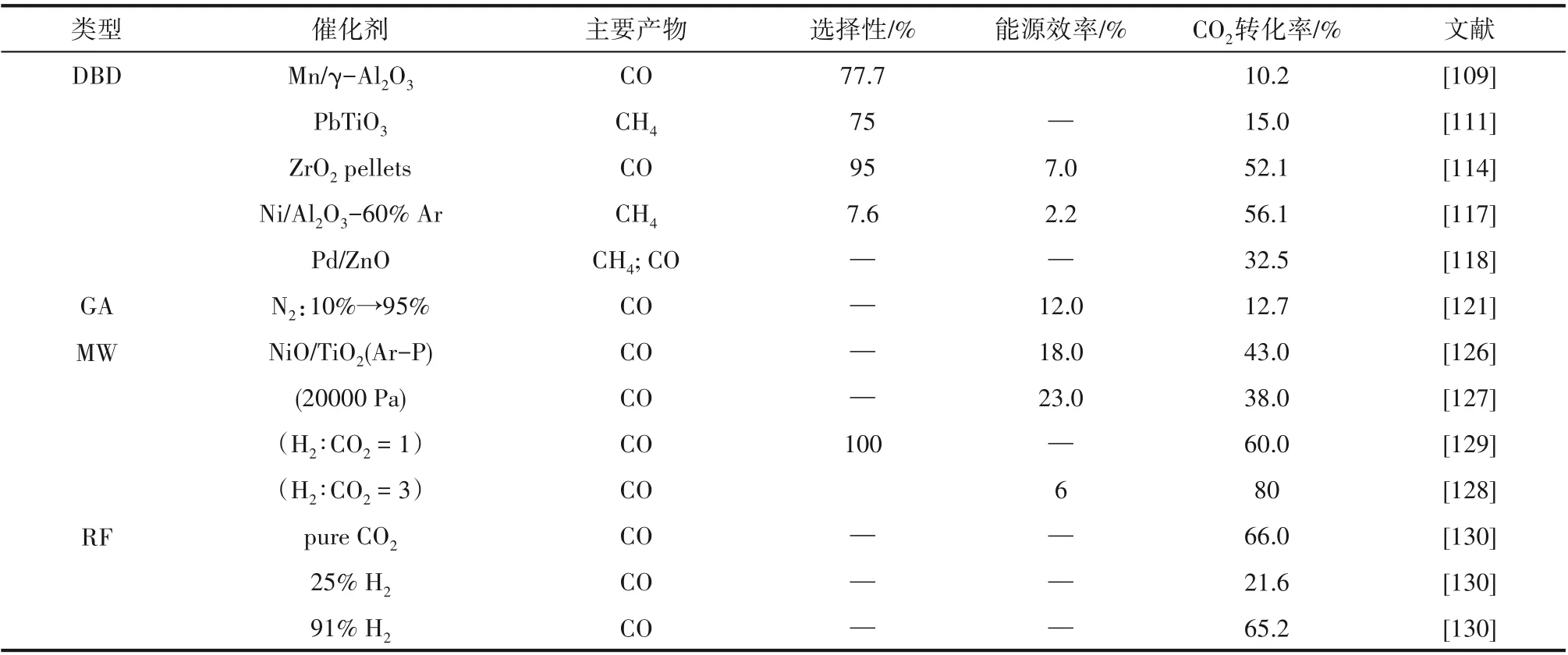
表5 等离子体催化中不同催化剂活性对比Table 5 Comparison of different catalyst activities in plasma catalysis
6 总结与展望
由于大气中CO2含量持续升高而引发了越来越严重的温室效应,使得CO2的治理技术成为全球关注的热点。本文主要介绍了4 种新型CO2氢化技术,并总结了各自的优缺点。光催化技术利用光能作为能源,成本最低,最环保,但是该技术的能源效率最低;电催化技术能效较高,反应系统模块化,易于规模化扩增,但是对产物的选择性较低;生物催化技术具有较高的时空产率与产物选择性,但是受到酶易变性失活以及较高成本的限制;冷等离子体催化技术具有较高CO2转化率,但是该技术目前还无法在常温常压下同时获得高CO2转化率与能源效率。冷等离子体技术具有非平衡热力学特性,活化能力强,反应速度快,对产物具有良好的选择性,可使用可再生能源的过剩产能作为能源以降低转化成本。虽然目前同时获得高CO2转化率与能量效率的等离子体催化技术还没有完全实现,但是一旦实现,这项技术将会成为CO2绿色转化技术的领跑者,具有良好的发展前景。此外,近年来新型耦合催化技术如光热、生电等技术表现出独特的催化特性,具有很好的发展潜力,值得人们进一步的研究。
本文探讨的几种CO2氢化技术目前均处于实验室研究阶段,虽然催化机理有所差异,但是这些技术转化CO2的能力均受到催化剂性能的限制,所以研发稳定、高效、经济、环保的催化剂是这些新型催化技术未来发展的主要方向;其次优化反应体系也是行之有效的措施之一;此外,深入研究转化技术的反应机理可为催化剂的研发指明方向,应受到研究者们的重视。
