响应面优化乳酸菌-柚子核共发酵体系中多肽的制备
2020-08-18吴戈仪吴继红
刘 帆,吴戈仪,吴继红,王 琴
(1.仲恺农业工程学院轻工食品学院,广东广州 510000;2.北京工商大学食品学院,北京市风味化学重点实验室,北京 100048)
柚子核作为金柚产业的大宗加工副产物,资源丰富,但在金柚的加工和食用过程中,往往被忽视而遗弃,造成资源的严重浪费。谢贞建等人[1]研究柚子核的化学组成为粗脂肪占柚子核的40.12%±0.13%,粗蛋白占32.89%±0.82%,含水量为12.08%±0.02%,总糖占11.22%±0.96%,灰分占5.35%±0.09%,且其中含有多种对人体健康有益的生理活性成分,如活性多糖、活性多肽、膳食纤维、黄酮等。因此,提高柚子核的高值化利用将会有效推动金柚产业向资源节约型、环境友好型的转型和发展。
关于金柚柚子核的研究刚刚起步,仅有关于其中的黄酮和柠檬苦素的优化提取,以及柚子核中挥发油的化学成分等研究。其中,黄师荣等人[2]利用乙醇作为提取剂,在进行提取工艺优化后,柚子核中黄酮类化合物的提取率为0.968%。邵金华等人[3]以乙醇作为提取剂,在进行提取工艺优化后,柚子核中的柠檬苦素的提取率为3.967 mg/g。叶茂等人[4]利用超声波辅助水酶法提取柚子核油,在进行提取工艺优化后,柚子籽油得率达到33.2%,且抗氧化性优于维C和白藜芦醇,这是由于柚子籽油中富含类黄酮、柠檬苦素等有效抗氧化成分。然而,有关柚子核中活性多肽的相关研究国内外尚未见报道。
多肽是具有与其功能性蛋白质相同序列的特异性小的无活性蛋白质片段。通常,肽包含2~20个氨基酸[5]。与蛋白质相比,生物活性肽的分子量较低、结构相对简单、抗原较弱、毒副作用较低且易被人体吸收,具有较强的生理活性,包括调节免疫、抗肿瘤、抗疲劳、抗氧化、抗衰老、抗病毒及抗菌等,是当今研究和开发的热点[6]。
由于乳酸菌的食物来源主要是纤维、乳糖、淀粉、寡糖,多肽几乎不被利用,而其代谢产物中富含蛋白酶,可对天然产物中的蛋白质进行水解,产生不同分子量的生物活性肽,利用这一特点选用微生物发酵法制备活性多肽,不仅成本较低并且在微生物发酵过程中其代谢等生理活动可减少天然产物中的某些致敏成分,提高营养成分含量[7]。
柚果加工,尤其是有关柚核、果皮等的综合利用已经引起国内外科技工作者的关注。因此,利用响应面优化乳酸菌-柚子核共发酵体系中活性多肽的提取,将为进一步研究乳酸菌-柚子核共发酵体系中多肽的生理活性奠定基础,有助于提高金柚加工过程中副产物的高值化利用,促进金柚产业的转型与升级,未来势必将加大对金柚加工副产物柚子核的综合利用。
1 材料与方法
1.1 材料来源
柚子核,来源于广东梅州的金柚柚子果实;乳酸菌(Lactobacillus amylolyticus 6),仲恺农业工程学院轻工食品学院微生物实验室提供。
1.2 主要试剂
谷胱甘肽标准品,Meilunbio公司提供;MRS肉汤培养基,青岛高科技工业园海博生物技术有限公司提供;氯化钠(AR)、三氯乙酸(AR)、碳酸钠(AR)、氢氧化钠(AR)、酒石酸钾钠(AR)、五水硫酸铜(AR),天津市大茂化学试剂厂提供;琼脂、福林酚试剂,广州市齐云生物技术有限公司提供。
1.3 主要仪器
MGC-350H型恒温培养箱,郑州生元仪器有限公司产品;YXQ-LS-50SII型高压灭菌锅,上海博迅实业有限公司产品;DHG-9023A型鼓风干燥箱,飞迪科技有限公司产品;SCIENTZ-50F型真空冷冻干燥机,新芝冻干有限公司产品;SC-3610型离心机,中佳有限公司产品;ME203E型分析天平,梅特勒-托利多仪器(上海)有限公司产品;TU-1900型双光束紫外可见分光度计,普析有限公司产品;HH-S2型数显恒温水浴锅,常州市金坛大地自动化仪器厂产品;RWD-1型超纯水机,Heal Force有限公司产品。
1.4 试验方法
1.4.1 柚子核样品制备
使用鼓风干燥机于60℃下将金柚柚子核烘干至恒质量,得干燥的柚子核。用组织捣碎机粉碎成粉末状,并通过30目筛,得试验用柚子核粉末,保存于常温干燥皿中,备用。
1.4.2 乳酸菌菌悬液制备
选定Lactobacillus amylolyticus 6作为微生物固态发酵菌种[8]。将MRS肉汤培养基以54 g/L的质量浓度配置,并用灭菌锅杀菌(121℃,15 min) 以备用。
将保存在-40℃的菌株复苏,再将50 μL已融化的冷冻菌滴入25 mL MRS肉汤培养基中,用封口条封好,避免污染,置于37℃培养箱中培养36 h。将培养后的乳酸菌用20 mL无菌生理盐水清洗并离心(1 200 r/min,15 min,常温) 2次,每次倒掉上清液,以去除培养基,加入20 mL无菌0.9%NaCl盐水,制备成悬浊液待用。
1.4.3 乳酸菌与柚子核的共生发酵
将已处理的柚子核粉末精密称取1 g于锥形瓶中,用一定料液比的超纯水将其浸湿,用封口条封好以免污染,于121℃下灭菌20 min后,在超净工作台上以一定百分比的接种量将乳杆菌接种于柚子核粉末表面,并置于一定温度的培养箱中培养一定时间,发酵完成后立即将样品放置在60℃烘箱中干燥48 h,以停止反应,并立即储存在4℃下备用。
1.4.4 乳酸菌发酵柚子核中多肽的提取
以1∶20的料液比加入超纯水,于温度37℃,转速40 r/min下用恒温摇床提取1 h;提取后倒入离心管以转速1 300 r/min离心20 min;取上清液定容至50 mL,并立即储存在4℃下以备后续测定使用。对于不需测定的多肽提取液,放置于-40℃条件下保存,后用真空冷冻干燥机进行冻干,得到多肽粗样,并立即储存在-40℃冰箱中。
1.4.5 多肽得率的测定
为避免蛋白质对多肽含量检测的影响,取1 mL上述提取液,加入10%(W/V) 的三氯乙酸(TCA) 水溶液1 mL混合均匀,静置10 min,以转速1 100 r/min离心30 min,取上清液。
多肽得率的测定使用福林酚法[9-10],具体包括以下步骤:
(1) 溶液配置。福林试剂A液:0.8 g NaOH和4 g无水Na2CO3溶于200 mL超纯水;福林试剂B液:2 g酒石酸钾钠溶于200 mL超纯水;福林试剂C液:1 g CuSO4·5H2O溶于200 mL超纯水;福林试剂D液:192 mL福林试剂A溶液与4 mL福林试剂B液和4 mL福林试剂C液的混合液,现配现用;福林试剂E液:Folin-Phenol试剂。
(2) 吸收光谱的测定。配置成质量浓度为1 mg/mL谷胱甘肽标准溶液,取0.5 mL加入4 mL试剂D液,于室温下静置10 min,然后加入试剂E液0.5 mL并混匀,于40℃下保温20 min,室温冷却,于波长300~900 nm处扫描,得到其吸收光谱曲线,确定测定波长。
(3)谷胱甘肽标准曲线制作。配置质量浓度为0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0,1.1,1.2 mg/mL谷胱甘肽溶液,各取1 mL,分别加入8 mL试剂D液,于室温下静置10 min,然后加入试剂E液1 mL并混匀,于40℃下保温20 min,室温冷却,于波长749 nm处测定各管溶液的吸光度,绘制标准曲线。
(4) 多肽得率的测定。取1 mL已加入TCA去除蛋白的样品,加入8 mL试剂D液,于室温下静置10 min,然后加入试剂E液1 mL并混匀,于40℃下保温20 min,室温冷却,于波长749 nm处测定各管溶液的吸光度,根据标准曲线求出试样溶液的多肽质量浓度。
式中:ρ——样品液中多肽质量浓度,mg/mL;
V——样品液体积,mL;
m——初始柚子核粉末的质量,mg。
1.4.6 乳酸菌发酵柚子核制备多肽工艺的单因素试验
(1)发酵温度对乳酸菌发酵柚子核制备多肽工艺影响。准确称取1 g柚子核粉,在发酵时间为50 h,料液比为1∶11,接种量为40%的情况下,分别于10,14,18,22,26℃下发酵。以多肽得率的极大值为指标,确定最佳发酵温度。
(2)发酵时间对乳酸菌发酵柚子核制备多肽工艺影响。准确称取1 g柚子核粉,在发酵温度为18℃,料液比为1∶11,接种量为40%的情况下,分别发酵20,35,50,65,80 h。以多肽得率的极大值为指标,确定最佳发酵时间。
(3)料液比对乳酸菌发酵柚子核制备多肽工艺影响。准确称取1 g柚子核粉,在发酵温度为18℃,发酵时间为50 h,接种量为40%的情况下,分别按照 1∶7,1∶9,1∶11,1∶13,1∶15(g∶mL) 的料液比添加超纯水。以多肽得率的极大值为指标,确定最佳发酵液料比。
(4)接种量对乳酸菌发酵柚子核制备多肽工艺影响。准确称取1 g柚子核粉,在发酵温度为18℃,发酵时间为50 h,料液比为1∶11的情况下,分别按照30%,35%,40%,45%,50%添加乳酸菌菌悬液。以多肽得率的极大值为指标,确定最佳接种量。1.4.7 响应面优化乳酸菌发酵工艺试验
在单因素试验结果的基础上,采用Design Expert 8.0(MSR) 软件设计试验条件,选用Box-behnken(BB) 模型,以发酵后柚子核多肽得率为响应面值Y,发酵温度(A)、发酵时间(B)、料液比(C)、接种量(D)为自变量,设计四因素三水平响应面试验并确定乳酸菌发酵柚子核制备多肽的最优工艺条件[11]。并根据响应面模型方差分析表,利用JMP14软件进一步分析各因素之间的交互作用关系。
2 结果与分析
2.1 谷胱甘肽吸收光谱扫描的测定结果
谷胱甘肽光谱扫描曲线见图1。
由图1可得,1 mg/mL谷胱甘肽标准溶液经TU-1900双光束紫外可见分光光度计在300~900 nm波长范围内进行光谱扫描,确定其最大吸收峰在749 nm处,并将此波长确定为以下各步骤中多肽含量的测定波长。
2.2 谷胱甘肽标准曲线的制作
749 nm测定波长的谷胱甘肽标准曲线见图2。
由图2可知,在测定波长为749 nm时,谷胱甘肽的标准曲线方程为Y=0.388 4X+0.033 4。相关系数R2=0.999,直观地说明了在749 nm下,吸光度与谷胱甘肽质量浓度有很好的线性关系,两者相关性强。标准曲线制作误差小,数据准确度高,为后续多肽得率的测定提供依据。
2.3 乳酸菌发酵柚子核制备多肽工艺的单因素试验结果与分析
2.3.1 发酵温度对乳酸菌发酵柚子核制备多肽工艺的影响
发酵温度对乳酸菌-柚子核共发酵体系中多肽得率的影响见图3。
由图3可知,在10~14℃的发酵温度范围内,多肽得率随发酵温度的增加而提高,在14℃时达到最高点,多肽得率为5.52%±0.12%,发酵温度大于14℃时,随温度增加而降低,最后趋于平缓。这是由于大多乳酸菌均为嗜冷杆菌属[12],在较低温度时生长代谢旺盛,产生的蛋白酶丰富,可对天然产物中的蛋白质进行水解,有助于多肽得率的提高,而在较高温度时乳酸菌生长缓慢,多肽得率较低。数据用3次重复的平均标准偏差(SD) 表示,用SPSS 17.0软件(IBM Amonk) 计算邓肯检验的显著性差异可得,发酵温度在14℃时与其他温度条件下的多肽得率有显著差异(p<0.05)。因此,初步确定14℃为最佳发酵温度。
2.3.2 发酵时间对乳酸菌发酵柚子核制备多肽工艺的影响
发酵时间对乳酸菌-柚子核共发酵体系中多肽得率的影响见图4。
由图4可知,在20~35 h的发酵时间内,多肽得率随发酵时间的增加而提高,发酵时间在35 h时达到最高点,多肽得率为4.40%±0.09%,发酵时间超过35 h后,随着发酵时间增加多肽得率降低。该乳酸菌的生长对数期为30~36 h,其在生长过程中主要利用纤维、乳糖、淀粉、寡糖[13-14],而在柚子核粉作为营养源的发酵过程中,在35 h达到一个菌株生长与物质消耗的平衡点,因此在35 h时对应的多肽得率最大。数据用3次重复的平均标准偏差(SD)表示,用SPSS 17.0软件(IBM Amonk) 计算邓肯检验的显著性差异可得,发酵时间在35 h时与其他发酵时间下的多肽得率有显著差异(p<0.05)。因此,初步确定35 h为最佳发酵时间。
2.3.3 料液比对乳酸菌发酵柚子核制备多肽工艺的影响
料液比对乳酸菌-柚子核共发酵体系中多肽得率的影响见图5。
由图5可知,料液比为1∶7~1∶11时,多肽得率随着添加的超纯水比例增加而逐渐增加,料液比超过1∶11时,多肽得率几乎稳定为4.79%±0.14%。原料在形成合适的质量浓度梯度时,将促进柚子核中水溶性物质溶出,包括提供乳酸菌生长代谢所需的碳源,在1∶11的料液比时刚好达到饱和,在1∶11的料液比后,增加超纯水的体积对多肽得率几乎没影响。数据使用3次重复的平均标准偏差(SD) 表示,用SPSS 17.0软件(IBMAmonk) 计算邓肯检验的显著性差异可得,料液比为1∶11与1∶7,1∶9条件下的多肽得率有显著差异,与1∶13,1∶15条件下的多肽得率无显著差异(p<0.05)。因此,初步确定1∶11为最佳料液比。
2.3.4 接种量对乳酸菌发酵柚子核制备多肽工艺的影响
接种量对乳酸菌-柚子核共发酵体系中多肽得率的影响见图6。
由图6可知,接种量为30%~45%时,多肽得率随着接种量的增加而逐渐增加,当接种量为45%时多肽得率达到最大值为4.68%±0.10%,当接种量大于45%后,多肽得率开始出现降低的趋势。这是由于提供乳酸菌生长所需的营养物质在接种量为45%时达到平衡,当接种量大于45%时会出现乳酸菌竞争营养物质而导致多肽得率趋于下降。数据用3次重复的平均标准偏差(SD)表示,用SPSS 17.0软件(IBM Amonk) 计算邓肯检验的显著性差异可得,接种量在40%时与30%,35%条件下的多肽得率有显著差异,与45%,50%条件下的多肽得率无显著差异(p<0.05)。因此,初步确定40%为最佳接种量。
2.4 响应面优化乳酸菌发酵工艺试验结果与分析
2.4.1 因素的选取及方案
综合上述单因素的试验结果,根据Box-benhnken的中心组合试验设计原理,选定发酵温度、发酵时间、料液比、接种量这4个因素作为响应面分析试验的因素,采用四因素三水平响应面分析法,利用Design Expert 8.0(MSR) 软件对数据进行拟合优化乳酸菌发酵柚子核制备多肽的工艺。
响应面分析试验因素与水平设计见表1。

表1 响应面分析试验因素与水平设计
以发酵后柚子核多肽得率为响应面值Y,发酵温度(A)、发酵时间(B)、料液比(C)、接种量(D)为自变量。其中1-24号为析因试验,25-29号为中心试验。
响应面试验设计与结果见表2。
2.4.2 二次方程数学模型的建立
针对响应面分析试验结果,应用Design Expert进行回归拟合分析,得到各发酵条件和多肽得率之间的二次多项式方程模型为Y=4.88-0.17A+0.15B+0.23C+0.036D。由方程中一次项系数可得出影响乳酸菌发酵柚子核制备多肽得率的因素由强到弱依次为C>A>B>D,即料液比>发酵温度>发酵时间>接种量。
2.4.3 方差分析结果
对模型的回归方程进行方差分析,以检验二次回归模型的显著性。
回归模型方差分析见表3。
回归模型的方差分析与显著性检验:利用Design Expert 8.0软件对回归模型进行方差分析,以确定每个因素对柚子核多肽提取率的影响程度,同时也检验回归方程的有效性。由表5可知,RSM获得的模型p值为0.020 1(p<0.05),显著;失拟项p值为0.453 8(p>0.05),不显著。因此,该模型成立,适合用于乳酸菌发酵柚子核制备多肽的得率响应值的预测。

表2 响应面试验设计与结果
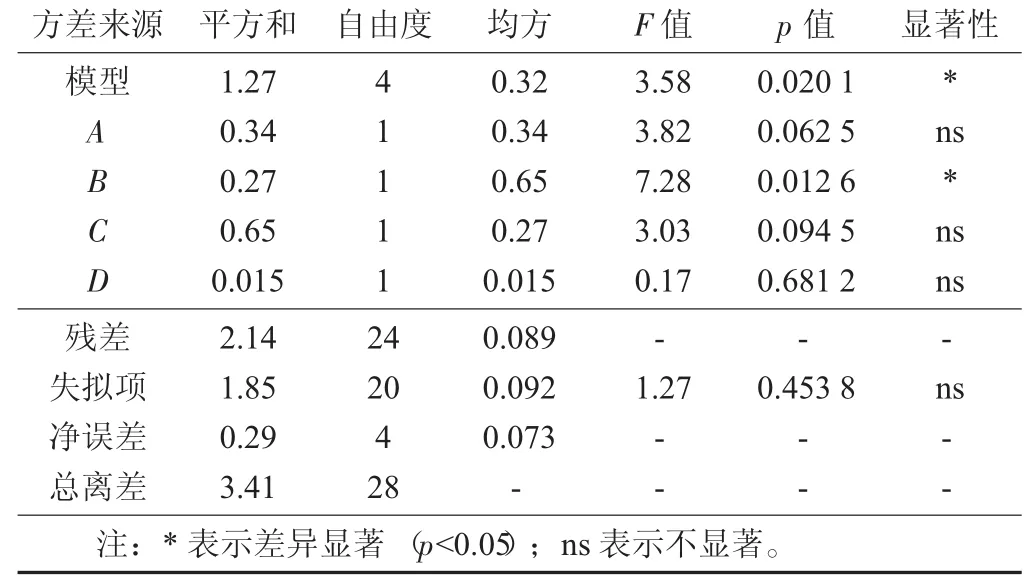
表3 回归模型方差分析
2.4.4 响应面因素交互作用分析
根据响应面模型方差分析表,利用JMP 14[15]分析得出发酵温度、发酵时间、料液比、接种量之间的交互作用关系图,作进一步分析。
发酵温度、发酵时间、料液比和接种量间的交互作用图见图7。
交互作用关系图中,曲线的弯曲程度越大,表明这种因素随着相应变量因素的变化而明显变化[16]。由图7可知,随发酵时间的变化,不同发酵温度、不同发酵料液比和不同接种量之间多肽得率变化较大,每条曲线的斜率变化较大,因此发酵时间与发酵温度、料液比、接种量之间交互作用均明显。
2.4.5 响应面优化结果及模型验证试验
根据试验所建立的模型,得到最佳发酵工艺为发酵温度10℃,发酵时间40 h,料液比1∶15,接种量50%,在此条件下柚子核多肽理论提取率为7.13%。在此条件下进行3次重复试验,柚子核活性肽实际平均提取率为7.04%±0.23%,与预测值的相对误差为1.26%。表明响应面法优化所得最佳工艺条件可靠,具有实用价值。
3 结论
以乳酸菌-柚子核共发酵体系为研究对象,通过 Design Expert 8.09(MSR) 软件的 Box-benhnken中心组合试验设计原理,利用响应面分析法优化乳酸菌-柚子核共发酵体系制备多肽的工艺。首先,通过单因素试验,分别研究乳酸菌发酵柚子核过程中发酵温度、发酵时间、料液比、接种量4个因素对柚子核多肽得率的影响。在此基础上,以发酵温度、发酵时间、料液比、接种量作为试验因子,采用四因素三水平的响应面分析法进行试验,分析数据后得出,制备乳酸菌-柚子核共发酵体系中活性多肽的最佳工艺为发酵温度10℃,发酵时间40 h,料液比1∶15,接种量50%,经过方差分析和分子刻画器显示模型拟合度较高。通过验证性试验证实此工艺条件下多肽得率为7.04%±0.23%,与模型的预测值7.13%十分接近。由此可见,该模型能有效指导乳酸菌-柚子核共发酵体系中活性多肽制备工艺条件的优化,并证明通过响应面分析法优化乳酸菌-柚子核共发酵体系中活性多肽的制备在实践上是可行的,这为进一步研究乳酸菌-柚子核共发酵体系中多肽的生理活性奠定基础。
柚果加工,尤其是有关柚核、果皮等的综合利用已经引起国内外科技工作者的关注。因此,利用响应面优化乳酸菌-柚子核共发酵体系中活性多肽的提取,将为进一步研究乳酸菌-柚子核共发酵体系中多肽的生理活性奠定基础,有助于提高金柚加工过程中副产物的高值化利用,促进金柚产业的转型与升级,未来势必将加大对金柚加工副产物柚子核的综合利用。
