柠檬酚对人肝癌HepG2细胞增殖、迁移和骨架相关蛋白表达的影响及其与蛋白作用方式研究
2020-08-16黄周锋胡筱希陆国寿黄建猷谭晓
黄周锋 胡筱希 陆国寿 黄建猷 谭晓
摘 要 目的:研究檸檬酚对人肝癌HepG2细胞增殖、迁移及骨架相关蛋白表达的影响,并探讨其与骨架相关蛋白的相互作用方式。方法:采用CCK-8法检测不同浓度柠檬酚(12.5、25、50、100、200 μmol/L)作用24 h后对HepG2细胞增殖的影响。将HepG2细胞分为阴性对照组和柠檬酚低、高浓度组(50、100 μmol/L柠檬酚),加入相应药物作用24 h后,采用划痕试验检测细胞的迁移能力并计算细胞迁移率,采用逆转录-聚合酶链式反应和Western blotting法检测细胞中聚合纤维状肌动蛋白(F-actin)、β-微管蛋白(β-tubulin)及埃兹蛋白(Ezrin)的mRNA和蛋白表达水平。利用分子对接软件Schrodinger 2015分析柠檬酚与上述3种蛋白的分子作用方式。结果:柠檬酚对HepG2细胞增殖具有显著抑制作用(P<0.05或P<0.01),且呈剂量依赖趋势。与阴性对照组比较,柠檬酚低、高浓度组细胞迁移率和F-actin、β-tubulin、Ezrin 的mRNA及蛋白表达水平显著降低(P<0.05或P<0.01)。分子对接结果显示,柠檬酚可与上述3种细胞骨架蛋白形成氢键和疏水键。结论:柠檬酚可抑制肝癌HepG2细胞的增殖和迁移;其作用机制可能与下调F-actin、β-tubulin、Ezrin 的mRNA及蛋白表达有关;其与骨架相关蛋白的作用方式可能是形成氢键或疏水键。
关键词 柠檬酚;人肝癌HepG2细胞;增殖;迁移;骨架相关蛋白;分子对接
ABSTRACT OBJECTIVE: To study the effects of citrusinol on proliferation, migration and the expression of skeleton-related proteins of human hepatocellular cells HepG2, and to investigate its interaction mode with skeleton-related proteins. METHODS: CCK-8 assay was used to detect the effects of different concentrations(12.5, 25, 50, 100, 200 μmol/L)of citrusinol on the proliferation of HepG2 cells for 24 h. HepG2 cells were divided into negative control group, citrusinol low-concentration and high-concentration groups (50, 100 μmol/L citrusinol). After treated for 24 h, the migration of HepG2 cells was detected by cell scratch test; cell migration rate was calculated. mRNA and protein expression of F-actin, β-tubulin and Ezrin in HepG2 cells were determined by RT-PCR and Western blotting assay. Molecular docking software Schrodinger 2015 was used to analyze the interaction mode between citrusinol and above 3 kinds of proteins. RESULTS: Citrusinol showed significant inhibition effect on the proliferation of HepG2 cells (P<0.05 or P<0.01), in dose-dependent trend. Compared with negative control group, cell migration, mRNA and protein expression levels of F-actin, β-tubulin, Ezrin were decreased significantly in citrusinol low-concentration and high-concentration groups (P<0.05 or P<0.01). Molecular docking results showed that the citrusinol could form hydrogen bond and hydrophobic bond with the above 3 skeleton-related proteins. CONCLUSIONS: Citrusinol can inhibit the proliferation and migration of HepG2 cells, the mechanism may be associated with the down-regulation of mRNA and protein expression of F-actin, β-tubulin and Ezrin. The mode of its interaction with skeleton-related proteins may be the formation of hydrogen bond or hydrophobic bond.
KEYWORDS Citrusinol; HepG2 cells; Proliferation; Migration; Skeleton-related proteins; Molecule docking
肝癌是常见的恶性肿瘤之一,发病率和病死率均很高。近年来研究发现,从中药中提取分离的天然有效成分在肿瘤疾病的治疗中起到了积极作用[1]。柠檬酚是从壮瑶药材小槐花中分离得到的活性成分[2],是一种A环并吡喃环黄酮类化合物(化学结构式见图1)。相关研究发现,具有A环并吡喃环黄酮结构的成分表现出良好的抗肿瘤活性,如桑辛素(Morusin)对人非小细胞肺癌A549细胞和人乳腺癌MCF7、MDA-MB-231细胞均具有强烈的抗肿瘤活性[3]。由此推测,柠檬酚也可能具有潜在的抗肿瘤活性。
本课题组前期研究发现,柠檬酚可以通过破坏人肝癌HepG2细胞聚合纤维状肌动蛋白(F-actin)骨架,阻止纺锤体形成,从而抑制人肝癌HepG2细胞的增殖[4]。相关研究发现,F-actin骨架的重组是细胞黏附能力和细胞形态改变得以实现的关键,当药物干预后可引起细胞骨架蛋白解聚,从而导致凋亡的发生[5-6]。Rao J等[7]的研究表明,细胞骨架聚合/解聚状态的改变,对恶性肿瘤细胞的形态和表型有非常重要的调节作用,故推测干预细胞骨架重组可作为抗癌药物的作用靶点。基于此,笔者在前期研究的基础上,采用CCK-8法检测柠檬酚对HepG2细胞增殖的影响,采用划痕试验检测柠檬酚对HepG2细胞迁移的影响,采用逆转录-聚合酶链式反应(RT-PCR)和Western blotting法检测HepG2细胞中F-actin、β-微管蛋白(β-tubulin)、埃兹蛋白(Ezrin)的mRNA及其蛋白表达水平,然后采用分子对接方法考察柠檬酚与上述3种蛋白的相互作用方式,以期为抗肿瘤活性分子的筛选及相关新药开发提供参考。
1 材料
1.1 仪器
BJ-J1606型细胞培养箱(上海博迅医疗生物仪器股份有限公司);CKX53型倒置相差显微镜(日本Olympus公司);ATY224型电子天平(日本Shimadzu公司);Z-11D型超声波细胞破碎仪(日本Toshiba公司);H1850R型台式高速冷冻离心机(湖南湘仪天平仪器设备有限公司);Multiskan Fc型酶标仪、ST70-2型微孔板恒温振荡器、7500型荧光定量PCR仪(美国Thermo Fisher Scientific公司);Tanon 5500 Multi型全自动化学发光/荧光图像分析系统(上海天能科技有限公司);1645050型基础电泳仪(美国Bio-Rad公司)。
1.2 药品与试剂
柠檬酚(本实验室自制,纯度:≥98%);高糖DMEM培养基(美国Hyclone公司,批号:AD12854263);胎牛血清(杭州四季青生物工程材料有限公司,批号:18090505);0.25%胰酶(美国Gibco公司,批号:1967534);CCK-8试剂盒(日本Dojindo公司,批号:CK04);兔抗Ezrin、F-actin、β-tubulin、β-actin单克隆抗体(北京博奥森生物技术有限公司,批号:AG12013984、AH11168240、AG07178634、AG0719703);反转录试剂盒[纽英伦(北京)生物技术公司,批号:M0303S];荧光定量PCR试剂盒(美国Thermo Fisher Scientific公司,批号:26616); RIPA裂解液(上海碧云天生物技术有限公司,批号:P0013B);BCA蛋白定量试剂盒(杭州联科生物技术股份有限公司,批号:R7204);辣根过氧化物酶标记山羊抗兔免疫球蛋白G二抗(北京博奥森生物技术有限公司,批号:bs-40296G);3-磷酸甘油醛脱氢酶(GAPDH,南京捷尼斯生物科技有限公司);磷酸盐缓冲液(PBS,pH为7.2~7.4)、青霉素、链霉素均购自美国Hyclone公司;无水乙醇、异丙酮、氯仿等均为分析纯;其他试剂为实验室常用试剂,水为超纯水。
1.3 细胞
人肝癌细胞HepG2购自美国ATCC细胞库。
2 方法
2.1 细胞培养
取HepG2细胞,置于含10%胎牛血清的DMEM培养基(以下简称“培养基”)中,于37 ℃、5%CO2条件下培养(以下培养条件相同)。
2.2 细胞增殖试验
采用CCK-8法进行细胞增殖检测。将对数生长期的HepG2细胞接种至96孔培养板中,每孔约1×104个细胞,于细胞培养箱中培养24 h后,弃上清液,然后将细胞分为阴性对照组和柠檬酚不同浓度组(终浓度为12.5、25、50、100、200 μmol/L),每组设置6个复孔。柠檬酚不同浓度组加入相应浓度的含药培养基,阴性对照组加入等体积培养基。将细胞继续培养24 h后,每孔加入CCK- 8工作液100 μL,置于细胞培养箱中培养1 h后,采用酶标仪于450 nm波长处检测各孔的吸光度(A),并计算细胞增殖抑制率[细胞增殖抑制率=(A阴性对照组-A柠檬酚不同浓度组)/A阴性对照组×100%],再通过SPSS 20.0软件计算柠檬酚的半数抑制浓度(IC50)。
2.3 细胞划痕试验
将对数生长期的HepG2细胞,接种于6孔板中,每孔约1×106个细胞。将细胞培养至融合率达95%后,分为阴性对照组和柠檬酚低、高浓度组(终浓度为50、100 μmol/L),每组设置2个复孔。用无菌处理后的1 mL枪头尖端垂直在细胞表面划出一条直线,再用PBS冲洗,除去漂浮的细胞,加入新鲜培养基,于显微镜下拍照,记录划痕位置。將各孔的上清液吸除后,柠檬酚低、高浓度组加入相应浓度的含药培养基,阴性对照组加入等体积培养基。将细胞置于细胞培养箱中培养24 h后,置于显微镜下拍照,利用 Image J 2.1.4.7软件分析图片,并计算细胞迁移率[细胞迁移率=(细胞迁移前的划痕距离-细胞迁移后的划痕距离)/细胞迁移前的划痕距离×100%]。
2.4 柠檬酚对细胞骨架相关蛋白mRNA表达水平的影响
采用RT-PCR法检测HepG2细胞骨架相关蛋白的mRNA表达水平。取对数生长期的HepG2细胞,按1×106个/孔接种于6孔板中,分为阴性对照组和柠檬酚低、高浓度组(终浓度为50、100 μmol/L),每组设置2个复孔。将细胞培养至细胞融合率达80%后,弃上清液,柠檬酚低、高浓度组加入相应浓度的含药培养基,阴性对照组加入等体积培养基。将细胞置于细胞培养箱中培养24 h后,收集细胞,并提取总RNA。按逆转录试剂盒说明书操作,先将RNA逆转录为cDNA,再按荧光定量PCR试剂盒说明书操作进行PCR扩增。扩增程序: 95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火30 s,60 ℃延伸30 s,40个循环。采用荧光分析软件对产物进行分析,并以GAPDH为内参,采用2-ΔΔCt法计算F-actin、β-tubulin、Ezrin mRNA的相对表达水平。引物信息见表1。
2.5 柠檬酚对细胞骨架相关蛋白表达水平的影响
采用Western blotting法检测HepG2细胞骨架相关蛋白的表达水平。取对数生长期的HepG2细胞,以2×106个/孔接种于6孔板中,分为阴性对照组和柠檬酚低、高浓度组(终浓度为50、100 μmol/L),每组2个复孔。将细胞培养至细胞融合率达80%后,弃上清液,柠檬酚低、高浓度组加入相应浓度的含药培养基,阴性对照组加入等体积培养基。将细胞置于细胞培养箱中培养24 h后,收集细胞,加入RIPA裂解液(含蛋白酶抑制剂),提取总蛋白;以BCA法检测蛋白浓度后,进行蛋白变性处理。取变性后蛋白进行十二烷基硫酸钠-聚丙烯酰胺电泳(SDS-PAGE),再转移至PVDF膜上,室温封闭1 h后,以TBST缓冲液清洗5 min×3次;分别加入β-actin、F-actin、β-tubulin、Ezrin抗体(稀释比例均为1 ∶ 1 000),4 ℃下孵育过夜;以TBST缓冲液清洗5 min×3次,再加入二抗(稀释比例为1 ∶ 5 000),室温孵育1 h;以TBST缓冲液清洗5 min×3次,加入显色液,以β-actin为内参,采用化学发光图像分析系统分析蛋白的相对灰度值来表示目的蛋白的相对表达水平。
2.6 分子对接试验
从PDB数据库(http://www.rcsb.org/)下载F-actin、β-tubulin、Ezrin的蛋白结构,其PDB ID分别为2ZWH、4U3J、4RM8,采用分子对接软件Schrodinger 2015中的Schrodinger Maestro模块中的Prep Wiz功能对蛋白结构进行预处理:加氢、去除水分子、补残基,使用OPLS3力场对各蛋白进行限制能量优化,使重原子的坐标均方根偏差收敛于0.3 ?[8]。使用Grid Generation模块定义格点文件,以晶体结构的原有配体所在位点为中心,根据不同受体定义活性口袋的位置。将“sdf ”格式的柠檬酚结构文件导入Canvas 2.4模块,导出生成格式为“mae”的文件,再将其导入Maestro 10.2模块,选择ligpre模块自动生成柠檬酚3D结构。将蛋白受体与柠檬酚3D结构在One-Step Glide Docking模块中进行对接,并选择对接模式为SP,生成2D平面图。
2.7 统计学方法
采用SPSS 22.0进行数据分析。计量资料以x±s表示,多组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 柠檬酚对HepG2细胞增殖的影响结果
与阴性对照组比较,柠檬酚不同浓度组HepG2细胞培养24 h后,其细胞增殖抑制率均显著增加(P<0.05或P<0.01);且随柠檬酚浓度的增加,其增殖抑制作用越强。柠檬酚对HepG2细胞的IC50为77.59 μmol/L。柠檬酚对HepG2细胞增殖的影响见表2。
3.2 柠檬酚对HepG2细胞迁移能力的影响
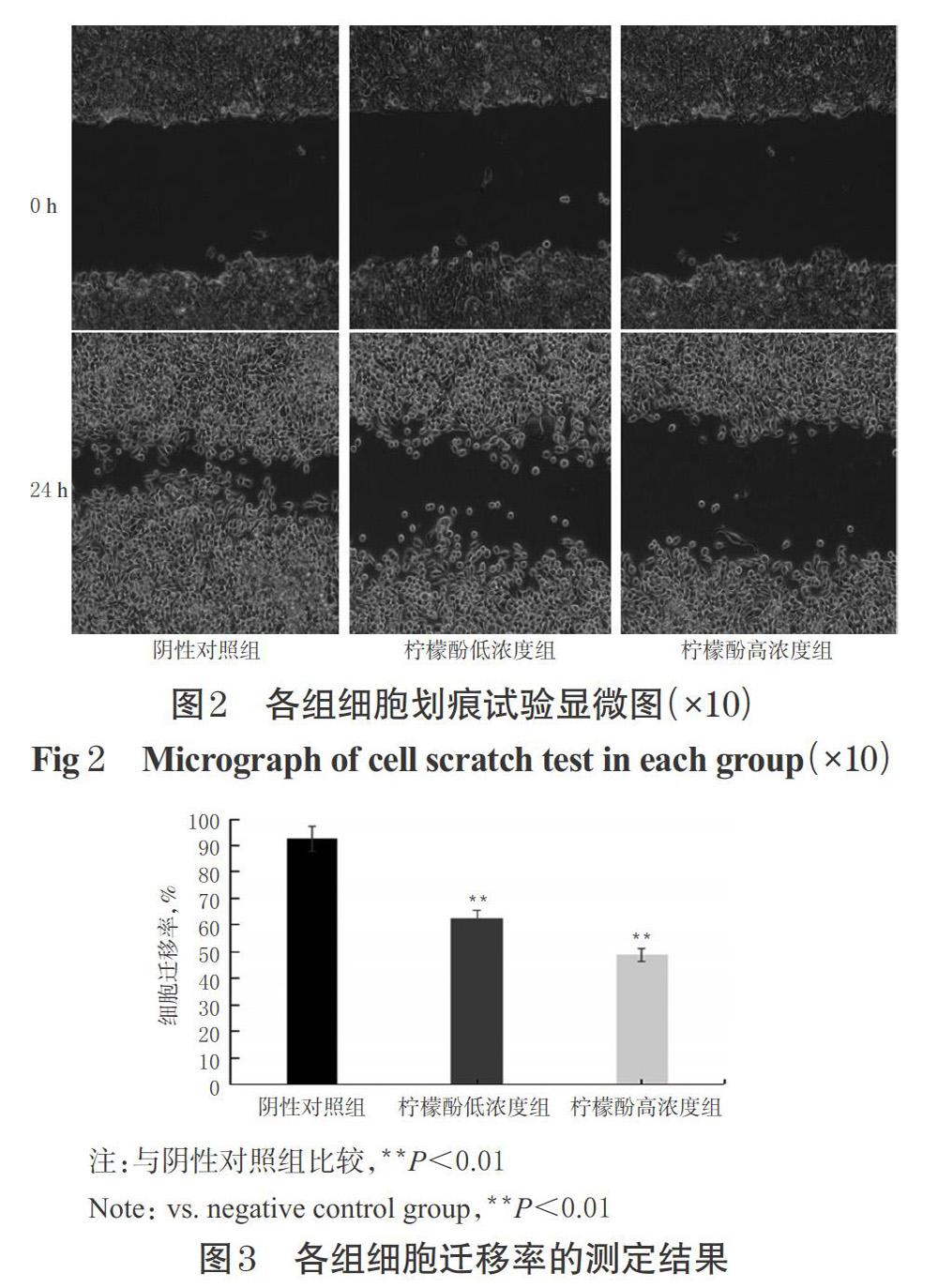
与阴性对照组[细胞迁移率为(92.35±5.36)%]比较,柠檬酚低、高浓度组细胞迁移率显著降低(P<0.01),细胞迁移率分别为(62.48±2.27)%、(48.63±3.25)%,表明柠檬酚能显著抑制HepG2细胞的迁移能力。各组细胞划痕试验显微图见图2,细胞迁移率的测定结果见图3。
3.3 柠檬酚对HepG2细胞骨架相关蛋白mRNA表达水平的影响
与阴性对照组比较,柠檬酚低、高浓度组细胞中F-actin、β-tubulin和Ezrin的mRNA表达水平均显著降低(P<0.05或P<0.01)。各组细胞中F-action、β-tubulin和Ezrin的mRNA表达水平见图4。
3.4 柠檬酚对HepG2细胞骨架相关蛋白表达水平的影响
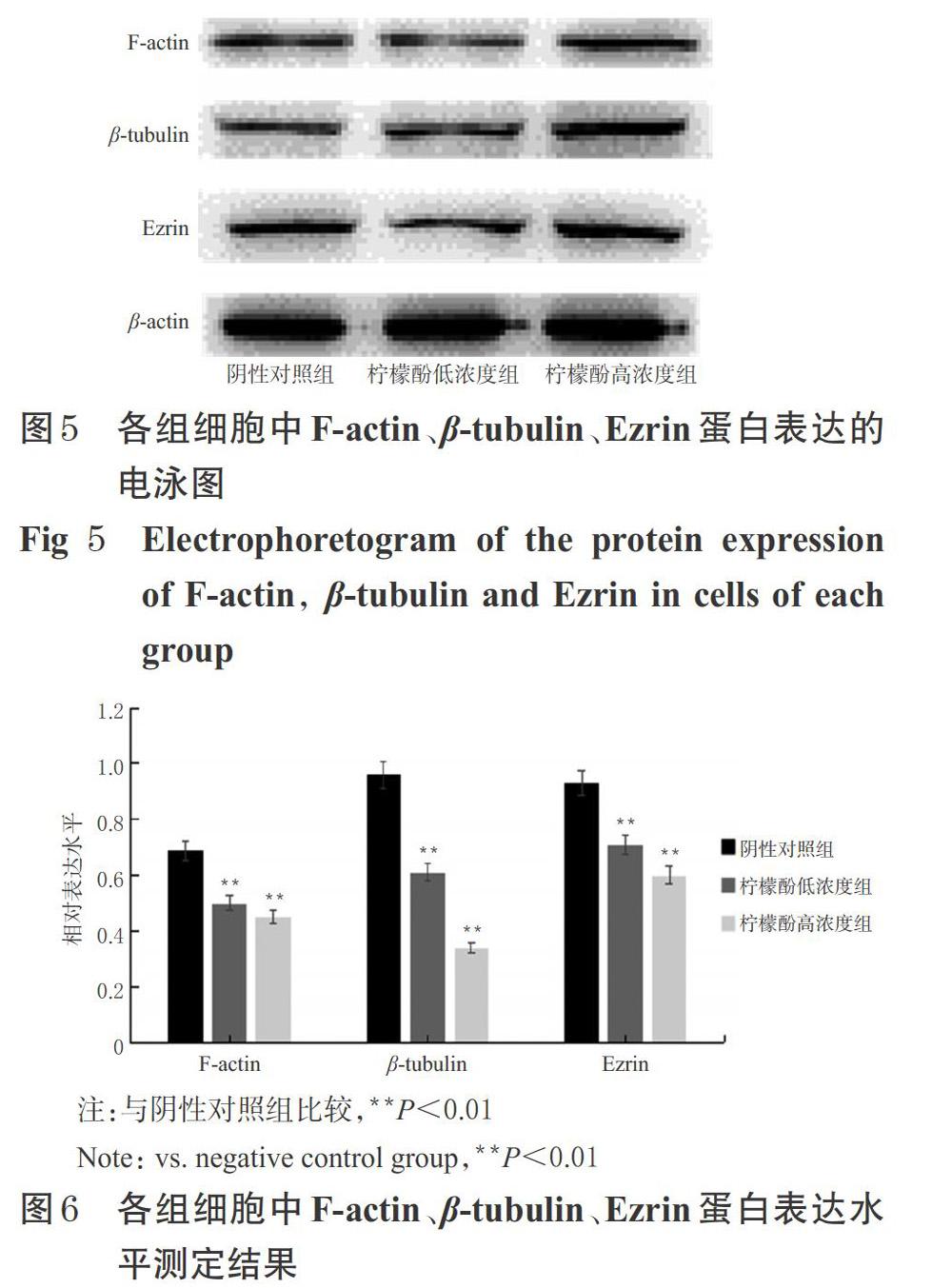
与阴性对照组比较,柠檬酚低、高浓度组细胞中F-actin、β-tubulin和Ezrin蛋白表达水平均显著降低(P<0.01)。各组细胞中F-actin、β-tubulin、Ezrin蛋白表达的电泳图见图5,蛋白表达水平测定结果见图6。
3.5 分子对接试验结果
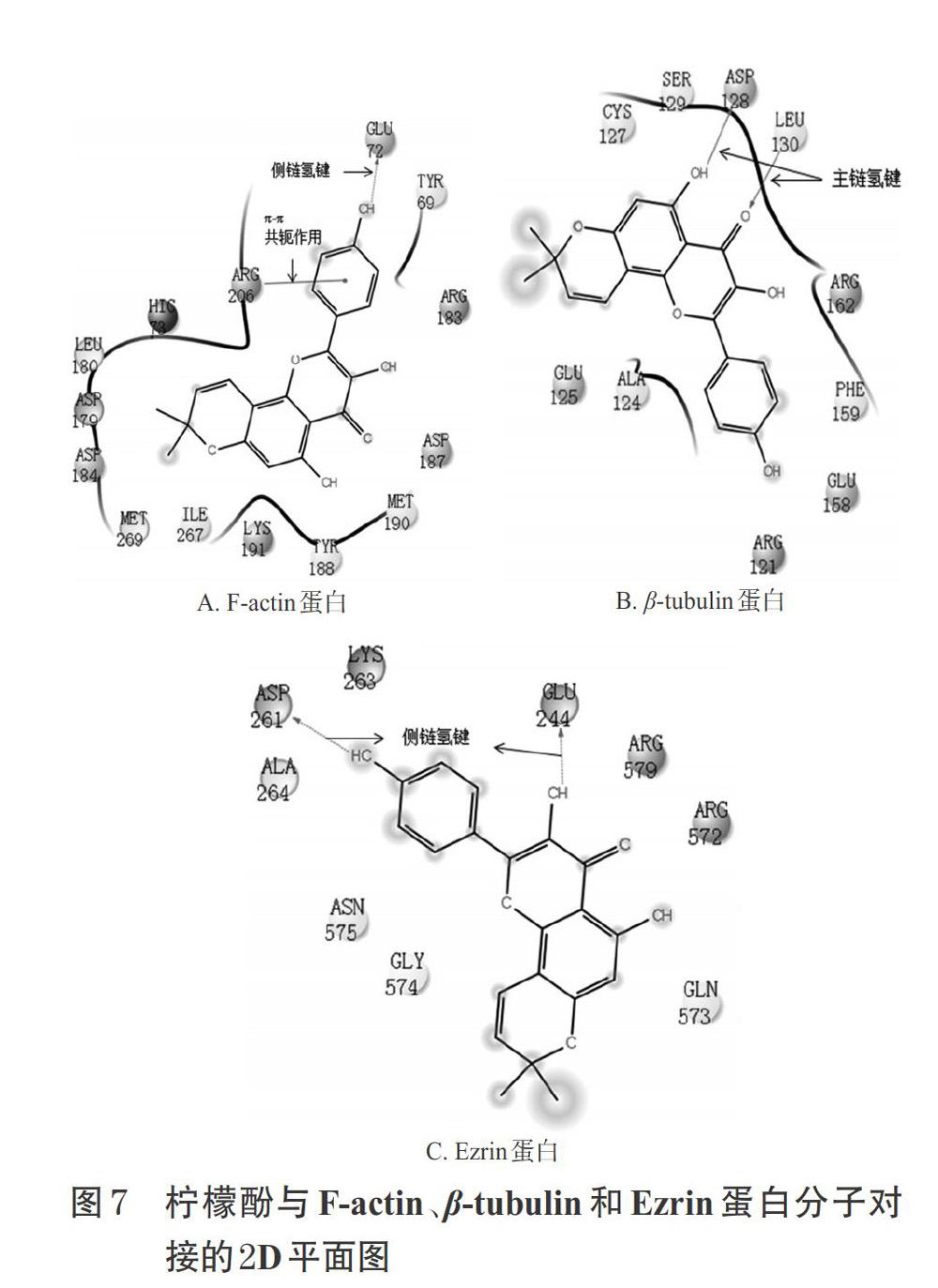
柠檬酚与F-actin、β-tubulin、Ezrin分子对接的2D平面图见图7。由图7A可知,柠檬酚C-4′位羟基与氨基酸GLU72的侧链形成氢键;A环并吡喃环与氨基酸ARG206形成π-π共价键,与氨基酸MET190、TYR188、TYR69、MET269、ASP179、LEU180等形成疏水鍵。由图7B可知,柠檬酚C-5位羟基与氨基酸ASP128的侧链形成氢键;C-4位的羰基氧与氨基酸LEU130的侧链形成氢键,与CYS127、LEU130、ALA124、PHE159等形成疏水键。由图7C可知,柠檬酚C-4′位羟基与氨基酸ASP261的侧链形成氢键,与ALA264等形成疏水键;C-3位羟基与氨基酸Glu244的侧链形成氢键。
4 讨论
柠檬酚于1987年在柑橘属植物酸橘(Citrus nobilis Lour Var. sunki Hort)中首次被发现[9]。尚明英等[10]在小檗科植物鬼臼(Podophyllum ecodi Wall.)的干燥成熟果实小叶莲中也有发现该化合物。Shen CC等[11]在豆科植物排钱树[Phyllodium pulchellum (L.) Desv.]中也发现有柠檬酚,并报道了其对KB、HepG2细胞均具有抑制活性。另有研究在毛排钱草(Desmodium blandum Van Meeuwen)中也发现了柠檬酚,并对其进行抗肿瘤细胞试验,结果发现,其对KB、HepG2细胞的IC50值分别为14.9、15.2 μg/mL[12-13]。由此可知,柠檬酚具有明显的抗肿瘤细胞的活性。本试验结果也显示,柠檬酚可以有效地抑制HepG2细胞的增殖和迁移。
F-actin是细胞骨架中微丝的主要存在形式之一,肌动蛋白微丝的破坏有可能导致间隙连接数目减少,细胞通讯功能下降,进而影响细胞的生长、增殖及其他代谢活动,促使细胞恶性转化[14-15]。β-tubulin是β微管蛋白中最重要的亚型之一,参与肿瘤细胞的定向迁移、增殖分化等过程,在细胞核周围的微管发生解聚可以激活Rac/Rho,促进细胞体中微丝的收缩;Ezrin介导“配体(细胞质基质)-黏附分子-Ezrin-细胞骨架”信号通路参与细胞的跨膜联系和信号转导,调节基因表达以及细胞骨架的收缩和组装,参与肿瘤的侵袭和转移[16-18]。本研究结果发现,柠檬酚可上调HepG2细胞中Ezrin、F-actin及β-tubulin的表达,从而抑制细胞的增殖和迁移。
药物与蛋白结合是控制药物向受体释放、避免药物迅速代谢的主要途径,通过分子对接可以直观地观察到药物小分子与蛋白的结合方式,有助于从原子水平上了解药物与生物大分子的作用方式[19-21]。本研究结果表明,柠檬酚与F-actin、β-tubulin、Ezrin的相互作用模式是形成氢键或疏水键。
综上所述,柠檬酚可抑制肝癌HepG2细胞的增殖和迁移;其作用机制可能与下调F-actin、β-tubulin、Ezrin 的mRNA及蛋白表达有关;其与骨架相关蛋白的作用方式可能是形成氢键或疏水键。
参考文献
[ 1 ] 杨楠,贾晓斌,张振海,等.黄酮类化合物抗肿瘤活性及机制研究进展[J].中国中药杂志,2015,40(3):373-381.
[ 2 ] 卢文杰,陆国寿,谭晓,等.壮瑶药小槐花化学成分研究[J].中药材,2013,10(12):1953-1956.
[ 3 ] TSENG TH, CHUANG SK, HU CC, et al. The synthesis of morusin as a potent antitumor agent[J]. Tetrahedron, 2010,66(6):1335-1340.
[ 4 ] 刘瑛,陆国寿,卢文杰,等.柠檬酚对人肝癌HepG2细胞增殖的影响[J].天然产物开发与研究,2017,29(1):135- 140.
[ 5 ] 宋鸣子,戈应滨,范玲玲,等.染料木黄酮对人乳腺癌细胞肌动蛋白细胞骨架的黏附能力的影响[J].南京医科大学学报(自然科学版),2007,27(5):424-427.
[ 6 ] 刘军楼,沈洪,徐力,等.冬凌草甲素对胰腺癌细胞骨架蛋白F-actin的影响[J].中国癌症杂志,2015,25(1):31-37.
[ 7 ] RAO J,LI N. Microfilament actin remodeling as a potential target for cancer drug development[J]. Curr Cancer Drug Targets,2004. DOI:10.2174/1568009043332998.
[ 8 ] 朱陵霞,孙晓艳,陈娇,等.雷公藤红素通过抑制PAK1抗胰腺癌作用及机制研究[J].药学学报,2020,55(1):60-66.
[ 9 ] WU TS. A 2,2-dimethylpyranoflavonol from Citrus nobilis[J]. Phytochemistry,1987,26(11):3094-3095.
[10] 尚明英,李軍,蔡少青,等.藏药小叶莲的化学成分研究[J].中草药,2000,31(8):569-571.
[11] SHEN CC, WANG ST, TSAI SY, et al. Cinnamylphenols from Phyllodium pulchellum[J]. J Nat Prod,2005,68(5):791-793.
[12] 干宁,杨欣,李天华,等.毛排钱草的化学成分及其对肿瘤细胞的细胞毒活性研究[J].中国中药杂志,2008,33(18):2077-2080.
[13] 干宁,李天华,杨欣,等.毛排钱草的化学成分分析及其抗肿瘤活性研究[J].中草药,2009,40(6):852-856.
[14] WATANABE N. Inside view of cell locomotion through single-molecule :fast-F-/G-actin cycle and G-actin regulation of polymer restoration[J]. Proc Jpn Acad Ser B Phys Biol Sci,2010,86(1):62-83.
[15] ONO Y, FUJII T, OGITA K, et al. Protein kinase C zeta subspecies from rat brain: its structure, expression, and properties[J]. Proc Natl Acad Sci USA,1989,86(9):3099-3103.
[16] 高辉,李庆昌.膜细胞骨架连接蛋白Ezrin与肿瘤侵袭转移相关性的研究现状[J].中华肿瘤防治杂志,2009,16(21):1702-1703.
[17] 屈洪波,李汉贤. Ezrin蛋白与肿瘤侵袭转移的研究进展[J].实用癌症杂志,2009,24(1):93-94.
[18] MCCARNEY BM,KULIKAUSKAS PM,LAJEUNESSE DR, et al. The neurofibromatos-2-homologue, merlin, and the tumor suppressor expanded function together in drosophila to regulate cell proliferation and differentiation[J]. Development,2000,127(6):1315-1324.
[19] 王文军,丁一,窦芳,等.分子对接在中药药效物质筛选及作用机制研究中的应用进展[J].中国药师,2018,21(6):1020-1023.
[20] 沈燕君,张新然,吴洋,等.基于虚拟筛选、分子对接和生物测活的TRPV3选择性小分子拮抗剂的发现[J].药学学报,2018,53(6):966-975.
[21] 魏雨晨,易忠胜,徐婕,等.基于光谱法和计算模拟研究PFBSK与HSA的相互作用[J]. 桂林理工大学学报,2019,39(2):474-481.
(收稿日期:2020-03-19 修回日期:2020-05-25)
(编辑:唐晓莲)
