NLRP3炎性小体激活调控机制及抑制剂研究新进展
2020-08-10周永婷叶菜英
周永婷,叶菜英,朱 蕾
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系, 北京 100005)
近年来,炎性小体(inflammasome)的研究受到越来越多的关注。尤其是含NLR家族PYRIN域蛋白3(NLR family, pyrin domain containing protein 3, NLRP3)炎性小体,一直是免疫炎性反应领域的重点研究对象,在机体免疫反应和多种疾病的发生发展中具有重要作用。NLRP3基因突变可导致冷炎素相关周期性综合征(cryopyrin-associated autoinflammatory syndrome,CAFS),而2型糖尿病、痛风、动脉粥样硬化、神经退行性疾病和肿瘤等与NLRP3炎性小体的过度激活密切相关。因此,深入探究NLRP3炎性小体激活机制对于发展其特异性抑制剂以及相关疾病的治疗提供思路。有关NLRP3炎
性小体的组成和激活途径等已有相关综述,本文重点探讨近年来NLRP3炎性小体活化调控机制及其抑制剂研究的新进展。
1 NLRP3炎性小体激活模型
NLRP3炎性小体由核苷酸结合寡聚化结构域(nucleotide binding oligomerization domain,NOD)样受体家族成员NLRP3、衔接蛋白ASC和半胱天冬蛋白酶caspase-1前体组成。经典的NLRP3炎性小体激活需要双重信号,分为两个阶段,即预激和活化阶段。预激阶段:信号1,如脂多糖(LPS)或细胞因子等病原相关分子模式(pathogen-associated molecular patterns,PAMPs)可活化NF-κB通路,上调NLRP3和IL-1β表达;活化阶段:信号2,包括多种PAMPs和损伤相关分子模式(danger-associated molecular patterns,DAMPs),它们活化的具体机制尚不明确,以往研究认为可能与K+外流、活性氧类(reactive oxygen species,ROS)升高、溶酶体破裂、Ca2+信号和Cl-外流等相关,从而促进NLRP3炎性小体复合物的组装,使pro-caspase-1被剪切为有活性的caspase-1,后者将pro-IL-1β、pro-IL-18切割为成熟形式并引起细胞焦亡[1]。NIMA相关蛋白激酶7(NIMA-related kinase 7,NEK7)可以直接结合NLRP3 促进炎性小体组装和活化,有文献认为NEK7可能是NLRP3炎性小体的组分蛋白[1]。
2 NLRP3炎性小体激活调控机制
2.1 反面高尔基网(trans-Golgi network,TGN)解体
由于信号2的多样性和高度差异性,且没有证据表明能够与NLRP3直接结合,推测信号2可能通过激发一个共同细胞信号从而活化NLRP3炎性小体,但一直未得到解答。通过建立一个创新性的能够有效检测NLRP3活性的体外分析系统,发现不同信号2可导致TGN解体成分散的TGN(dispersed TGN,dTGN),后者作为一个平台,其膜上带负电荷的磷脂酰肌醇-4-磷酸通过与NLRP3上保守的带正电荷的多碱区结合从而招募NLRP3聚集于dTGN上形成斑点,使NLRP3分子活化,然后进一步招募ASC并引起炎性小体激活[2]。虽然信号2如何诱导dTGN形成仍不清楚,但这一发现揭示NLRP3在dTGN上募集是多样化信号2活化NLRP3炎性小体的早期共同信号,为相关疾病治疗提供了新靶点。
2.2 线粒体与NLRP3
线粒体在NLRP3炎性小体活化中起重要作用。已有报道,多种PAMPs和DAMPs可引起线粒体功能障碍,释放ROS和线粒体DNA(mtDNA)以及产生氧化mtDNA(ox-mtDNA),从而激活NLRP3炎性小体。而线粒体自噬可以负调控NLRP3炎性小体。另外,NLRP3炎性小体组分蛋白的线粒体定位对于其活化具有重要作用,线粒体相关适配蛋白、c-FLP和线粒体心磷脂可调节定位过程[3]。信号1-LPS可以通过TLR-MyD88/TRIF- IRF1通路上调尿苷酸-胞苷酸激酶2(UMP-CMPK2)的表达。UMP-CMPK2是mtDNA合成中dNTP供应的限速酶,LPS诱导的UMP-CMPK2依赖性mtDNA合成是多种信号2产生ox-mtDNA并进而激活NLRP3炎性小体所必需的。该项研究首次将预激阶段和活化阶段联系起来,同时也提示抑制UMP-CMPK2可能为NLRP3相关疾病治疗提供新策略[4]。
2.3 NLRP3的翻译后修饰(图1)
2.3.1 NLRP3泛素化:信号1不仅可以增加NLRP3转录,还可以调节其泛素化修饰从而影响其活化。LPS通过TLR4/MyD88 通路使NLRP3去泛素化从而激活NLRP3炎性小体,该过程依赖线粒体ROS的产生。含BRCA1/BRCA2复合体亚基3(BRCA1/BRCA2-containing complex subunit 3,BRCC3)可介导NLRP3的LRR域去泛素化,促进NLRP3寡聚化和活化。而维生素D受体(VDR)激活后可直接结合NLRP3,阻滞BRCC3去泛素化NLRP3,从而抑制NLRP3炎性小体活化[5]。而一些E3泛素连接酶可以使NLRP3泛素化从而负调控NLRP3炎性小体的活化。FBXL2是SCF E3连接酶复合物的亚基,可介导NLRP3 Lys689位点的泛素化和蛋白酶体降解[6]。而LPS可诱导SCF的另一亚基——FBXO3,FBXO3降解FBXL2从而避免NLRP3被泛素化而降解[6]。另两个E3泛素连接酶,ARIH2和TRIM31亦可促进NLRP3的泛素化降解从而抑制NLRP3炎性小体的活化;而信号1可使TRIM31的表达上调从而对NLRP3炎性小体活化起负反馈调节作用。多巴胺可以作为NLRP3炎性小体的内源性抑制剂,它与D1受体结合后增加胞内cAMP水平,cAMP与NLRP3结合促进E3泛素连接酶MARCH7介导的NLRP3泛素化和降解[7]。与上述大量报道的NLRP3的泛素化作为负调控信号所不同的是,最近研究显示Pellino 2可以使NLRP3泛素化从而促进NLRP3的组装和活化。
2.3.2 NLRP3磷酸化:一些激酶和磷酸酶可以调节NLRP3上相应位点的磷酸化修饰状态从而影响其活化。JUN氨基末端激酶1(JNK1)和蛋白激酶D(PKD)分别磷酸化NLRP3的Ser198和Ser295位点,从而促进NLRP3炎性小体激活,同时Ser198的磷酸化还可以通过促进BRCC3的结合和去泛素化来激活NLRP3炎性小体[8]。然而,NLRP3的磷酸化也可以抑制其活化。PYD结构域的Ser5发生磷酸化后与ASC蛋白PYD结构域产生静电斥力从而抑制NLRP3炎性小体活化,蛋白磷酸酶2A(PP2A)使该位点去磷酸化,从而促进NLRP3和ASC的相互作用。蛋白酪氨酸磷酸酶非受体型22(protein tyrosine phosphatase non-receptor type 22,PTPN22)可以使NLRP3的Tyr861位点去磷酸化而促进其活化。胆酸或前列腺素E2可以通过蛋白激酶A(PKA)介导的NLRP3的Ser295位点磷酸化,降低ATP酶活性而抑制NLRP3炎性小体的激活[9]。PKA和PKD介导的Ser295磷酸化对NLRP3炎性小体活化产生了相反的影响,这可能与磷酸化修饰发生的时间以及同时发生的其他翻译后修饰有关,但需要进一步的研究。
2.3.3 NLRP3小泛素相关修饰物化(SUMO):Sumoylation(SUMO)是类泛素蛋白家族的重要成员,目前哺乳动物中有4种亚型(SUMO1~4),SUMO化修饰过程与泛素化类似。细胞在静息状态时,SUMO E3连接酶MAPL介导的NLRP3 SUMO2/3化修饰可以抑制NLRP3活化;而信号2可以通过SUMO 特异性蛋白酶(SENP6和7)使NLRP3去SUMO2/3化,从而促进NLRP3炎性小体活化[10]。而另一项研究显示,SUMO E2连接酶UBC9催化NLRP3 Lys204位点发生SUMO1化修饰,从而促进ASC寡聚化和炎性小体活化;当SENP3催化NLRP3去SUMO1化后可抑制NLRP3炎性小体活化[10]。SUMO化修饰是蛋白质翻译后修饰研究的新热点,其对NLRP3炎性小体活化的调节可能与修饰的位点以及SUMO亚型相关,还需进一步深入研究。
2.3.4 NLRP3与其他翻译后修饰:NLRP3亦可被烷基化和S-亚硝基化修饰。烷基化对 NLRP3抑制作用的发现来自于抑制剂的研究,Bay11-7082、MNS、丙烯酰胺衍生物和BOT-4-one等抑制剂使NLRP3烷基化而抑制其激活。预测NLRP3 ATP酶催化口袋的Cys419是烷基化位点,该位点烷基化后降低NLRP3与ATP结合的亲和力,从而抑制ATP酶活性和NLRP3炎性小体激活。NLRP3烷基化也可能通过增加其泛素化水平来抑制其激活。此外研究报道,一氧化氮可以使NLRP3发生S-亚硝基化修饰从而抑制NLRP3炎性小体激活。

GPBAR1:G-蛋白偶联胆酸受体1;PTGER4:前列腺素E2受体EP4亚型;DRD1:D1A多巴胺受体图1 NLRP3蛋白翻译后修饰示意图Fig 1 Post-transcriptional modifications of NLRP3
2.4 其他
一些蛋白通过促进自噬而抑制NLRP3炎性小体激活。与克罗恩病发病风险相关的免疫相关GTP酶M通过与NLRP3和ASC蛋白结合,促进选择性自噬降解,抑制NLRP3炎性小体激活,对肠道炎性反应具有保护作用[11];在阿尔茨海默病(AD)中,自噬蛋白Beclin1介导小胶质细胞中NLRP3的选择性自噬降解,从而抑制神经炎性反应中促炎细胞因子IL-1β和IL-18的产生[12]。
另外,一些蛋白,如巨噬细胞迁移抑制因子[13]、微管亲和调节激酶4[14]、肌醇酶1α[15]、谷胱甘肽转移酶ω1-1[16]在NLRP3炎性小体激活中必不可少。研究报道,细胞在受到应激时,可以形成应激颗粒促进细胞存活,也可以形成炎性小体使细胞发生焦亡。应激颗粒的组成蛋白DDX3X可以促进NLRP3炎性小体激活,而应激颗粒的形成隔离了DDX3X与NLRP3的相互作用从而抑制NLRP3炎性小体激活,因此DDX3X通过调节NLRP3炎性小体决定应激细胞的生死[17]。
上述研究表明NLRP3炎性小体调节的广泛性和复杂性,而这些蛋白也为抑制NLRP3炎性小体激活以及相关疾病治疗提供了新的重要治疗靶点。
3 NLRP3炎性小体抑制剂
目前临床治疗NLRP3炎性小体相关疾病的策略是靶向下游产物IL-1β,但这对同时产生的IL-18以及细胞焦亡没有影响。随着对其激活机制的深入探讨,作用于NLRP3或其他组分蛋白或相关信号通路的药物开发成为NLRP3炎性小体抑制剂的研究热点,尤其是直接靶向NLRP3分子的药物因更具特异性和有效性而引起广泛关注(表1),下面重点介绍研究较为深入的几种抑制剂。
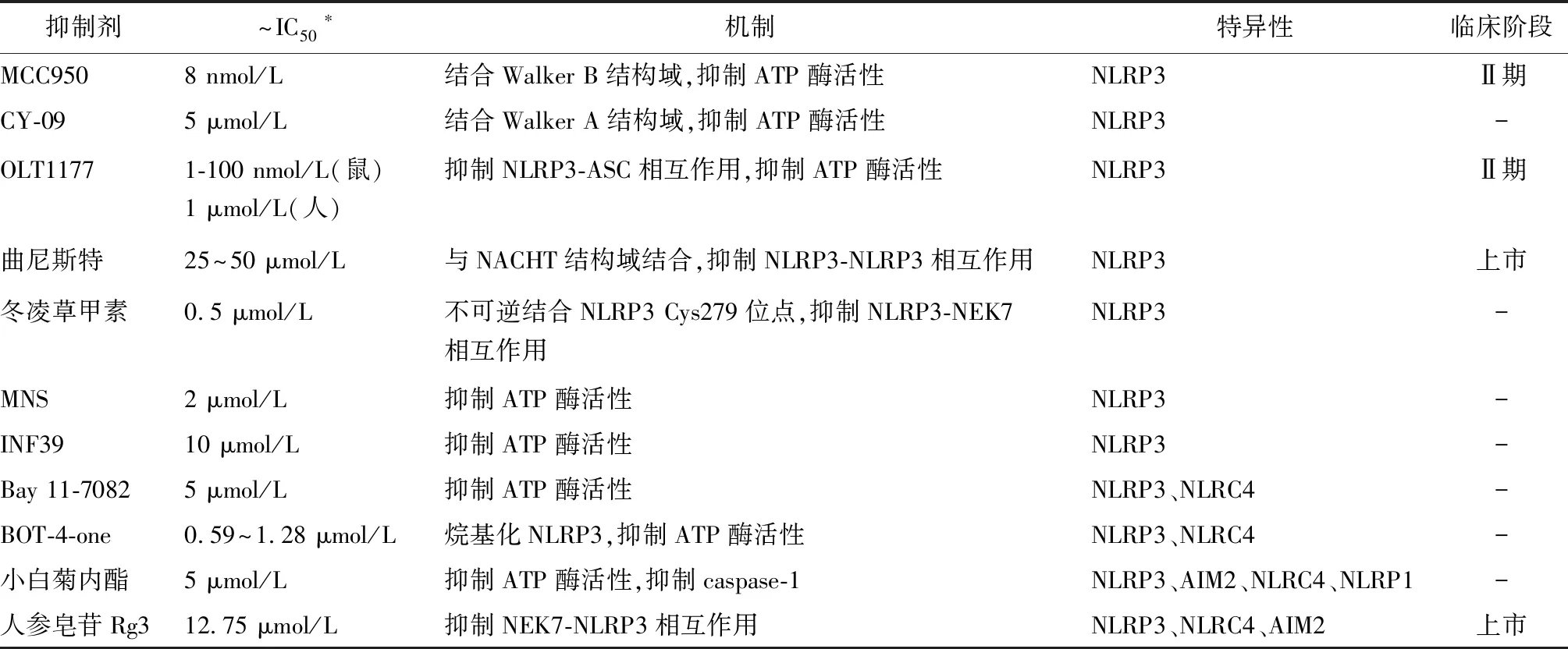
表1 直接靶向NLRP3的抑制剂及其特点[1]Table 1 Inhibitors that directly targeting NLRP3 and their characteristics
3.1 MCC950
MCC950(CRID3,CP-456773),是二芳基磺酰脲的衍生物,是目前作用最强的NLRP3炎性小体抑制剂,且抑制作用具有特异性,对其他炎性小体无影响。早期研究认为MCC950的作用机制是抑制ASC多聚化[18],而新近研究证实MCC950直接与NLRP3 NACHT结构域Walker B模序结合,阻碍NLRP3水解ATP从而抑制 NLRP3炎性小体激活。NLRP3 NACHT结构域ATP结合口袋的完整性影响其与MCC950的结合,CAPS的很多突变位点影响了ATP结合口袋的完整性从而使MCC950不能结合,因此作者提出MCC950可能对野生型NLRP3形成的炎性小体更有效[19]。MCC950对多种NLRP3相关疾病的动物模型具有良好改善作用,包括Nlrp3A350VCAPS、败血症、实验性脑脊髓炎、AD、帕金森病、动脉粥样硬化、心肌梗死、糖尿病、非酒精性脂肪肝和结肠炎等模型。而一项MCC950治疗类风湿关节炎的Ⅱ期临床试验因为其肝脏毒性而终止,因此其应用前景还需进一步观察[20]。
3.2 CY-09
CY-09是对小分子化合物CFTR(inh)-172结构改造而来,对NLRP3炎性小体的抑制作用具有特异性。CY-09能够直接与NLRP3 NACHT结构域的Walker A模序结合,抑制NLRP3的ATP酶活性和多聚化,从而抑制NLRP3炎性小体激活。在小鼠腹膜炎模型、CAPS模型以及高脂饮食诱导的糖尿病模型中,CY-09均显示出良好的改善作用[21]。
3.3 OLT1177
OLT1177对NLRP3炎性小体具有特异性抑制作用。机制上,OLT1177抑制NLRP3-ASC相互作用,进而影响NLRP3多聚化。此外,它还能够抑制NLRP3的ATP酶活性[22]。在小鼠痛风模型中,OLT1177通过抑制NLRP3炎性小体的活化从而发挥良好的改善作用[23]。
3.4 曲尼斯特
曲尼斯特是治疗过敏性疾病的上市药物,但作用机制一直未明。直到最近报道,曲尼斯特直接与NLRP3 NACHT结构域结合,阻碍了NLRP3-NLRP3的相互作用和多聚化,但并不影响ATP酶活性,从而抑制了后续NLRP3炎性小体的组装和激活。与前面NLRP3抑制剂不同的是,曲尼斯特可以抑制NF-κB通路,减少LPS刺激的pro-IL-1β和IL-6生成,提示其可能通过多途径抑制NLRP3炎性小体激活[24]。
3.5 冬凌草甲素
冬凌草甲素是传统中药冬凌草的二萜类提取物,具有抗癌和抗感染作用。它可以通过碳碳双键与NLRP3 NACHT结构域Cys279不可逆结合,影响NLRP3-NEK7相互作用,干扰炎性小体组装和激活。尽管冬凌草甲素对NF-κB和MAPK通路也有抑制作用,但抑制所需浓度是抑制NLRP3炎性小体所需浓度的10倍。另外,冬凌草甲素对于腹膜炎、痛风和2型糖尿病的动物模型亦具有良好疗效[25]。
4 问题与展望
近年来,对NLRP3炎性小体的研究虽然取得较大进展,但由于其复杂性和多样性,对其具体激活和调控机制的认识仍然有限,临床上也缺乏靶向NLRP3炎性小体的有效治疗药物,因此,继续深入探究NLRP3炎性小体的活化调控机制,在此基础上设计并研发针对NLRP3分子或多样化刺激剂引起其活化的共同关键信号通路特异性抑制剂有望为相关疾病的治疗带来新的希望。
