茶多酚对肺炎克雷伯菌抑菌作用的研究
2020-08-04刘五高张宁刘爱霞
刘五高 张宁 刘爱霞

[摘要] 目的 探讨茶多酚对肺炎克雷伯菌的杀菌作用,及其与常用抗菌药物联合使用的抑菌疗效,并初步探讨其作用机制。 方法 采用VITEK 2 Compact全自动微生物鉴定系统对临床分离的20株肺炎克雷伯菌进行细菌鉴定;K-B法检测常见药物亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定的敏感性;琼脂稀释法检测茶多酚的最低抑菌浓度(MIC);同时检测0.5 MIC(512 μg/mL)茶多酚与常用抗菌药物联合使用后试验药物抑菌环直径的变化,并判断茶多酚联合常用抗菌药物对多重耐药肺炎克雷伯菌抑制作用的可行性。使用结晶紫染色法、刚果红染色方法检测茶多酚对细菌生物膜形成和胞外黏液样物质(slime)产生的影响。 结果 20株肺炎克雷伯菌对常用抗菌药物均耐药,K-B值为6~15 mm;茶多酚对20株多重耐药肺炎克雷伯菌的MIC均值为1024 μg/mL;与常用试验药物联用:0.5 MIC(512 μg/mL)茶多酚能使亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定的抑菌环直径增加3~28 mm不等,能明显与受试抗生素产生显著的协同作用,并且能逆转部分试验药物从耐药变为敏感。亚抑菌浓度下茶多酚能显著抑制肺炎克雷伯菌生物膜和胞外黏液样物质(slime)的产生。 结论茶多酚与常用抗菌药物(亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定)联合使用对多重耐药肺炎克雷伯菌具有协同杀菌作用,并且影响其细菌生物膜形成和胞外黏液样物质(slime)的产生。
[关键词] 茶多酚;多重耐药;肺炎克雷伯菌;联合药敏试验
[中图分类号] R446.5 [文献标识码] B [文章編号] 1673-9701(2020)15-0044-05
Study on the antibacterial effect of tea polyphenols on Klebsiella pneumoniae
LIU Wugao ZHANG Ning LIU Aixia WU Ningjun JIN Jing
Department of Laboratory Medicine, Lishui People's Hospital in Zhejiang Province, Lishui 323000, China
[Abstract] Objective To investigate the bactericidal effect of tea polyphenols on Klebsiella pneumoniae and its antibacterial effect in combination with commonly used antibacterial drugs, and to explore its mechanism of action. Methods Bacterial identification of 20 strains of Klebsiella pneumoniae clinically isolated was performed using the VITEK 2 Compact microbiological identification system. K-B method was used to detect the sensitivity of common drugs imipenem, piperacillin/tazobactam, cefepime, cefotaxime, and ceftazidime. Agar dilution method was applied to detect the minimum inhibitory concentration(MIC) of tea polyphenols. The diameter changes of the bacteriostatic ring after the application of 0.5 MIC(512 μg/mL) tea polyphenols in combination with commonly used antibacterial drugs was tested. The feasibility of tea polyphenols combined with commonly used antibacterial drugs to inhibit Klebsiella pneumoniae was judged. The effects of tea polyphenols on bacterial biofilm formation and extracellular slime production were examined using crystal violet staining and Congo red staining. Results 20 strains of Klebsiella pneumoniae were resistant to commonly used antibacterials and the K-B value was 6-15 mm. The average MIC value of tea polyphenols to 20 strains of Klebsiella pneumoniae was 1024 μg/mL. Combined with commonly used antibacterial drugs: 0.5MIC(512 μg/mL) tea polyphenols could increase the diameter of bacteriostatic rings of imipenem, piperacillin/tazobactam, cefepime, cefotaxime, and ceftazidime by 3-28 mm, obviously produce a significant synergistic effect with the tested antibiotics, and reverse the change from resistance to sensitivity of some test drugs. Tea polyphenols could significantly inhibit the production of Klebsiella pneumoniae biofilms and extracellular slime-like substances at subinhibitory concentrations. Conclusion Tea polyphenols combined with commonly used antibacterial drugs(imipenem, piperacillin/tazobactam, cefepime, cefotaxime and ceftazidime) has a synergistic bactericidal effect against multidrug-resistant Klebsiella pneumoniae, and influences the formation of bacterial biofilms and the production of extracellular slime.
[Key words] Tea polyphenols; Multidrug resistance; Klebsiella pneumoniae; Combined drug sensitivity test
肺炎克雷伯菌是导致医院感染的常见病原菌,研究表明其耐药性尤其是对碳青霉烯类抗菌药物的耐药性近年来增长迅速[1],甚至出现了对黏菌素耐药的菌株[2]。如何有效治疗多重耐药肺炎克雷伯菌感染已成为临床上一项重要的课题。茶多酚(Tea polyphenols,TP)是茶叶中多酚类物质的总称[3]。近年来,国内外学者对茶多酚化学、药理和临床应用等进行了多方面研究,证实了茶多酚的杀菌力强,抗菌谱广,具有卓越的功效[4-6]。本研究对茶多酚在抑制多重耐药肺炎克雷伯菌的疗效进行了初步探讨,现报道如下。
1 资料与方法
1.1 材料来源
选取20株2017年2~11月我院临床分离的多重耐药菌肺炎克雷伯菌和肺炎克雷伯菌标准菌株ATCC70063(购自美国菌株保藏中心)为研究对象。
1.1.1 仪器 比浊仪和VITEK 2 Compact全自动微生物鉴定系统购自法国生物梅里埃公司;连续微量加样器购自美国Eppendorf公司,CO2培养箱购自德国Memmert公司。
1.1.2 試剂 MH琼脂为杭州滨和微生物试剂有限公司产品(批号170607);哥伦比亚血琼脂平板为郑州安图生物公司产品(批号20171204B);药敏纸片为英国OXOID公司产品(批号:CAZ,2256528;CXM,2346194 FEP 2199512;TZP,2217954;IPM2371850);茶多酚购自大连美仑生物(纯度>99.31%),其含有53.9%的EGCG(epigallocatechin gallate)和0.32%咖啡因;肉汤培养基(OXOID,批号2151741)。
1.2 方法
1.2.1 菌悬液的配制 从已分纯培养16~18 h的哥伦比亚血琼脂平板上挑取2~3个菌落分别移至3 mL生理盐水,以比浊仪校正浊度至0.5麦氏单位。
1.2.2 茶多酚储备液的配制 茶多酚储备液为10 mg/mL,将50 mg茶多酚粉末溶解于5 mL 0.15 mM H3PO4中,通过0.22 μm孔径的膜过滤器过滤制成保存液以避免氧化,使用前保存于为-20℃冰箱。
1.2.3 M-H琼脂平板和M-H茶多酚平板的配制 在90 mm内径的平板中倾注25 mL的培养基使其厚度为4 mm,配成M-H琼脂平板。将茶多酚储备液配于M-H琼脂平板中,使平板中茶多酚的终浓度分别为2048 μg/mL、1024 μg/mL、512 μg/mL、256 μg/mL和128 μg/mL,其为M-H茶多酚平板。
1.2.4 不同浓度茶多酚抑菌率曲线测定 微孔板生物检测法:平底96微孔板上取3个微孔作为阴性对照孔(对照孔中加入250 μL 0.15 mM H3PO4),分别加入250 μL培养液。后面每孔内分别加入250 μL 1.5×105 CFU/mL的细菌培养液。留3个微孔作为阳性对照,在之后的微孔中加入4096 μg/mL茶多酚250 μL,使其终浓度为2048 μg/mL,然后从中吸取250 μL混悬液至下一孔,依此类推,使后面微孔中的TP浓度分别为1024 μg/mL、512 μg/mL、256 μg/mL、128 μg/mL、64 μg/mL。于37℃过夜培养,波长600 nm下测定微孔板中各孔内培养液的吸光度(A)值,计算各孔中样品的抑菌率。抑菌率计算公式如下:抑菌率%=AR-A/AR-AB×100%。式中:AR:菌液阳性孔的吸光值,AB:阴性对照孔的吸光值,A:样品测定孔的吸光值。分别统计茶多酚的抑菌率。
1.2.5 Kirby-Bauer法药敏试验 把0.5麦氏单位的受试菌均匀涂布于M-H琼脂平板,同时在平板上分别贴上亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定,35℃~37℃培养18~24 h后量取抑菌环直径(mm),平行做两次,取平均值。结果判断标准按美国临床实验室标准化委员会(NCCLS)2018年推荐的方法及标准[7],以敏感(S)、中介(I)、耐药(R)报告药敏试验结果。
1.2.6 茶多酚的琼脂稀释与常规药敏纸片的联合检测 在0.5 MIC(512 μg/mL)茶多酚M-H平板上分别接种0.5麦氏单位的受试菌,同时在平板上分别贴上亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定,35~37℃培养18~24 h后量取抑菌环直径(mm)。平行做两次,取平均值。
1.2.7 结果判定 依据文献[8]进行判定,将琼脂稀释与常规药敏纸片联合,检测抑菌环直径增加5 mm以上为协同作用,增加3~4 mm为相加作用,<2 mm为无关作用。
1.2.8 茶多酚对肺炎克雷伯菌的作用研究 结晶紫染色法测茶多酚对肺炎克雷伯菌生物膜形成的影响,具体方法为:将菌悬液按10%(V/V)接种量接种96孔板中,37℃、180 r/min下振荡培养24 h,轻轻倒去培养液,用PS缓冲液洗去生物膜表面浮游细菌;加入0.1%结晶紫水溶液200 μL,室温染色5 min,倒出染色液用去离子水轻轻洗涤2次;45℃烘箱干燥后,加乙醇溶液0.2 mL,洗脱吸附于生物膜上的染料,595 nm处测定吸光值。通过将肺炎接种到含有刚果红平板上,37℃培养24 h定性检测茶多酚对胞外黏液样物质(slime)产生的影响。
1.3 统计学方法
采用SPSS17.0统计学软件进行数据处理,符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 茶多酚对肺炎克雷伯菌ATCC70063抑菌试验
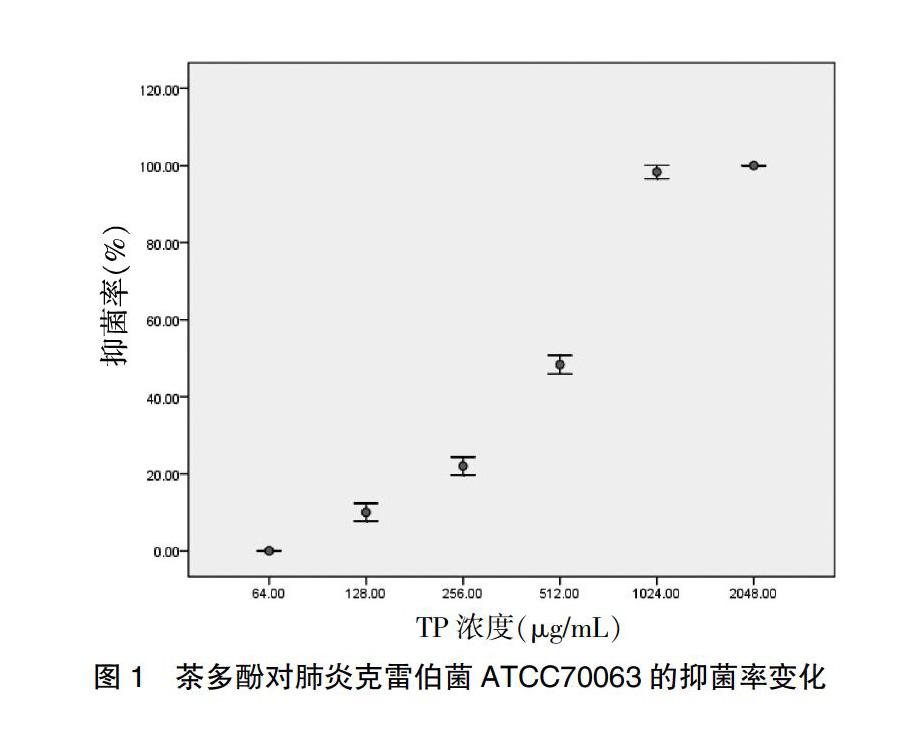
茶多酚对肺炎克雷伯菌ATCC70063抑菌率随浓度增加而增大,见图1。当茶多酚浓度为1024 μg/mL时受试菌被完全抑制,因此,其MIC值在512~2048 μg/mL之间,该处取其均值1024 μg/mL。
2.2 茶多酚的瓊脂稀释法与常规药敏纸片的联合检测
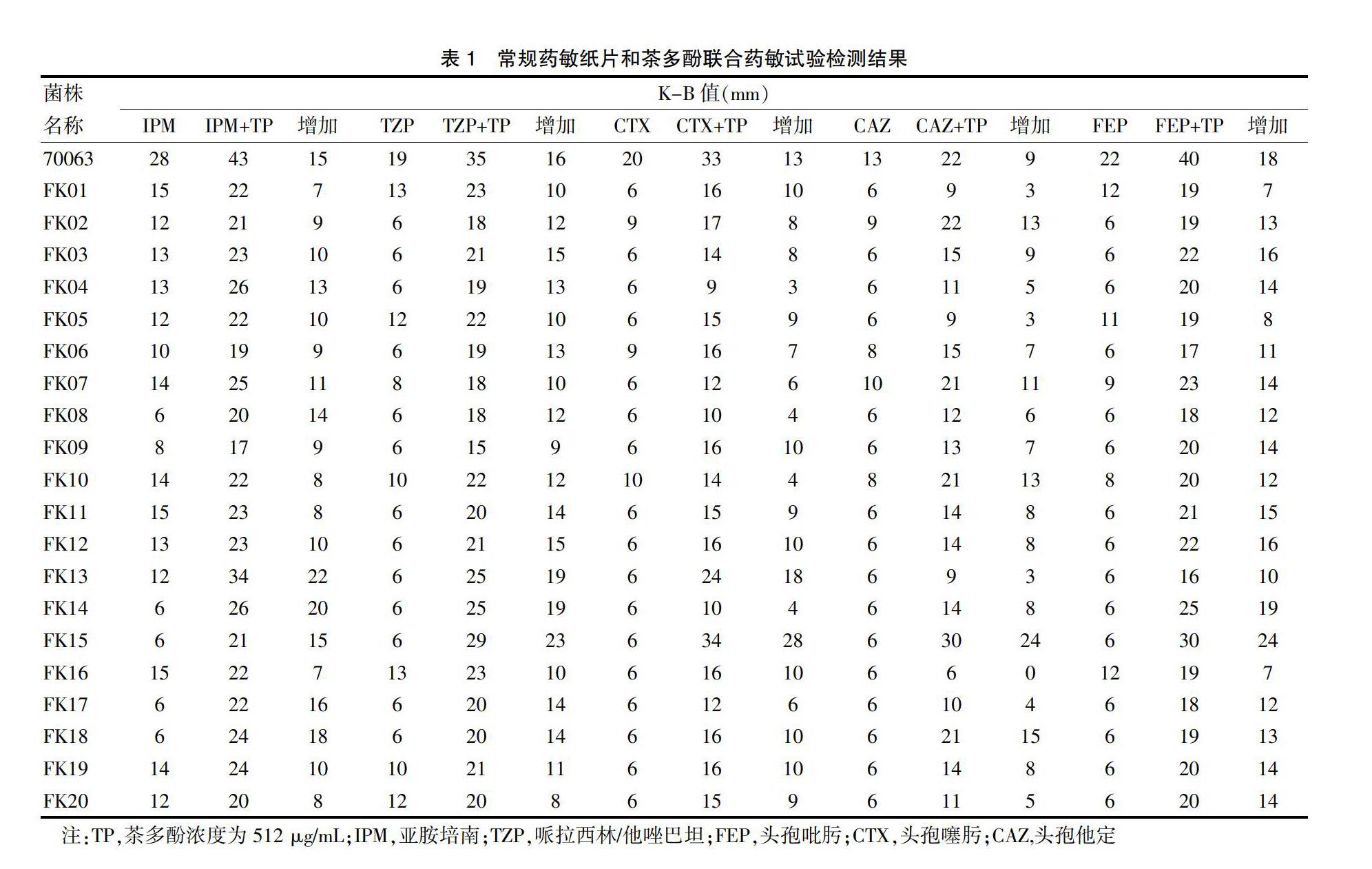
浓度512 μg/mL的茶多酚琼脂平板分别和抗生素联合药敏检测(封三图3),使试验菌的相应抗生素K-B值明显增大,依据文献[8]把抑菌环直径增加5 mm以上为具协同作用,在肺炎克雷伯菌药敏试验中茶多酚对试验的5种抗生素均有协同作用,能使亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定的抑菌环直径增加3~28 mm不等,使原本耐药的抗生素发生逆转,重新对多重耐药肺炎克雷伯菌敏感。见表1。
2.3 茶多酚对肺炎克雷伯菌生物膜形成的影响
2.3.1 对肺炎克雷伯菌生物膜形成的影响 经SPSS 17.0软件独立样本t检验分析,0 μg/mL组与研究各组的生物膜形成均有显著差异(t值分别为35.700、101.329、94.000,P均<0.001);200 μg/mL组与其他各组间有显著性差异(t值分别为23.720、24.502,P均<0.001);但600 μg/mL组与400 μg/mL组之间无差异(t=-2.673,P=0.060)。表明茶多酚能显著抑制生物膜的形成,但这种抑制功能在400 μg/mL茶多酚浓度之后并不呈浓度梯度依赖性。茶多酚在400 μg/mL之前肺炎克雷伯菌生物膜形成与浓度梯度有显著性变化,但之后与茶多酚浓度梯度差异不显著。见表2。
2.3.2 茶多酚对细菌胞外黏液样物质(slime)产生的影响 通过将细菌接种到含有刚果红平板上,定性检测茶多酚对slime形成的影响。经培养20 h后,从平板培养的菌落可以明显观察到(封三图4)在没加茶多酚的平板上菌落呈黑色,表明肺炎克雷伯菌分泌胞外黏液样物质(slime),为slime阳性。而加入茶多酚的菌株呈淡粉色无黑色菌落,为slime阴性。表明茶多酚可明显抑制肺炎克雷伯菌株胞外黏液样物质(slime)的产生。
3 讨论
随着抗生素的长期和广泛使用,致使耐药性致病菌的检出率不断增加,这对临床抗感染治疗产生了巨大挑战。而超级细菌的出现与流行,如碳青霉烯类耐药肺炎克雷伯菌已在WHO的全部区域都已检出[9],更加重了人们对这一问题的担忧。
茶多酚已被证明具有广谱抗菌性能,大量研究表明,茶多酚对枯草芽孢杆菌、金黄色葡萄球菌和沙门氏菌等常见细菌有较强的抑制作用[10-12]。当然,不同细菌对茶多酚的抗性不同,这和茶多酚的具体构成成分以及细菌的特点有关。同时,有研究发现茶多酚与多种抗生素具有协同抗菌作用,如茶多酚与四环素协同能对葡萄球菌有抑菌作用等[13]。而本次研究也发现其能够加强亚胺培南、哌拉西林/他唑巴坦、头孢吡肟、头孢噻肟和头孢他定对肺炎克雷伯菌的抗菌活性,并且在亚抑菌浓度下(512 μg/mL),能显著增加抗菌药物的K-B值,其抑菌环直径绝大多增加到5 mm以上,提示茶多酚与抗菌药物联用存在显著的协同作用。其中对亚胺培南、哌拉西林/他唑巴坦和头孢吡肟的协同作用最大,头孢噻肟和头孢他定其次。使部分耐药的受试抗生素逆转为敏感,并且这种逆转与细菌本身的耐药性无显著相关。目前,茶多酚抗菌机制还未有明确定论,未完全清楚。有些研究认为茶多酚中的EGCG可能直接绑定肽聚糖并促使其沉淀,由于肽聚糖是许多细菌细胞壁的主要成分,所以EGCG可阻碍细菌细胞壁的形成和作用,这种假说被认为是茶多酚的主要抑菌机理[14]。也有理论认为,茶多酚的抗菌作用,主要是通过与活性氧物质反应,产生过氧化氢,从而发挥作用[15]。此外,有研究证实茶多酚可发挥特异性凝固细菌蛋白的作用,从而破坏细菌细胞膜结构,改变细菌生理抑制生长。而本研究揭示了茶多酚对细菌生物膜形成具有明显抑制作用,但这种抑制功能并不全部是浓度依赖性,大约在0~0.5 MIC与茶多酚浓度呈正相关,0.5 MIC浓度之后其抑制作用明显变弱。另外,通过茶多酚对细菌胞外黏液样物质(slime)产生的影响研究,表明茶多酚对肺炎克雷伯菌的毒性因子也具有抑制作用。其机制可能与细菌的群体感应作用有关[16]。茶多酚通过干扰细菌群体感应中信号分子的合成从而影响细菌成膜能力,对细胞膜形成起到了抑制作用,使细胞内外渗透压失衡,导致细胞破裂甚至死亡[17]。本研究也进一步证实了茶多酚的这种抑制机制。
虽然体外试验已证实茶多酚对细菌生长具明显的抑制作用,但由于茶多酚被人体较难吸收利用,其到达靶器官或组织的量相对较低并且代谢速度很快,其药物浓度远远低于实验所测的MIC值,导致其生物学活性大大降低[18-20],因此,限制了茶多酚由实验室向实际应用领域的拓展。在今后的研究中,我们应着力于研究改善茶多酚在机体内的吸收与代谢的相关技术,例如基于纳米结构的药物递送系统、分子修饰以及茶多酚与其他天然产物协同作用等[21],使我们能够更好地评估茶多酚及其代谢物对改善宿主健康的贡献。
[参考文献]
[1] 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2017,(5):7-17.
[2] Wang Y,Tian GB,Zhang R,et al. Prevalence,risk factors,outcomes,and molecular epidemiology of mcr-1-positive Enterobacteriaceae in patients and healthy adults from China:An epidemiological and clinical study[J].Lancet Infectious Diseases,2017,17(4):390.
[3] Pasrija D,Anandharamakrishnan C. Techniques for extraction of green tea polyphenols:A review[J]. Food and Bioprocess Technology,2015,8(5):935-950.
[4] Hannig C,Sorg J,Bettina Spitzmüller,et al. Polyphenolic beverages reduce initial bacterial adherence to enamel in situ[J]. Journal of Dentistry,2009,37(7):566.
[5] Hannig C,Bettina Spitzmüller,Al-Ahmad A,et al. Effects of Cistus-tea on bacterial colonization and enzyme activities of the in situ pellicle[J]. Journal of Dentistry,2008,36(7):0-545.
[6] Li W,Qi XU,Shun XU,et al. Research progress of tea polyphenols on growth of microorganisms[J]. Modern Food Science and Technology,2013,29(7):1737-1741.
[7] Dalyan Cilo Burcu,Topa? Tuncay,A [g]ca Harun,et al. Comparison of clinical laboratory standards institute(CLSI) and european committee on antimicrobial susceptibility testing (EUCAST) broth microdilution methods for determining the susceptibilities of Candida isolates[J]. Mikrobiyoloji Bulteni,2018,52(1).
[8] 胡麗庆,孙定河,王盛,等. 大蒜素琼脂纸片扩散法联合药试验的可行性研究[J]. 中国卫生检验杂志,2017,(6):16-19.
[9] Campos,Anaelís C,Albiero J,et al. Outbreak of Klebsiella pneumoniae carbapenemase-producing K pneumoniae:A systematic review[J]. American Journal of Infection Control,2016,44(11):1374-1380.
[10] Sun FL,Chen GN,Wu B,et al. Research on the extraction and antibacterial activity of tea polyphenols[J]. Applied Mechanics and Materials,2014,644-650:5157-5160.
[11] 王莹. 茶多酚的抗氧化和抑菌活性及其增效剂[J]. 生物学杂志,2007,(5):56-58.
[12] 董璐,代增英,韩晴,等. 茶多酚对大肠杆菌抑菌机理的研究[J]. 生物学杂志,2015,(1):72-75.
[13] 华德兴,许晓玲,彭青,等. 表儿茶素没食子酸酯与四环素协同抗金黄色葡萄球菌作用及机制[J]. 中国新药与临床杂志,2009,(12):65-69.
[14] Chan EC,Tie PP,Soh EY,et al. Antioxidant and antibacterial properties of green,black,and herbal teas of Camellia sinensis[J]. Pharmacognosy Research,2011,3(4):266.
[15] Hamilton-Miller JM. Antimicrobial properties of tea(Camellia sinensis L.)[J]. Antimicrobial Agents & Che-motherapy,1995,39(11):2375-2377.
[16] Honging Yin,Yifeng Deng,Huafu Wang,et al. Tea polyphenols as an antivirulence compound disrupt quorum-sensing regulated pathogenicity of pseudomonas aeruginosa[J]. Scientific Reports,2015,5(1):16158.
[17] 黄旭镇. 大黄鱼特定腐败菌波罗的海希瓦氏菌QS系统的鉴定及茶多酚调控研究[D]. 杭州:浙江工商大学,2015:55-57.
[18] Sun H,Chen Y,Chen M,el al. The modulatory effect of polyphenols from green tea,oolong tea and black tea on human intestinal microbiota in vitro[J]. J Food Science and Technology,2018,55(1):399-407.
[19] Guo X,Cheng M,Zhang X,et al. Green tea polyphenols reduce obesity in high-fat diet-induced mice by modulating intestinal microbiota composition[J]. International Journal of Food Science & Technology,2017,52(8):1723-1730.
[20] Xin Zhang,Man Zhang,Chi-Tang Ho,et al. Metagenomics analysis of gut microbiota modulatory effect of green tea polyphenols by high fat diet-induced obesity mice model[J].Journal of Functional Foods,2018,46:268-277.
[21] 周方,欧阳建,黄建安,等. 茶多酚对肠道微生物的调节作用研究进展[J]. 茶叶科学,2019,39(6):619-630, 616.
(收稿日期:2020-02-21)
