肾移植术后人肾存活患儿生长发育的队列研究
2020-08-04谭锦兰钟发展王长希刘龙山李颖杰
廖 欣 谭锦兰 张 妙 钟发展 王长希 邱 江 傅 茜 刘龙山 李颖杰
近年来,儿童肾移植在国内得到关注和推广,越来越多的终末期肾病(ESRD)患儿接受了肾移植治疗,随着儿童肾移植技术的日益成熟,儿童肾移植成功率明显提高,大部分移植后的患儿都能获得良好的长期生存指标,部分患儿出现追赶性生长,使得移植前的生长迟缓状态得到改善。尽管如此,仍然有部分移植后患儿存在生长迟缓,直接影响其成年最终身高。目前国内对于肾移植后儿童生长发育的临床特征了解较少,尚缺乏相关的临床研究报道。国外报道,肾移植后患儿的生长发育情况会获得不同程度改善,与移植年龄、移植物功能、糖皮质激素(GC)和生长激素的使用有关[1-4]。本文探讨儿童肾移植后生长发育特征及影响追赶性生长的因素。
1 方法
1.1 研究设计 队列研究。以接受肾移植人肾存活患儿为对象,在不同时点行身高、体重测量,考察移植后不同时点身高生长速率(ΔHtSDS)和末次随访身高标准差比值(HtSDS)。
1.2 肾移植指征 各种原因导致的ESRD。
1.3 肾移植伦理和知情同意 本研究通过广州市妇女儿童医疗中心(我中心)伦理委员会审批(穗妇儿伦审批号第2018052401号),行肾移植患儿及其监护人均签署书面知情同意书。
1.4 肾移植资质和肾源 2017年7月起我中心与中山大学附属第一医院合作开展儿童器官捐献供肾-儿童受者肾移植工作,我中心负责提供器官供体、对受者进行术前评估与治疗,后者负责供体肾摘除及受者移植手术,两中心共同承担受者的术后随访。
1.5 儿童肾移植手术和免疫抑制治疗 ①采用单肾移植术式,供肾置于受者右侧髂窝,供肾静脉与受者髂外静脉端侧吻合,供肾动脉与受者髂内动脉端端吻合。②免疫抑制治疗采用抗人胸腺细胞免疫球蛋白联合甲泼尼龙琥珀酸钠诱导治疗,术后2周GC减量至维持剂量,与他克莫司联合吗替麦考酚酯或麦考酚钠或咪唑利宾三联免疫抑制剂口服治疗,定期监测他克莫司药物谷浓度。
1.6 儿童肾移植后随访时点 肾移植术后15~30 d随访1次,以后要求每3个月随访1次,本文截取6、12、18和24个月以及随访终点的随访结局指标。
1.7 生长发育评估[5]采用标准差比值(SDS)评分法[6]行身高、体重和BMI评估,SDS=(实测身高-同年龄同性别的均值身高)/SD,身高标准参照WHO 2007标准,SDS<-2为生长迟缓。以每年SDS增值(ΔSDS)表示生长速率,ΔSDS>0.5为追赶性生长。儿童平均正常身高增长速度为:36~48月龄每年7 cm;4岁至青春前期每年5~6 cm。以BMI<18.5 kg·m-2为消瘦,~24 kg·m-2为体重正常,~28 kg·m-2为超重, ≥28 kg·m-2为肥胖[7]。
1.8 纳入标准 同时满足以下条件:①第1次肾移植肾存活时间>3个月,②肾移植术后随访时间>6个月;③女性患儿行移植手术时未来月经初潮。
1.9 排除标准 满足以下任1项:①肾移植术后随访期间各种原因致移植肾失功需要再次维持性透析者或不可避免的移植肾切除者;②第2次肾移植者。
1.10 影响终点HtSDS的因素及采集 复习文献,将如下因素作为终点HtSDS的自变量:移植年龄,维持透析时间,供体年龄,供受者错配点数,基础原发病,平均动脉压(平均动脉压=舒张压+1/3脉压差,高于同年龄、同性别和同身高儿童正常血压的P95视为高血压[8]),并发症,药物(GC、降压药、骨化三醇)的使用,术后随访实验室指标(血肌酐、血清白蛋白、Hb、血钙、血磷、他克莫司血药浓度,尿蛋白/肌酐、尿RBC计数等)。需要说明的是,本文各项实验室指标以末次随访数据代表康复期间的转归结局,随访期间重复监测的平均水平代表康复期间指标变化趋势,二者之间是否一致反映康复的稳定程度。
1.11 GC剂量评估 ①GC累积总量:自移植手术免疫抑制诱导治疗起计算,累积至随访终点,按泼尼松剂量等量换算记录;②GC每公斤累积剂量:累积剂量/体重;③GC每公斤每天剂量:每公斤累积剂量/观察期内总天数。根据GC的给药剂量(mg·kg-1·d-1)[9、10]分为:①冲击量 15~30; ②维持低剂量 <0.25; ③小剂量~0.5,中等量~1.0,大剂量>1.0。
1.12 统计学分析 应用SPSS 19.0统计学软件进行数据处理,符合正态分布的计量资料以xˉ±s表示,非正态分布的计量资料以M(Q1,Q3)表示;计数资料采用频数、构成比、百分比和率等统计学指标描述。计量资料组间比较,正态分布时采用t检验(方差齐性)或校正t检验(方差不齐),非正态分布时采用非参数Wilcoxon秩和检验。计数资料组间比较采用卡方检验、Fisher精确概率法或秩和检验。采用相关分析、多元线性回归分析、Logistic回归分析来评估2个独立变量间的关联,多变量分析调整潜在的混杂因素,以相关系数(r)、β系数、优势比(OR)及95%CI描述。
2 结果
2.1 一般资料 2017年7月至2019年11月我中心符合本文纳入和排除标准的18例肾移植受者进入本文分析。男5例,女13例;中位移植年龄7.5(4.9,9.8)岁;肾移植前原发病:原发性肾小球疾病5例、遗传性肾脏病9例、先天肾发育不良/泌尿道畸形3例、病因不明1例;移植前17例行透析治疗,维持性透析时间2~21个月,中位时间8(4.5,13)个月;肾移植前6例使用GC。
器官捐献供体类型:脑死亡15例,心跳停止死亡3例,供体中位年龄2.3(1.8,3.7)岁,供受者人类白细胞抗原(HLA)-A、HLA-B、HLA-DR传统位点配型中位错配数目4.5(4,5)个。
2.2 生存状况 肾移植后随访7~31个月,中位随访时间17.5(11,24.5)个月,随访时间≥2年者7例。肾移植后至末次随访人肾存活率均为100%。未出现并发症10例;8例出现并发症,其中3例重症感染,4例抗体介导性排异反应,1例原发肾病复发,经相应治疗后病情均得到治愈或缓解(尿蛋白缓解,肾功能、尿量及血压恢复正常,群体反应性抗体减少或消失)。随访12个月移植肾长径增长(13.3±9.1) mm。GC累积剂量(143.6±86.6) mg·kg-1,每天剂量为(0.30±0.15) mg·kg-1,9例维持低剂量,7例小剂量,2例中等剂量。使用骨化三醇治疗9例,降压药治疗10例[其中4例使用血管紧张素转换酶抑制剂(ACEI),6例使用β-受体拮抗剂]。表1显示,各项实验室指标末次随访值与随访期内的平均水平差异均无统计学意义。

表1 儿童肾移植后常规实验室检查指标
2.3 移植后随访期患儿身高、体重及BMI变化情况 表2显示,移植后12个月及末次随访HtSDS均较移植前增高,差异有统计学意义,随访终点有9例患儿HtSDS>-2,达标率为50%(9/18)。移植后12个月ΔHtSDS 0.8(0.1,1.2),身高呈追赶性生长,其中11例患儿ΔHtSDS≥0.5,追赶率61%(11/18)。移植后24个月ΔHtSDS -0.1(-0.3,0.4),年平均身高增长(6.55±2.11)cm,接近同年龄同性别正常身高儿童的增长速度,身高呈减速生长。HtSDS移植前与末次随访呈正相关(r=0.64,P=0.005),与移植后12个月呈负相关(r=-0.61,P=0.008)。WtSDS移植后12个月和末次随访较移植前差异均有统计学意义。随访终点根据BMI值按照中国标准体态偏瘦12例、正常5例、肥胖1例。
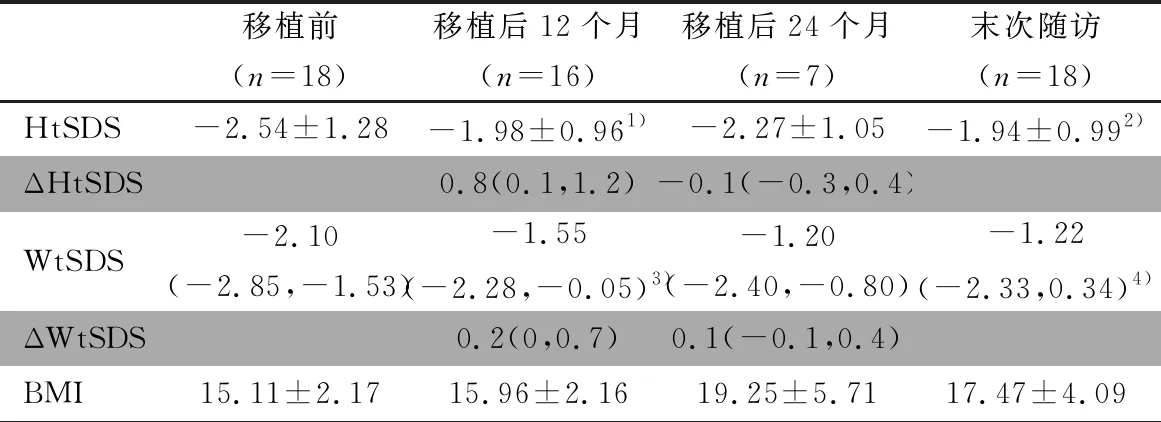
表2 随访期间患儿身高、体重及BMI变化情况
2.4 肾移植后12个月追赶性生长的影响因素 以肾移植后12个月是否ΔHtSDS≥0.5为追赶和无追赶2组,截取本文1.10中的HtSDS因素作为影响因素变量,鉴于末次随访与随访期间实验室监测指标差异均无统计学意义(表1),故其中实验室监测指标取随访终点指标。表3显示,移植前HtSDS低、移植年龄小和末次平均动脉压低,肾移植后更倾向于发生身高追赶性生长,差异有统计学意义。口服降压药物追赶组和无追赶组分别为7例和1例。
将表3中移植年龄、末次平均动脉压和基线HtSDS等作为备选因子进行肾移植后12个月ΔHtSDS的多元线性回归分析,表4显示,移植前较低的HtSDS、较小的移植年龄及正常低限的平均动脉压是儿童肾移植后提高ΔHtSDS的有利因素。以降压药的使用作为自变量,肾移植后12个月ΔHtSDS作为因变量,行Logistic回归分析,OR=10.50(95%CI:0.91~21.39),Walfχ2=3.55,P=0.05,降压药的使用是肾移植后身高追赶性生长的独立保护因素。

表4 肾移植后12个月ΔHtSDS的多元线性回归分析

表3 肾移植后12个月ΔHtSDS的单因素分析[n(%)]
3 讨论
生长落后是慢性肾脏病及ESRD儿童主要的临床特征之一,国外报告[11]显示,接受肾移植之前的ESRD患儿较正常儿童低1.61~1.78 SD。造成ESRD患儿生长发育障碍的原因是多方面的,发病年龄越小,透析时间越长,生长迟缓越明显。肾移植后患儿的生长发育情况会获得不同程度改善,部分患儿生长加速而出现追赶性生长,但移植后的追赶性生长通常不足以补偿移植前发生的生长迟缓,大多数受者最终身高并未达到自然预测身高[12]。本研究同样显示患儿在接受肾移植后第1年出现身高的追赶性生长,但在移植后第2年身高出现减速而停止了追赶性生长,随访终点依然有50%患儿身高落后同年龄同性别正常儿童身高2个SD以上。 2006年北美儿童肾脏病临床试验和合作研究机构(NAPRTCS)数据显示,1 500例儿童肾移植受者19岁时平均身高在-1.4 SD,其中25%身高低于-2.3 SD,10%的患儿身高低于-3.3 SD[13]。也有文献[14]报道肾移植后患儿最终身高能达到正常水平即第3个百分位只有42%~75%,有62%~77%的患儿在18岁或以上年龄表现为身材矮小。
尽管肾移植成功,部分患儿的生长迟缓难以避免,影响患儿移植后的纵向生长是多因素的。本研究显示,移植前基线身高越落后的患儿,移植后追赶性生长越显著。追赶性生长是人类在有一个时期的生长停滞或落后,之后去除某些导致生长迟缓的病理因素而出现生长加速,使生长回到原来的遗传性轨道生长。肾移植后的追赶性生长推测可能与肾功能的改善后负反馈性胰岛素样生长因子1(IGF-1)分泌量增加有关[15]。本研究显示,移植年龄较小的患儿移植后身高加速生长较明显,尤其是第1年,在NAPRTCS 2006报告[13]中,只有婴儿和学龄前儿童(2~5岁)在移植后出现追赶性生长,主要发生在移植后的前2年,学龄儿童(6~12岁)和青少年的身高SDS没有改善甚至下降,也有其他研究报道[1]在青春期前(6~10岁)的儿童受者中同样出现了追赶性生长。本研究还显示,正常低限的血压及降压药物的使用是ΔHtSDS的独立保护因素。有研究[16]发现,血IGF-1水平与动脉血压呈正相关,心脏内IGF-1水平及受体的表达水平随血压增高而逐渐增加,IGF-1水平在体内升高使得IGF-1受体数量及活性降低,导致了GH抵抗引起生长迟缓。因此,合理选择降压药物,使儿童受者血压控制在同年龄同性别正常儿童血压的-1 SD左右,有利于其身高的追赶性生长。
长期GC的暴露对于生长发育的影响早有定论[17],主要是由于干扰了成纤维细胞生长因子23(FGF23)/活性维生素D3[18]和生长激素(GH)/IGF-1[19]2个生长轴,而导致成骨不良的生长迟缓。然而,对于GC的具体使用剂量及维持时间所能起到的阻碍作用,尚无定论。本研究未发现GC平均剂量对身高追赶生长的影响,可能由于整体被纳入研究患儿随访期单位体重平均GC剂量,属于维持低剂量至小剂量范畴,由此推断移植后身高的追赶性生长并不受0.25 mg·kg-1·d-1这一维持性低剂量的GC使用的影响,并且不受GC使用持续时间影响,随着GC剂量的增加,患儿生长迟缓的风险随之升高。本文同样未发现使用骨化三醇能如预期般促进身高生长加速,可能与尚未纳入某些固有影响因素做研究有关,如FGF23、活性维生素D3及骨化三醇量效关系等[20]。
患儿肾移植后终点身高由移植前基线身高和移植后追赶性生长所决定,因此凡能影响患儿肾移植前基线身高的因素如移植前维持透析时间、肾功能及有关营养的血清白蛋白和血磷水平等均可影响终点HtSDS。因此已确诊ESRD患儿应尽早接受肾移植治疗,并尽可能改善患儿移植前的生长发育和营养状态,术后综合优化有利于促进身高追赶性生长的各项治疗措施如优化GC及降压药等药物的合理使用、维持良好的肾功能和营养状态等,以期能达到最终的理想身高。同时本文数据将为下一步开展相关临床干预研究的时机及策略提供依据。
