青蒿素对脂多糖诱导的小鼠巨噬细胞NF-κB信号通路激活和NO合成的影响
2020-08-04孙丕忠
安 莉,孙丕忠
1)四川省医学科学院·四川省人民医院重症监护室 成都 610000 2)青岛市黄岛区中医医院外一科 山东青岛 266500
巨噬细胞是人体免疫系统的重要组成部分,不仅参与机体正常免疫过程,还与动脉粥样硬化等心血管系统疾病的发生有关[1]。脂多糖(lipopolysaccharides,LPS)是革兰阴性菌的主要组成部分,可以诱导巨噬细胞核因子-κB(nuclear factor-κB,NF-κB)信号通路的激活,从而促进炎症因子的释放和一氧化氮(nitric oxide,NO)的合成[2]。青蒿素是一种新型倍半萜内脂化合物,具有抗炎、抑制血管生成、抗肿瘤等功效,可抑制巨噬细胞分泌炎症因子[3-4]。本实验观察了青蒿素对LPS诱导的小鼠巨噬细胞NF-κB信号通路的激活及炎症反应的影响,为进一步明确青蒿素的抗炎机制提供依据。
1 材料与方法
1.1细胞及主要试剂小鼠巨噬细胞Raw264.7购自上海纪宁实业有限公司;青蒿素购自南京森贝伽生物科技有限公司; TNF-α检测试剂盒购自武汉伊莱瑞特生物科技股份有限公司, IL-1β检测试剂盒购自上海江莱生物科技有限公司,NO检测试剂盒购自上海彩佑实业有限公司;Toll样受体4(toll-like receptor-4,TLR4)抗体、诱导型NO合酶(inducible nitric oxide synthase,iNOS)抗体购自美国Abcam,IκB-α抗体、NF-κB p65抗体购自美国Santa Cruz Biotechnology;LPS购自美国Sigma;细胞质蛋白提取试剂盒、细胞核蛋白提取试剂盒购自生工生物工程(上海)股份有限公司。
1.2细胞分组将Raw264.7细胞分成空白对照组、LPS组、青蒿素20 mg/L组、青蒿素40 mg/L组、青蒿素80 mg/L组[5-6]。LPS组细胞以含有LPS(1 mg/L)的细胞培养液培养;青蒿素20、40、80 mg/L组细胞分别以含有LPS和20、40、80 mg/L青蒿素的细胞培养液培养;空白对照组以不含LPS和青蒿素的细胞培养液培养。细胞培养24 h后,进行相关指标检测。
1.3巨噬细胞TNF-α、IL-1β、NO分泌量的检测取各组细胞培养上清,用ELISA法检测TNF-α、IL-1β含量;用Griess试剂法检测培养上清中亚硝酸盐含量,亚硝酸盐含量可以间接反应NO含量。均依照试剂盒说明书操作。
1.4巨噬细胞中TLR4、iNOS、IκB-α的检测采用Western blot法检测。取各组细胞接种到6孔板中,每孔加入100 μL蛋白裂解液裂解细胞,提取细胞总蛋白,BCA法定量,加入5×Loading Buffer混合,于100 ℃水浴中煮沸5 min。用100 g/L分离胶、50 g/L浓缩胶进行SDS-PAGE,蛋白上样量为30 μg。分离胶中以160 V恒压电泳,浓缩胶中90 V恒压电泳。溴酚蓝染料到达凝胶末端后,取出凝胶,转膜(转膜电压100 V,时间50 min),将NC膜置于抗体孵育袋中,分别与TLR4、iNOS、IκB-α一抗(1∶1 000稀释)、HRP标记的二抗(1∶2 000稀释)反应液杂交,HRP-ECL发光。用Image J图像处理系统分析条带灰度值,以β-actin作为参照。以目的条带与β-actin条带灰度值的比值表示目的蛋白表达水平。
1.5细胞质和细胞核中NF-κB p65蛋白的检测采用Western blot法检测。取各组细胞,分别提取细胞质和细胞核总蛋白,按照细胞质蛋白提取试剂盒、细胞核蛋白提取试剂盒说明操作,用Western blot法检测NF-κB p65蛋白表达水平。NF-κB p65抗体以1∶1 000稀释,步骤同1.4。细胞核中NF-κB p65蛋白定量以Histone H作为内参,细胞质中以β-actin作为内参。
1.6统计学处理数据采用SPSS21.0分析,5组各指标的比较采用单因素方差分析,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.15组巨噬细胞TNF-α、IL-1β分泌量的比较见表1。与空白对照组比较,LPS组细胞TNF-α、IL-1β分泌量升高(P<0.05)。与LPS组比较,各青蒿素处理组细胞TNF-α、IL-1β分泌量降低(P<0.05),并且青蒿素80 mg/L组TNF-α、IL-1β分泌量最低(P<0.05)。
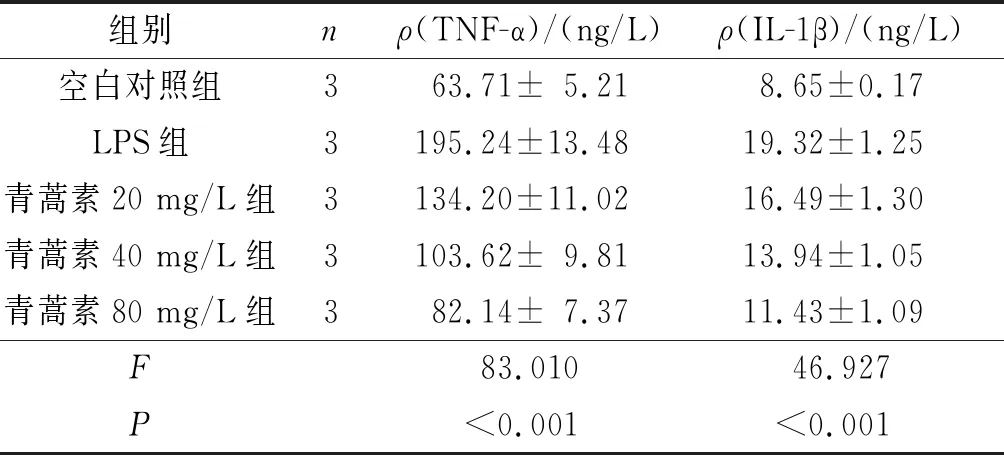
表1 5组巨噬细胞TNF-α、IL-1β分泌量的比较
2.25组巨噬细胞中NO分泌量和iNOS蛋白表达水平的比较见图1和表2。与空白对照组比较,LPS组细胞NO分泌量及细胞中iNOS表达水平升高(P<0.05)。与LPS组比较,各青蒿素处理组细胞NO分泌量及细胞中iNOS表达水平降低(P<0.05);并且青蒿素80 mg/L组变化最显著(P<0.05)。

表2 5组巨噬细胞NO分泌量和iNOS表达水平的比较
2.35组巨噬细胞中IκB-α、TLR4蛋白表达水平的比较见图1和表3。与空白对照组比较,LPS组细胞中TLR4蛋白表达水平升高,IκB-α蛋白表达水平降低(P<0.05)。与LPS组比较,各青蒿素处理组细胞中TLR4蛋白表达水平降低,IκB-α蛋白表达水平升高(P<0.05);且青蒿素80 mg/L组细胞中TLR4蛋白表达水平最低,IκB-α蛋白水平最高P<0.05)。

1:空白对照组;2:LPS组;3、4、5:青蒿素20、40、80 mg/L组
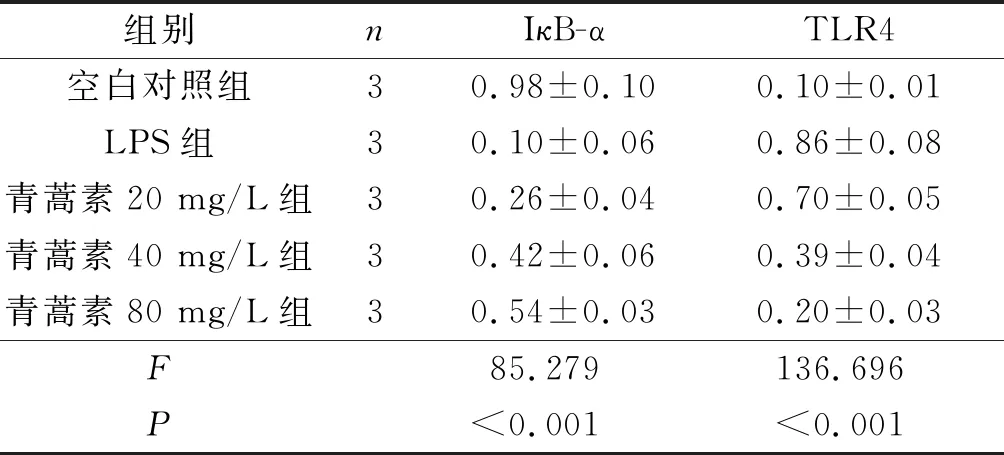
表3 5组巨噬细胞中IκB-α、TLR4蛋白表达水平的比较
2.45组巨噬细胞中NF-κB p65表达的比较见图2、表4。与空白对照组比较,LPS组胞质中NF-κB p65蛋白表达水平降低,胞核中NF-κB p65蛋白表达水平升高(P<0.05)。与LPS组比较,各青蒿素处理组胞质中NF-κB p65蛋白表达水平升高,胞核中NF-κB p65蛋白表达水平降低(P<0.05);且青蒿素80 mg/L组的变化最显著(P<0.05)。
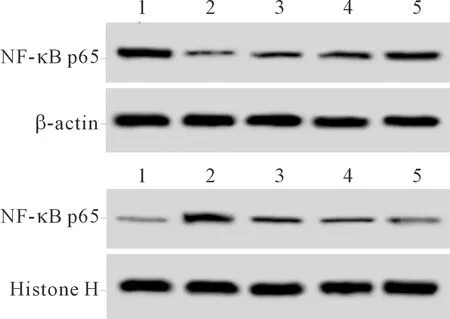
1:空白对照组;2:LPS组;3、4、5:青蒿素20、40、80 mg/L组

表4 5组巨噬细胞胞质和胞核中NF-κB p65表达水平的比较
3 讨论
炎症是机体重要的病理过程,巨噬细胞是机体炎症反应的重要参与者。LPS是巨噬细胞重要的激活因子,可以直接诱导巨噬细胞释放促炎因子[7]。TNF-α是炎症反应过程中的初级内源性炎症因子,IL-1β也是促炎因子,TNF-α、IL-1β被认为是炎症相关疾病进展的驱动因子[8]。本实验结果显示,LPS处理后的小鼠巨噬细胞TNF-α、IL-1β分泌量增加,说明成功构建了巨噬细胞炎症模型。
青蒿素是一种抗疟疾药物,并且也具有抗动脉粥样硬化、滑膜炎等炎性疾病损伤的作用,可以降低受损组织炎症因子水平[5,9-12]。本实验结果显示,青蒿素可以逆转LPS诱导的巨噬细胞炎症反应,表现为TNF-α、IL-1β分泌量下降,提示青蒿素具有抑制小鼠巨噬细胞炎症反应的作用。研究[13-14]发现,青蒿素可以减少Ox-LDL诱导的巨噬细胞中炎症因子基因的表达和转录,抑制NF-κB信号通路的激活。TLR4-NF-κB通路是目前研究较为透彻的与炎症有关的通路之一,TLR4是炎症反应的正向诱导因子,位于该通路的上游[15]。本实验结果证实青蒿素能够降低LPS诱导的小鼠巨噬细胞中TLR4蛋白表达,抑制NF-κB p65核转位,促进IκB-α蛋白表达,提示青蒿素抗炎机制可能与抑制巨噬细胞中TLR4-NF-κB通路激活,从而减少炎症因子释放有关。
NO具有重要的生理功能,其是在NO合酶催化作用下产生的小分子化合物。NO在人体内一方面作为信号传递分子参与生命体的活动,另一方面可以直接作用于染色体、细胞膜或其他细胞组分,诱导细胞损伤[16-18]。iNOS在炎症、肿瘤等病理条件下促进NO合成,而NO过多则会进一步诱导炎症反应[19-20]。本实验发现青蒿素处理可以下调LPS诱导的小鼠巨噬细胞中iNOS蛋白的表达,减少NO的合成,这可能是青蒿素抗巨噬细胞炎症反应的机制之一。
总之,本研究以巨噬细胞炎症因子分泌为主要切入点,证实了青蒿素可以抑制LPS诱导的小鼠巨噬细胞的炎症反应,并且初步证实青蒿素抗炎作用机制可能与抑制NF-κB信号通路激活及NO合成有关。
