以AMI为首发表现的原发性抗磷脂综合征一例
2020-08-02陈泽锋税星陈璘
陈泽锋 税星 陈璘
【摘要】抗磷脂综合征(APS)是一种自身免疫性疾病,其特征表现是抗磷脂抗体持续存在且合并血管血栓形成。该文报道一例以急性血栓形成致AMI为首发表现的APS患者的诊疗过程及随访情况。该患者无明显冠状动脉粥样硬化性心脏病(冠心病)危险因素,因发热查因入院,期间突发AMI,冠状动脉造影示右冠状动脉血栓形成,血栓抽吸后未植入支架。予抗凝抗血小板及抗风湿等治疗,10 d后复查冠状动脉造影未见明显异常。随访半年期间未再发血栓栓塞事件。该病例提示,对于冠状动脉造影以冠状动脉血栓形成为主且无明显冠心病危险因素的AMI患者,建议行APS筛查,以助于明确诊断及指导治疗。
【关键词】抗磷脂综合征;冠状动脉血栓栓塞;急性心肌梗死
【Abstract】Antiphospholipid syndrome (APS) is an autoimmune syndrome characterized by persistent presence of antiphospholipid antibodies complicated with vascular thrombosis. In this article, we reported the diagnosis, treatment and follow-up of one case of APS presenting with acute myocardial infarction (AMI). The patient did not have significant risk factors of coronary heart disease and was admitted to our hospital because of fever of unknown origin. During hospitalization, the patient suddenly developed AMI. Coronary angiography revealed thombosis in the right coronary artery, and no coronary stent was implanted after thrombus aspiration. After antithrombotic and antirheumatic therapy for 10 days, coronary angiography revealed no thombosis or stenosis in the right coronary artery. No arterial or venous thrombosis events were found during the follow-up period. This case suggests that screening of APS is recommended for AMI patients presenting with coronary arterial thrombosis while without significant risk factors of coronary heart disease, which contributes to confirming the diagnosis and offering guidance on treatment.
【Key words】Antiphospholipid syndrome;Coronary artery thrombosis;Acute myocardial infarction
抗磷脂綜合征(APS)是一种自身免疫性疾病,其特征表现是抗磷脂抗体持续存在且合并动静脉血栓形成。APS常继发于SLE等全身性自身免疫性疾病,也可为原发性[1]。原发性APS动脉血栓形成相比静脉血栓形成少见,其动脉血栓最常发生于脑血管,冠状动脉受累相对少见。国内协和医院107例原发性APS患者的数据显示,67.3%的患者发生静脉血栓事件,27.1%的患者发生动脉血栓事件,3.7%的患者发生心肌梗死[2]。因此,并发AMI的APS患者临床上容易漏诊病因。现将我科近期收治的一例以AMI为首发表现的原发性APS患者诊治过程及随访情况总结报告如下。
病例资料
一、主诉、病史及体格检查
患者男,49岁,因反复发热20 d于2019年8月23日入我院感染科。患者反复发热伴畏寒、寒战,最高体温40℃,偶伴咳嗽、少量白色痰,无胸闷、胸痛、气促,以“发热查因”收入院。入院后先后予头孢哌酮舒巴坦钠、美罗培南、阿奇霉素、利福平、多西环素抗感染治疗,后患者热峰较前明显下降,2019年8月30日开始无发热。2019年9月1日凌晨患者开始出现上腹部痛,进行性加重,伴有出汗。查床边心电图示Ⅱ、Ⅲ、aVF导联ST段抬高,考虑“急性下壁心肌梗死”转入心血管科CCU。无高血压病、糖尿病、高脂血症、吸烟、冠状动脉粥样硬化性心脏病(冠心病)家族史。
入院体格检查:体温36.5℃,脉搏95次/分,呼吸18次/分,血压106/69 mm Hg (1 mm Hg = 0.133 kPa)。神志清,对答切题。皮肤巩膜无黄染,颈静脉无怒张,心率95次/分,心律齐,未闻及病理性杂音。双肺呼吸音清,未闻及干湿性啰音。腹平软,无压痛,无反跳痛。肝脾肋下未触及,移动性浊音(-),肠鸣音4次/分。双下肢无水肿。
二、实验室检查及辅助检查
2019年8月23日感染科查尿常规、粪便常规、甲状腺功能、登革热病毒抗体抗原、肥达氏反应、外斐氏反应、血液疟原虫检查、抗中性粒细胞胞浆抗体、抗核抗体未见明显异常。血常规:白细胞8.49×109/L, 红细胞3.80 ×1012/L, 血红蛋白116.00 g/L,血小板153×109/L(血小板已复查,镜下发现血小板聚集)。CRP 186.6 mg/L、降钙素原0.294 ng/ml、ESR 75.00 mm/h。血脂:LDL-C 3.27 mmol/L、HDL-C 0.47 mmol/L。血浆凝血酶原时间 15.4 s,活化的部分凝血活酶时间56 s。心电图示窦性心动过速。心脏彩色多普勒超声(彩超):未见明显心脏形态学改变,左心室收缩功能正常,左心室舒张功能减退。2019年8月29日胸部CT:双肺下叶支气管轻度扩张并感染。正电子发射计算机断层显像/CT:双肺多发炎症,余未见明显异常。
三、诊治过程
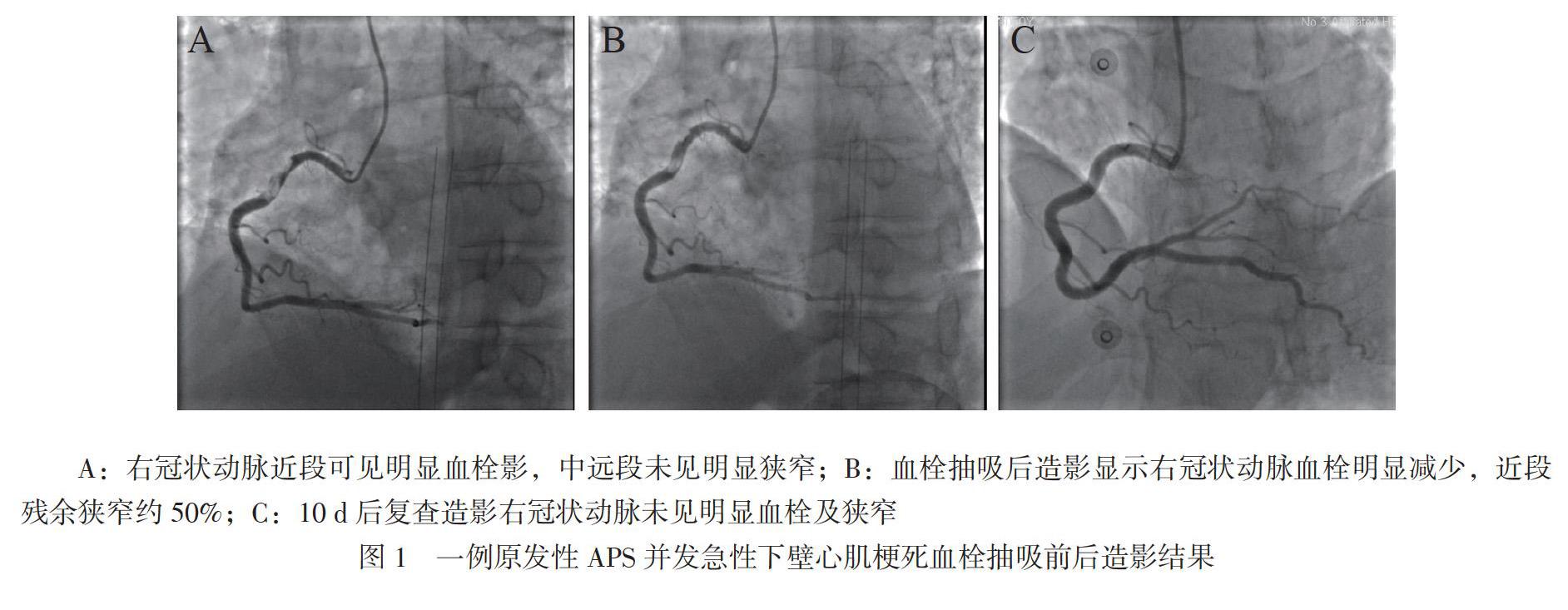
转入我科后行急诊冠状动脉造影示冠状动脉为右冠优势型,左主干未见狭窄,前降支未见明显狭窄;回旋支未见明显狭窄;右冠状动脉近段可见明显血栓影,中远段未见明显狭窄,见图1A。使用血栓抽吸导管反复抽吸后复查造影显示血栓明显减少,近段残余狭窄约50%,远端血流TIMI 3级,遂未植入支架,见图1B。术后症状缓解返CCU监护治疗,继续予美罗培南+多西环素+利福平抗感染,低分子肝素抗凝、阿司匹林+替格瑞洛+替罗非班抗板及阿托伐他汀调脂等处理,后加用比索洛尔及培哚普利改善心室重构,患者无再胸闷、胸痛、发热。考虑患者无高血压病、糖尿病、高脂血症、吸烟等危险因素,且冠状动脉以血栓形成为主,2019年9月1日查APS三项:狼疮抗凝物IgG 27 U/ml,狼疮抗凝物IgM 47 U/ml, 抗β2-糖蛋白1抗体 65 U/ml(参考值均为< 18 U/ml),抗心磷脂抗体阴性,蛋白S 22.5%(参考范围75% ~ 130%),蛋白C 88.2%(参考范围 70% ~ 140%)。2019年9月2日查CK-MB 7.70 ng/ml, 肌红蛋白 13.08 ng/ml, 肌钙蛋白I 33.72 ng/ml。风湿科会诊诊断原发性APS,建议羟氯喹及抗凝治疗,必要时丙种球蛋白调节免疫。2019年9月7日至9日予丙种球蛋白10 g冲击并加用羟氯喹0.2 g每日2次调节免疫。2019年9月10日复查冠状动脉造影未见明显异常,见图1C。2019年9月12日复查APS三项:狼疮抗凝物IgG 14 U/ml,狼疮抗凝物IgM 17 U/ml, 抗β2-糖蛋白1抗体 50 U/ml。予氯吡格雷抗血小板聚集及华法林抗凝及阿托伐他汀调脂、培哚普利及比索洛尔改善心肌梗死预后及羟氯喹抗风湿带药出院。后续规律门诊随访继续以上药物治疗(期间因监测不方便,华法林更换为利伐沙班),患者未再发血栓栓塞事件。2020年3月25日门诊复查APS三项均阳性:狼疮抗凝物IgG 95 U/ml,狼疮抗凝物IgM 45 U/ml, 抗β2-糖蛋白1抗体 22 U/ml。血浆凝血酶原时间13.0 s,活化的部分凝血活酶时间34.3 s。
讨论
APS诊断目前采用修订的Sapporo标准,即需要同时满足1项临床标准(明确的血管栓塞事件或病理性妊娠)及1项实验室检查标准(2次及以上相隔12周以上的1种或多种抗磷脂抗体阳性)[1]。本例患者首次造影示血栓形成为主,血栓抽吸后未植入支架,10 d后复查冠状动脉造影未见明显狭窄,考虑为冠状动脉血栓栓塞导致AMI。抗磷脂抗体包括狼疮抗凝物、抗β2-糖蛋白1抗体以及抗心磷脂抗体,本例患者狼疮抗凝物、抗β2-糖蛋白1抗体阳性。该患者急性冠状动脉血栓形成合并多次抗磷脂抗体阳性(> 2次,间隔12周以上),诊断APS明确,无SLE等继发性因素,考虑原发性APS。本例患者因发热查因入院,住院期间突发AMI而后确诊APS。其它风湿免疫相关指标阴性,抗磷脂抗体可能是由于该患者暴露于感染因子后出现[3]。抗磷脂抗体导致血栓栓塞事件的机制尚未完全明确,最可能的原因是抗磷脂抗体对正常抗凝系统以及纤溶系统的抑制作用。抗磷脂抗体可以抑制蛋白C和蛋白Z,降低蛋白S水平,干扰外源性凝血途径,抑制纤溶系统,增强内皮细胞、单核细胞以及血小板促凝活性,导致膜结合微粒释放[4]。本例患者多次查血常规时镜下均发现血小板聚集,蛋白S水平明显下降,考虑由于抗磷脂抗体所致。虽然既往有APS合并AMI相关病例报道,但鲜有提供治疗后短期复查冠状动脉造影结果及后续随访情况。
抗栓方面,第13届抗磷脂抗体国际会议发布的指南推荐有动脉血栓形成的APS患者接受华法林治疗(INR>3.0),或接受低剂量阿司匹林+标准强度华法林(INR 2.0 ~ 3.0)[5]。本例患者采用标准强度华法林+氯吡格雷进行心肌梗死的二级预防。后续因华法林需经常监测使用不便與患者沟通后更换为利伐沙班。但有证据表明,新型口服抗凝药如利伐沙班用于APS患者预防血栓效果不如华法林,因而不推荐其作为APS患者进行血栓形成例如心肌梗死二级预防的首选方案[6-8]。但因其不需实验室监测且出血风险可能更低,是否运用于APS患者心肌梗死一级预防抗凝治疗还需要更多证据。
抗风湿治疗方面,本例患者风湿科会诊建议使用羟氯喹抗风湿治疗。相关文献提示,SLE继发APS的患者,羟氯喹可能降低血栓形成风险,然而尚不清楚这是治疗SLE还是治疗APS的结果[9]。
调脂治疗方面,APS患者使用他汀类药物可能减少促血栓性标志物,因而可能有益[10-11]。并发心肌梗死的APS患者若造影提示动脉粥样硬化斑块形成或合并高脂血症,使用他汀类药物应无异议。对于本例因急性血栓形成而无明显动脉粥样硬化斑块患者,是否使用及是否长期使用他汀目前似乎并无明确推荐,需要进一步证据支持。
有研究提示,早发冠心病与免疫系统相关指标异常有关,对于早发冠心病患者需注意有无免疫系统疾病[12]。尽管APS并发AMI相对少见,临床上并不会常规对AMI患者进行APS相关检查。但对于造影以冠状动脉血栓形成为主且无高血压病、糖尿病、高脂血症、吸烟、冠心病家族史等冠心病危险因素的AMI患者,可能需要行APS筛查,以助于明确诊断及指导治疗。
参 考 文 献
[1] Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL,Cervera R, Derksen RH, DE Groot PG, Koike T, Meroni PL,Reber G, Shoenfeld Y, Tincani A, Vlachoyiannopoulos PG,A Krilis SA. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost,2006,4(2):295-306.
