脊髓CSF-1诱发小胶质细胞活化在长春新碱诱导神经病理性疼痛大鼠中的作用
2020-08-02付宝军姜静静黄玉琼林宗航李恒
付宝军 姜静静 黄玉琼 林宗航 李恒
【摘要】目的 探討脊髓集落刺激因子1(CSF-1)诱发小胶质细胞活化在长春新碱诱导神经病理性疼痛大鼠中的作用。方法 采用随机数表法将30只健康雄性SD大鼠分为3组(每组10只):对照组(Control组)、化学治疗痛组(CINP组)、化学治疗痛+ CSF-1中和抗体组(CINP+anti组)。化学治疗药物诱导的神经病理性疼痛动物模型采用隔日腹腔注射长春新碱125 μg/kg(共计4次)的方法建立,CINP+anti组在CINP组的给药基础上加予CSF-1中和抗体。于首次注射长春新碱前及注射后1、3、5、7 d采用机械缩足反射阈值(MWT)和热缩足反射潜伏期(TWL)评价大鼠机械痛敏和热痛敏;采用蛋白免疫印迹法检测脊髓CSF-1以及脊髓小胶质细胞标志物离子化钙结合适配分子1(Iba1)的表达情况;采用逆转录PCR法检测脊髓CSF-1 mRNA和Iba1 mRNA的表达水平。结果 与Control组比较,CINP组大鼠在首次注射长春新碱后3、5、7 d的MWT和TWL更低(P均< 0.01);与CINP组比较,CINP+anti组首次注射长春新碱后5、7 d的MWT和TWL更高(P均< 0.01)。与Control组比较,CINP组脊髓CSF-1、Iba1表达上调(P均< 0.01);与CINP组比较,CINP+anti组CSF-1、Iba1表达下调(P均< 0.05)。与Control组比较,CINP组脊髓Iba1 mRNA表达上调(P < 0.01);与CINP组比较,CINP+anti组脊髓Iba1 mRNA表达下调(P < 0.01)。结论 长春新碱诱导神经病理性疼痛,其机制可能与大鼠脊髓CSF-1活化脊髓小胶质细胞有关。
【关键词】长春新碱;神经病理性疼痛;小胶质细胞; 集落刺激因子1
【Abstract】Objective To investigate the role of spinal colony-stimulating factor 1 (CSF-1)-induced microglia activation in rat models with neuropathic pain induced by vincristine. Methods Thirty healthy male SD rats were divided into 3 groups by random number table method (10 rats in each group): control group (control group), chemotherapy-induced neuropathic pain group (CINP group) and chemotherapy-induced neuropathic pain+CSF-1 neutralizing antibody group (CINP+anti group). The CINP rat models were established by intraperitoneal administration of vincristine 125μg/kg on alternate days for 4 times. In the CINP+anti group, CSF-1 neutralizing antibody was supplemented. Mechanical allodynia and heat hyperalgesia were evaluated by mechanical withdrawal threshold (MWT) and thermal withdrawal latency (TWL) before and 1-, 3-, 5- and 7-d after initial administration of vincristine, respectively. The expression levels of CSF-1 and ionized calcium-binding adapter molecule 1 (Iba1) proteins were detected by Western blot. The expression levels of CSF-1 and Iba1 mRNA were measured by RT-PCR. Results Compared with the control group, the MWT and TWL at 3-, 5- and 7-d after vincristine administration were significantly decreased in the CINP group (both P < 0.01). The MWT and TWL at 5- and 7-d after vincristine administration in the CINP+anti group were significantly higher than those in the CINP group (both P < 0.01). Compared with the control group, the expression levels of CSF-1 and Iba1 in the spinal cord were significantly up-regulated in the CINP group (both P < 0.01). Compared with the CINP group, the expression levels of CSF-1 and Iba1 in the spinal cord were significantly down-regulated in the CINP+anti group (both P < 0.05). Compared with the control group, the expression of Iba1 mRNA was significantly up-regulated in the CINP group (P < 0.01). Compared with the CINP group, the expression of Iba1 mRNA was remarkably down-regulated in the CINP+anti group (P < 0.01). Conclusion The mechanism of neuropathic pain induced by vincristine may be related to the activation of spinal microglia induced by CSF-1 in rats.
【Key words】Vincristine;Neuropathic pain;Microglia;Colony-stimulating factor 1
长春新碱是一种常用化学治疗药物,被用于治疗各种癌症,特别是急性淋巴细胞白血病、霍奇金淋巴瘤和非霍奇金淋巴瘤。长春新碱与其他化学治疗药物一样会伴不良反应,其中化学治疗诱导的神经病理性疼痛(CINP)最为常见,这是一种剂量限制性毒性[1-2]。目前用于化学治疗引起CINP的治疗药物仅限于抗惊厥药、阿片类药物和三环抗抑郁药,但这些药物的应用往往因其不可被接受的不良反应而受限[3-4]。因此阐明CINP发生机制,对于探索药物作用靶点、开发有效的治疗药物具有重大现实意义。随着对疼痛机制研究的不断深入,细胞因子尤其集落刺激因子1(CSF-1)在CINP中的作用得到越来越多研究者关注[5-7]。近期的研究证实,在脊神经结扎、背部痛、关节炎疼痛模型中,CSF-1在慢性疼痛信息调制中扮演重要角色,但是其在化学治疗药物诱导CINP中的作用未见报道[8-10]。本研究采用长春新碱诱导CINP大鼠模型,探讨长春新碱诱导机械痛敏和热痛敏的可能机制。
材料与方法
一、材 料
实验动物为清洁级健康雄性Sprague Dawley(SD)大鼠30只,体质量200~230 g,由清远市人民医院实验动物中心提供[生产许可证号:SYXK(粤)2019-0206]。注射用硫酸长春新碱(浙江海正药业股份有限公司),兔抗大鼠CSF-1单克隆抗体、兔抗大鼠离子化钙结合适配分子1(Iba1)单克隆抗体(Abcam公司,美国),PCR试剂盒(武汉博士德生物科技有限公司),von Frey细丝(Stoelting公司),热痛刺激仪(Stoelting公司),CSF-1中和抗体(Abcam公司),TRIzol? reagen(Invitrogen公司),焦碳酸二乙酯、BeyoR TTM cDNA 逆转录试剂盒(上海碧云天生物技术有限公司南通分公司),实验用PCR引物(天跟生化科技北京有限公司)。本实验符合动物实验的伦理要求。
二、方 法
1.动物分组与处理
将30只大鼠适应饲养1周后,将其按随机数表法分为3组各10只:对照组(Control组)、化学治疗痛组(CINP组)、化学治疗痛+CSF-1中和抗体组(CINP+anti组)。整个实验过程中动物自由摄食和饮水,分笼单独饲养, 室温(22±1)℃, 光照周期12 h(7:00 ~ 9:00 pm 光照,19:00 ~ 7:00 黑暗)。
2. 鞘内置管
参照Yaksh等[11]报道的方法对大鼠实施鞘内置管, 置管成功后观察其肢体运动情况, 有运动功能障碍大鼠将被剔除后续实验,经导管注射利多卡因后30 s内出现双后肢麻痹现象即确认为导管位置正确,置管5 d后测试大鼠无感觉及运动异常即可用于实验 。
3.实验动物模型建立及给药方法
对大鼠进行隔日腹腔注射长春新碱,注射量为125 μg/kg(共计 4 次),注射当日视为 1 d,通过检测大鼠痛阈值变化确定化学治疗药物诱导的CINP模型建立成功。CINP+anti组从1 d开始连续7 d于行为学测试前30 min鞘内给予CSF-1中和抗体(10 μg/10 μl),每次给药后用10 μl生理盐水冲洗聚乙烯管。
4. 行为学的测定
参照Chaplan 等[12]的方法测定机械缩足反射阈值(MWT),以Up-down法推测阈值,并在阈值上下各刺激5次,用中位数法计算50%的反应阈值。参照Hargreaves等[13]的方法测定热缩足反射潜伏期(TWL), 为防止组织损伤设定自动切断时间为20 s。在整个实验过程中热刺激强度保持一致,测定5次TWL(间隔3 min)取平均值。在给药前、给药后1、3、5、7 d分别采用MWT和TWL评价大鼠机械痛敏和热痛敏。
5. 蛋白免疫印迹法检测脊髓CSF-1、Iba1蛋白
采用戊巴比妥钠50 mg/kg麻醉大鼠后处死,取出其脊髓L4 ~ 5节段进行匀浆(加入裂解液),于4℃下12 000转/分离心5 min,并进行二辛可宁酸法(BCA)蛋白定量,每份样品各取20 μg蛋白质。配置分离胶和浓缩胶,当溴酚蓝染料前端电泳至分离胶末端处时即停止电泳,转膜后封闭2 h, 加入β-actin(兔抗大鼠,1∶2000)、CSF-1(兔抗大鼠,1∶1000)、 Iba1(兔抗大鼠,1∶1000)一抗,4℃孵育过夜后洗膜3次(每次10 min)。加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG(1∶3000)室温孵育后洗膜、显色、曝光、显影,采用Image J软件检测目的蛋白条带及β-actin蛋白条带的光密度值,以目的蛋白条带灰度值/β-actin蛋白条带灰度值作为目的蛋白表达量。将3张以上相同趋势灰度值取平均值记为本次实验结果。
6. 逆转录-PCR测定脊髓CSF-1 mRNA、Iba1 mRNA 注射长春新碱后7 d,每组各取3只大鼠实施安乐死后进行检查。用TRIzol? reagent提取大鼠L4 ~ 6脊髓总RNA,逆转录为互补DNA。用ΔΔCT 法来测定CSF-1 mRNA、CSF-1受体mRNA、Iba1 mRNA含量。引物合成为:CSF-1上游引物:5-TGCTAAGTGCTCTAGCCGAG-3;下游引物5- CCCCCAACAGTCAGCAAGAC-3。Iba1上游引物:5-CCATGACCTTCCAAGAGAATGC-3;下游引物:5-ACCGGCTTGTGCTGTAGTC。β-actin上游引物:5-CGTTGACATCCGTAAAGACCTC-3;下游引物:5-TAGGAGCCAGGGCAGTAATCT-3。擴增条件:94℃预变性5 min、94℃ 30 s、54℃ 30 s、72℃ 20 s,共45个循环,72℃延伸10 min。计算目的基因表达灰度/β-actin灰度值作为目的基因表达量。
三、统计学处理
采用GraphPad Prism 7.0软件进行统计学处理,实验数据均以表示,行为学数据结果采用重复测量方差分析,同一时间点多重比较(Control组与CINP组;CINP组与CINP+anti组)采用Sidak法;蛋白免疫印迹、逆转录PCR数据结果采用单因素方差分析,多重比较(Control组与CINP组;CINP组与CINP+anti组)采用Tukey法。P < 0.05为差异有统计学意义。
结果
一、制模情况
本实验中的大鼠首次给药后3 d 的MWT和TWL开始明显降低,并出现跛行、抬足、舔舐足底增多以及自发嘶叫等疼痛行为学变化,直到本实验观察结束,表明CINP模型制备成功,无被剔除的大鼠。
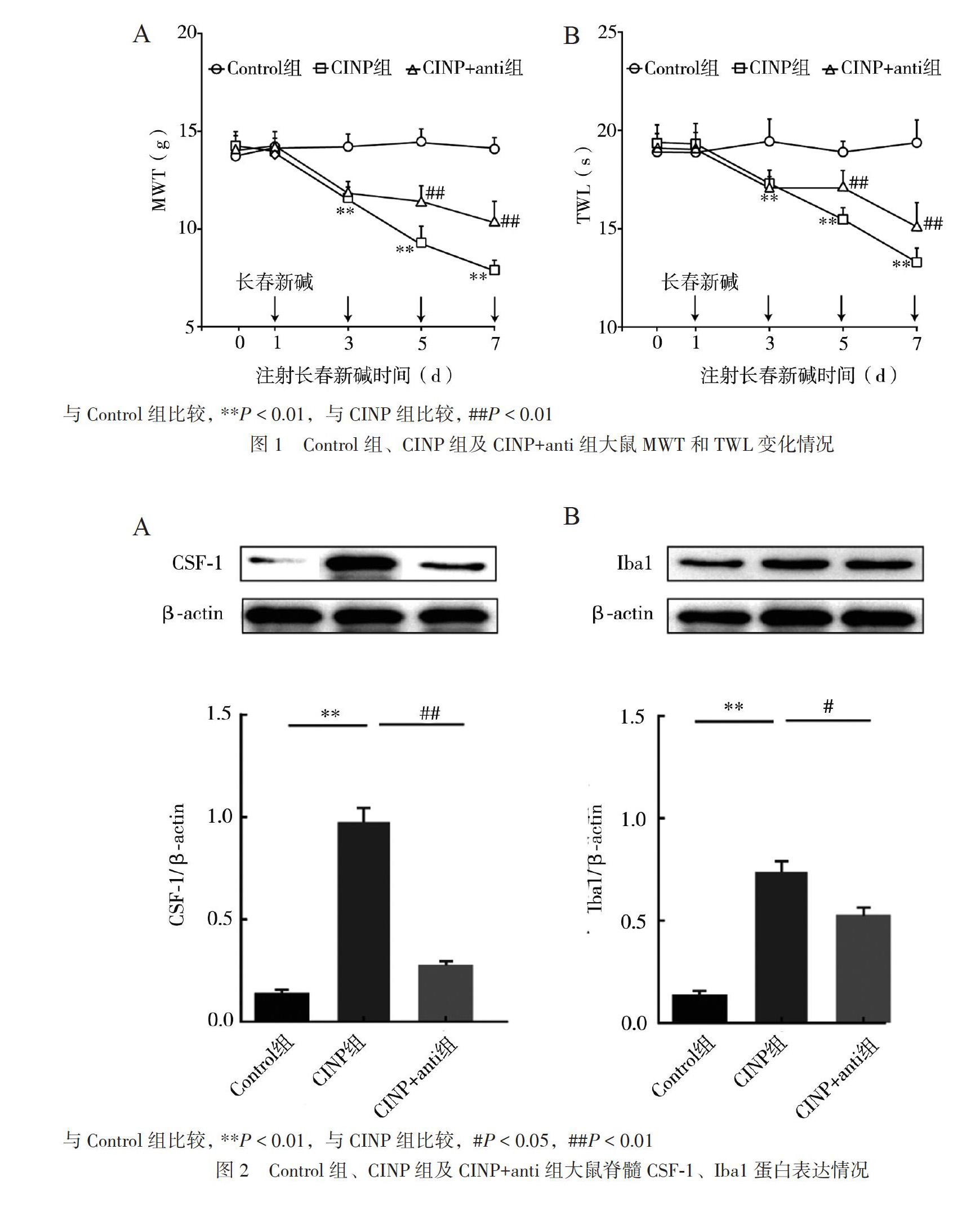
二、Control组、CINP组及CINP+anti组大鼠 MWT和TWL 变化情况
重复测量资料方差分析结果:时间和分组之间存在交互效应[MWT(F = 27.11,P < 0.01)和TWL(F = 28.61,P < 0.01)],故分析简单效应与Control组比较,CINP组大鼠在3、5、7 d, MWT[3 d:(12.6±0.5)g,P < 0.01;5 d:(9.3±0.8)g,P < 0.01;7 d:(8.1±0.7)g,P < 0.01)和TWL[3 d: (17.1±0.6)s,P < 0.01;5 d:(15.5±0.6)s,P < 0.01;7 d:(12.9±0.7)s,P < 0.01]均降低,同时大鼠跛行、抬足、舔舐足底、自发嘶叫明显增加。与CINP组比较,CINP+anti组大鼠在5、7 d MWT[5 d:(11.7±1.1)g,P < 0.01;7 d:(11.5±0.5)g,P < 0.01]和TWL[5 d:(17.2±0.6)s,P < 0.01;7 d:(14.8±0.5)s,P < 0.01]均升高;同时大鼠跛行、抬足、舔舐足底、自发嘶叫明显减少,见图1。
三、Control组、CINP组及CINP+anti组大鼠大鼠脊髓CSF-1和Iba1蛋白表达情况各组大鼠的CSF-1蛋白(F = 283.20, P < 0.01)和Iba1蛋白(F = 21.25, P < 0.01)表达差异均有统计学意义。与Control组比较,CINP组脊髓CSF-1蛋白(0.85±0.10)表达上调(P < 0.01);与CINP组相比,CINP+anti组脊髓CSF-1蛋白(0.25±0.05)表达下调(P < 0.01),见图2A。与Control组相比,CINP组脊髓Iba1蛋白(0.75± 0.12)表达上调(P < 0.01);与CINP组相比,CINP+anti组脊髓Iba1蛋白(0.53±0.06)表达下调(P = 0.012),见图2B。
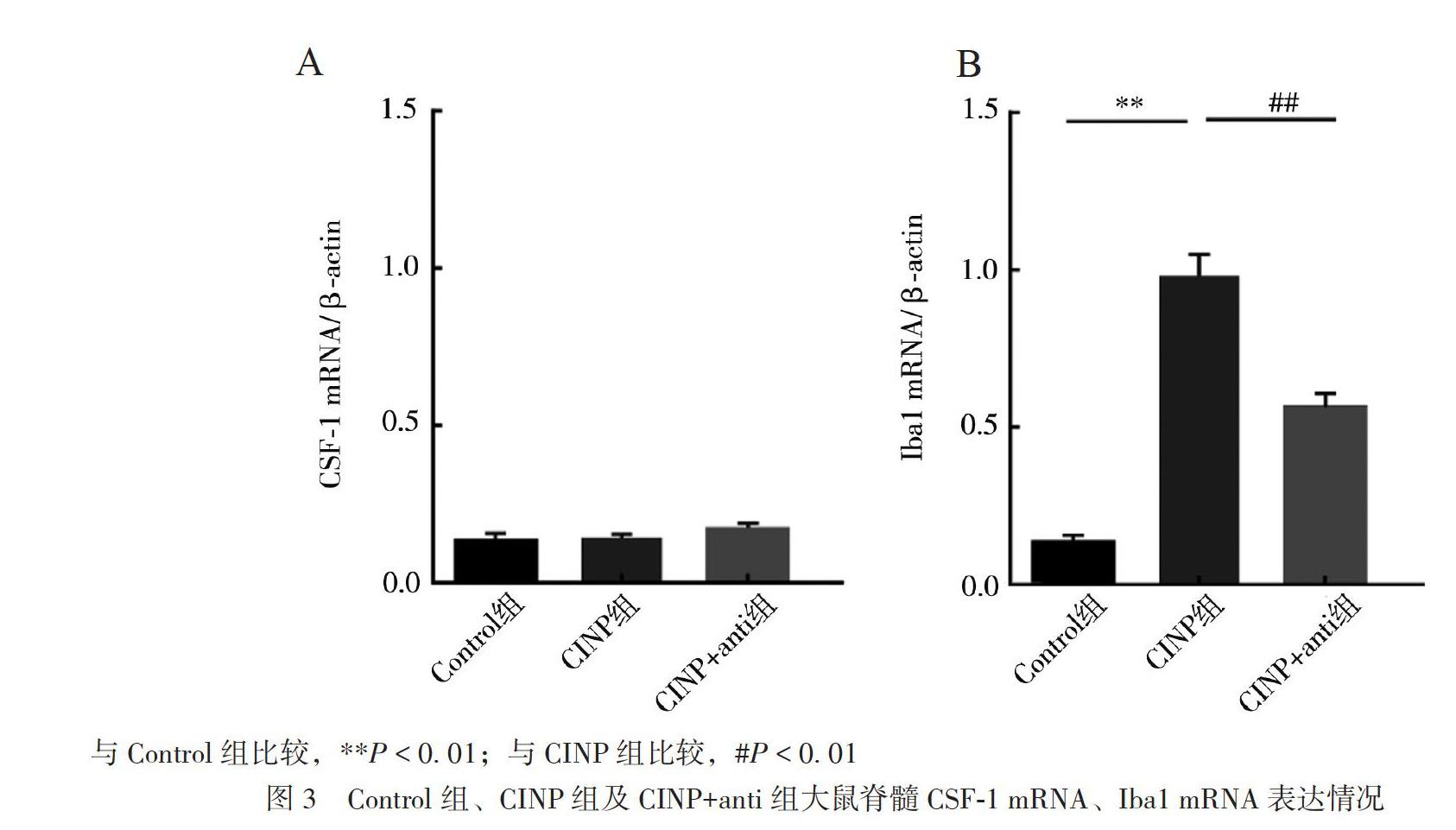
三、各组大鼠脊髓CSF-1、Iba1 mRNA表达情况
各组脊髓CSF-1mRNA表达差异无统计学意义(F = 1.71,P = 0.256),見图3A。各组脊髓Iba1 mRNA表达差异有统计学意义(F = 108.50,P< 0.01),与Control组比较,CINP组脊髓Iba1 mRNA表达(0.95±0.09)上调(P < 0.01);与CINP组比较,CINP+anti组脊髓Iba1 mRNA表达(0.63± 0.06)下调(P < 0.01),见图3B。
讨论
本研究采用许爱军等[14]介绍的方法制备大鼠CINP模型,该模型由于可操作性强、重复性好、与临床CINP特征有相似之处等优点,已被广泛应用于验证药物和探讨机制的动物实验中。本实验的CINP模型制备成功。
CSF-1是一种细胞因子,它通过与Ⅲ型受体酪氨酸激酶偶联CSF-1受体结合来发挥作用,在调节单核细胞、巨噬细胞和小胶质细胞存活、增殖和分化中发挥重要作用[15]。越来越多证据显示CSF-1在CINP中发挥重要作用[5-6]。我们的研究结果表明,与Control组比较,CINP组大鼠脊髓CSF-1蛋白表达上调,但两者脊髓CSF-1 mRNA 表达差异无统计学意义,提示可能存在其他部位CSF-1蛋白向脊髓转运的情况,本课题组(2019年)进行的前期实验显示,在构建CINP模型前结扎L4 ~ 5背根,脊髓CSF-1降低与正常对照组无差异,也进一步证实背根节CSF-1向脊髓转运。另有研究显示缺血痛模型建立后6 h脊髓背角活化的星形胶质细胞产生CSF-1,相反,星形胶质细胞代谢抑制剂氟代柠檬酸显著抑制缺血6 h后CSF-1上调,其CSF-1产生部位和我们实验的差异可能与使用模型以及动物种属不同有关[16]。既然存在CSF-1向脊髓转运,那么CSF-1如何发挥作用?最近的研究表明,脊神经结扎大鼠背根节,可使初级感觉神经元中CSF-1促进脊髓小胶质细胞的激活,以及促发促伤害性基因[8]。Iba1是小胶质细胞的标志物,是一个17 kDa的EF手性蛋白,在小胶质细胞的活化过程中表达升高。在本研究中,予大鼠腹腔注射长春新碱后,CINP组脊髓Iba1蛋白、Iba1 mRNA均升高,与CINP组相比,CINP+anti组脊髓Iba1蛋白、Iba1 mRNA均降低,这提示脊髓CSF-1蛋白可能活化了脊髓背角小胶质细胞介导CINP发生。
综上所述,长春新碱诱导的CINP,其机制可能与脊髓CSF-1激活小胶质细胞有关。然而在本实验中脊髓CSF-1蛋白表达升高是否源于背根节或其他部位的转运还有待今后的实验进一步证实。
参 考 文 献
[1] 梁承华,郑晓明, 张亚琴, 雷普润, 蔡梓凯, 魏波. 含奥沙利铂化学治疗方案对Ⅱ期结直肠癌患者肝纤维化的影响. 新医学, 2019, 50(6):427-431
[2] Brewer JR, Morrison G, Dolan ME, Fleming GF. Chemotherapy-induced peripheral neuropathy: current status and progress. Gynecol Oncol,2016, 140(1):176-183.
[3] Busse JW, Wang L, Kamaleldin M, Craigie S, Riva JJ, Montoya L, Mulla SM, Lopes LC, Vogel N, Chen E, Kirmayr K, Oliveria KD, Olivieri L, Kaushal A, Chaparro LE, Oyberman I, Agarwal A, Couban R, Tsoi L, Lam T, Vandvik PO, Hsu S, Bala MM, Schandelmaier T, Scheidecker A, Ebrahim S, Ashoorion V, Rehman Y, Hong PJ, Ross S, Johnston BC, Kunz R, Sun X, Buckley N, Sessler DI, Guyatt GH. Opioids for chronic noncancer pain: a systematic review and meta-analysis. JAMA, 2018, 320(23):2448-2460.
[4] Fornasari D. Pharmacotherapy for neuropathic pain: a review. Pain Ther, 2017, 6(Suppl 1):25-33.
[5] Zhou LJ, Peng JY, Xu YN, Zeng WJ, Zhang J, Wei X, Mai CL, Lin ZJ, Liu Y, Murugan M, Eyo UB, Umpierre AD, Xin WJ, Chen T, Li MG, Wang H, Richardson JR, Tan Z, Liu XG, Wu LJ. Microglia are indispensable for synaptic plasticity in the spinal dorsal horn and chronic pain. Cell Rep, 2019, 27 (13):3844-3859.e6.
[6] Zhang F, Wang YY, Liu Y, Han H, Zhang DD, Fan XZZ, Du XN, Gamper N, Zhang HL. Transcriptional regulation of voltage-gated sodium channels contributes to GM-CSF-induced pain. J Neurosci, 2019, 39(26):5222-5233.
[7] Boakye PA, Rancic V, Whitlock KH, Simmons D, Longo FM, Ballanyi K, Smith PA. Receptor dependence of BDNF actions in superficial dorsal horn: relation to central sensitization and actions of macrophage colony stimulating factor 1. J Neuro-physiol,2019, 121(6):2308-2322.
[8] Guan ZH, Kuhn JA, Wang XD, Colquitt B, Solorzano C, Vaman S, Guan AK, Reinsch ZE, Braz J, Devor M, Werner SLA, Lanier LL, Lomvardas S, Basbaum A. Injured sensory neuron-derived CSF1 induces microglial proliferation and DAP12-dependent pain. Nat Neurosci, 2016, 19(1):94-101.
[9] Yang G, Chen LH, Gao ZH, Wang Y. Implication of microglia activation and CSF-1/CSF-1Rpathway in lumbar disc degeneration-related back pain. Mol Pain, 2018, 14:1744806918811238.
[10] Saleh R, Lee MC, Khiew SH, Louis C, Fleetwood AJ, Achuthan A, Forster I, Cook AD, Hamilton JA. CSF-1 in inflammatory and arthritic pain development. J Immunol, 2018, 201(7):2042-2053.
[11] Yaksh TL, Rudy TA. Chronic catheterization of the spinal subarachnoid space. Physiol Behav, 1976, 17(6):1031-1036.
[12] Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Method, 1994, 53(1):55-63.
[13] Hargreaves K, Dubner R, Brown F, Flores C, Joris J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain, 1988, 32(1):77-88.
[14] 許爱军, 曹菲, 田玉科. 长春新碱诱发外周神经病理性疼痛模型的建立. 中国疼痛医学杂志, 2008, 21(9): 647-651.
[15] Liu J, Ying YY, Wang S, Li JY, Xu JQ, Lv PP, Chen JH, Zhou CY, Liu YF, Wu YQ, Huang Y, Chen Y, Chen LF, Tu SJ, Zhao W, Yang M, Hu YJ, Zhang RJ, Zhang D. The effects and mechanisms of GM-CSF on endometrial regeneration. Cytokine, 2020, 125:154850.
[16] Tang Y, Liu L, Xu D, Zhang WS, Zhang Y, Zhou JS, Huang W. Interaction between astrocytic colony stimulating factor and its receptor on microglia mediates central sensitization and behavioral hypersensitivity in chronic post ischemic pain model. Brain Behav Immun, 2018, 68:248-260.
(收稿日期:2020-01-20)
(本文编辑:洪悦民)
