程序性死亡配体1在接受抗癌治疗的非小细胞肺癌患者中的表达变化
2020-07-31张瑶陈丽展吴朔张艳欧阳海峰
张瑶 陈丽展 吴朔 张艳 欧阳海峰△
(1.西安国际医学中心医院胸科医院呼吸内科,陕西 西安 710000;2.空军军医大学西京医院呼吸内科,陕西 西安 710000)
致癌表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)在肺癌的靶向治疗方面已显示出有较好的前景[1-2],但肺癌仍然是全球癌症死亡的主要原因,每年约有160万人死于肺癌[3]。免疫检查点已成为非小细胞肺癌(NSCLC)及许多恶性肿瘤免疫治疗的新靶点[4]。此外,靶向程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)的单克隆抗体,如纳武单抗、派姆单抗等,已在临床试验中发挥了重要的抗肿瘤作用[5-6]。关于PD-L1表达与NSCLC患者存活之间的关系已有报告[7-8],但对于NSCLC患者在接受抗癌治疗后的PD-L1表达变化研究却较为少见。本研究旨在调查PD-L1在接受抗癌治疗的NSCLC患者组织中的表达变化,以期为NSCLC患者的免疫治疗提供更多的理论基础。
1 资料和方法
1.1样本收集 收集2015年1月至2018年12月于空军军医大学西京医院呼吸内科行病理学确诊为NSCLC的76例患者的肿瘤组织,其中男46例,女30例,年龄39~89岁,中位年龄为67岁。本研究获得我院伦理委员会批准和患者知情同意。患者接受的抗癌治疗有全身治疗和非全身治疗,其中,全身治疗包括细胞毒性化疗、放化疗、EGFR酪氨酸激酶抑制剂(EGFR-TKI)和间变淋巴瘤激酶基因(ALK)抑制剂,非全身治疗包括手术切除(无辅助化疗),放射治疗和切除。通过ARMS技术联合Taqman探针检测EGFR突变[9-10]。利用免疫组化分析PD-L1表达的变化,仅接受免疫检查点抑制剂或姑息性放疗的患者被排除在外。
1.2PD-L1表达的免疫组化分析 所有肿瘤组织标本均经福尔马林固定,石蜡包埋,4 μm厚度切片。切片经过常规脱蜡和水化后,用0.3%H2O2的甲醇溶液处理30 min以封闭内源性过氧化物酶活性,在Tris-EDTA缓冲液(pH9.0)中在95 ℃下高压灭菌40 min抗原修复,磷酸盐缓冲液(PBS)冲洗3次,在4 ℃下与兔抗人PD-L1单克隆抗体(1∶1 000稀释,美国Spring Bioscience公司)一起温育过夜,PBS冲洗3次。在室温下加入过氧化物酶标记的兔聚合物抗体(EnVision,K4002,美国Dako公司)孵育30 min,然后在室温下用3,3’二氨基联苯胺四盐酸盐(K3468,美国Dako公司)孵育4 min,再用PBS冲洗,DAB显色,Mayer苏木精溶液轻度复染。由两位病理学家独立评估PD-L1的表达,为了获得合格的标本,评估了标本中的巨噬细胞作为PD-L1免疫染色的内部对照实验。根据之前报道,如果标本中有超过1%的肿瘤细胞被染色,则被考虑为PD-L1阳性表达,如果标本中有超过50%的肿瘤细胞被染色,则被考虑为PD-L1强阳性表达[11]。因此,我们根据PD-L1染色的肿瘤细胞百分比确定了两个组:A组(阴性):0%;B组(阳性):≥1%。
1.3统计学方法 采用SPSS20.0进行数据分析,采用Kaplan-Meier法对可能影响患者预后的指标进行单因素分析并绘制生存曲线。通过Log-rank时序检验比较两组生存曲线的差异。运用Cox风险回归模型进行多因素分析,使用Wilcoxon符号秩检验比较了患者治疗前和治疗后PD-L1表达的分布。P<0.05为差异有统计学意义。
2 结 果
2.1患者的一般资料比较 A组EGFR野生突变的人数显著低于B组(P=0.039),但两组在年龄、性别、吸烟状况、组织学及诊断阶段等方面没有显著差异(P>0.05)。见表1。
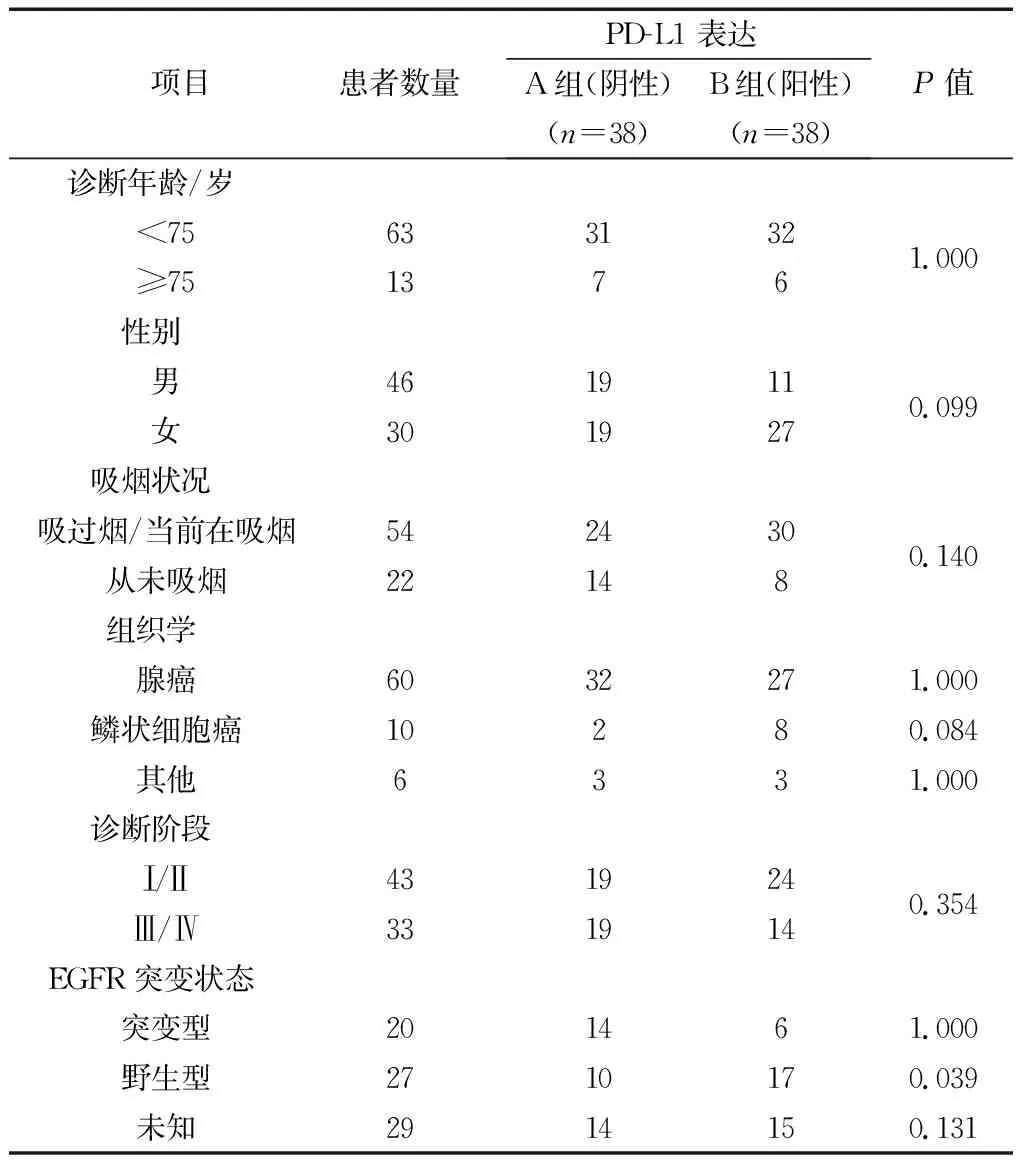
表1 两组患者的临床特征比较
2.2PD-L1在治疗前后表达的差异 76例患者在进行抗癌治疗前,有38例患者的肿瘤细胞具有阳性PD-L1染色(B组,图1),占50%。
2.3患者治疗情况 在本研究中,46例患者接受了全身治疗,其中细胞毒性化疗(包括辅助化疗)者25例、放化疗者8例、细胞毒性化疗和EGFR-TKI者10例、EGFR-TKI者3例、ALK抑制剂者0例;30例患者接受了非全身性抗癌治疗,其中手术切除(无辅助化疗)者27例、放射治疗者2例、切除者1例。进行抗癌治疗后,有36例患者的肿瘤细胞具有阳性PD-L1染色,占47%,这与治疗前相似(P=0.706)。与此同时,我们在15例(20%)患者的肿瘤组织标本中观察到PD-L1的表达显著增加,在18例(24%)患者的肿瘤组织标本中观察到PD-L1的表达显著减少(图2)。在43例接受细胞毒性化疗的患者中,有8例(19%)患者显示PD-L1表达显著增加,8例(19%)患者显示PD-L1表达显著减少。在使用EGFR-TKI治疗的13例患者中,有5例(38%)患者显示PD-L1表达显著增加,1例(8%)患者显示出PD-L1表达显著减少。在30例接受了非全身性抗癌治疗的患者中,只有2例(7%)患者显示出PD-L1表达显著增加,9例(30%)患者显示出PD-L1表达显著减少。与接受非全身性抗癌治疗患者相比,接受EGFR-TKI治疗患者的PD-L1表达显著增加(P=0.031)。
2.4两组预后比较 在患有Ⅰ期或Ⅱ期癌症的患者中,诊断的随访时间中位数为45.6个月。B组患者的生存率低于A组(B组和A组的中位数分别为75.6个月,103.1个月,P=0.065)。见图3。
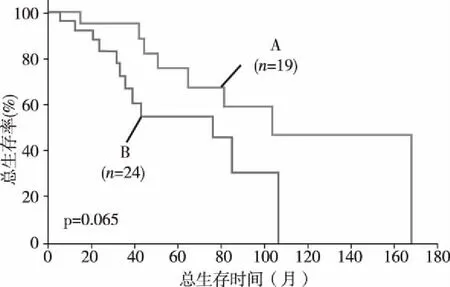
注:A.阴性表达;B.阳性表达。图3 两组Kaplan-Meier曲线分析结果
3 讨 论
PD-L1,也称B7-H1或CD274,是B7超家族中重要的成员,是Ⅰ型跨膜糖蛋白,广泛表达于多种免疫细胞表面,如T细胞、B细胞、巨噬细胞和树突状细胞,除此之外,PD-L1还在多种癌组织中过表达;在病理状态下,PD-L1与其受体 PD-1 结合,可显著抑制T细胞的增殖和活化,使肿瘤发生免疫逃逸。
本研究中通过免疫组化分析发现,43%的NSCLC患者在接受抗癌治疗后,肿瘤组织标本中的PD-L1的表达发生变化,且与非全身治疗的患者相比,用EGFR-TKI治疗的患者的PD-L1表达显著增加,同时,预后分析显示,PD-L1阳性表达和阴性表达对患者的预后没有显著性影响。程小珍等报道,肝癌患者在经过治疗之后,PD-L1表达显著下降。J·F·Gainor等[13]回顾性地分析了EGFR突变的NSCLC患者在接受EGFR-TKI治疗前和治疗后活组织检查样本的PD-L1表达状态,发现15%的患者在EGFR-TKI治疗前显示肿瘤细胞PD-L1表达,而25%的患者在EGFR-TKI治疗后显示肿瘤细胞PD-L1表达(P=0.181)。潘贝晶等[14]通过研究142例女性三音性乳腺癌患者的资料,发现肿瘤细胞的PD-L1表达与OS、PFS没有明显的相关性。以上结果均与本研究结果一致,并支持EGFR-TKI治疗可能增加EGFR突变的NSCLC患者中PD-L1表达的假设。笔者推测,EGFR-T790M突变,HGF分泌、MET扩增、IGF-1R活化、HER2扩增、EMT、PTEN缺失等机制促使患者对EGFR-TKI治疗产生耐药,而EGFR-TKI耐药细胞通则进一步促进PD-L1的表达,然而,目前对于耐药细胞促进PD-L1表达的机制尚不明确。
综上所述,在接受抗癌治疗后,部分NSCLC患者的肿瘤组织标本的PD-L1的表达会发生变化,且EGFR-TKI治疗似乎促进了NSCLC患者的PD-L1表达。

