多期相CT对乳头状肾细胞癌亚型的鉴别诊断
2020-07-25周红俐陈世孝任勇张福洲孙昊金征宇
周红俐,陈世孝,任勇,张福洲,孙昊,金征宇
乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是第二常见的肾细胞癌亚型,发病率约占10%~20%[1]。基于组织学特性,PRCC分为Ⅰ型和Ⅱ型,不同亚型的生物学差异决定了其不同的治疗方案及临床预后[2],术前通过影像学检查对亚型进行准确判断意义重大。CT是目前公认的肾癌亚型鉴别及分期评价的参考标准,其能否进一步区分PRCC亚型的研究较少。本文回顾性分析了33例经病理证实的PRCC的临床及影像资料,旨在探讨多期相CT对PRCC亚型的鉴别价值,为PRCC的治疗和预后评估提供更为准确的信息。
材料与方法
1.临床资料
回顾性分析2014年10月-2018年5月在北京协和医院(27例)和南充市中心医院(6例)泌尿外科诊治的PRCC患者的病例资料,患者在获取病理结果前均接受CT平扫及增强三期扫描。33例PRCC患者中,男24例、女9例,平均年龄(52.67±14.55)岁,包括Ⅰ型11例、Ⅱ型22例。18例患者通过体检发现;7例患者因“腰部疼痛、血尿、双下肢水肿、恶心呕吐、尿蛋白阳性”入院,其中1例为直肠癌术后出现无痛性肉眼血尿;1例触及左侧肋弓下包块入院;4例患者分别因肾上腺瘤、局灶节段性肾小球硬化、脑梗塞、前列腺癌行腹部检查时偶然发现;3例为左肾占位复查增大、进一步增强检查发现。2例患者因存在肾外恶性肿瘤病史被误诊为转移瘤,1例为子宫肌瘤术后1年同时发现子宫多发占位及肾占位,另1例为前列腺癌放疗后、内分泌治疗中新发现的右肾占位伴有右肾静脉及下腔静脉癌栓形成。
2.检查方法
所有患者均行CT泌尿系成像,采用Siemens Somatom Definition Flash 双源双能量CT扫描仪。患者取仰卧位,行腹部平扫及多期相增强扫描,扫描范围从膈顶至骨盆上缘。管电压120~140 kVp,开启实时动态曝光剂量调节CARE Dose 4D,准直128×0.6 mm,球管旋转时间 0.28~0.5 s,Kernel值B30f medium smooth,螺距0.6~0.9,重建层厚及层间距5~8 mm。增强扫描采用双筒高压注射器以3.0~4.0 mL/s的流率注入非离子型对比剂(碘帕醇370 mg I/mL,上海博莱科信谊药业有限责任公司;碘海醇350 mg I/mL,北京北陆药业股份有限公司)100 mL,随后加注100 mL生理盐水。采用Bolus tracking阈值触发扫描技术,ROI置于降主动脉与腹主动脉交界处,自动触发阈值设定为100 HU,达到阈值后延迟7~12 s行皮髓质期扫描,之后再分别延迟38~55 s、40~85 s行实质期及延迟期扫描。
3.图像分析
由两名副高以上诊断医师在对研究内容及病理结果不知情的情况下对病灶进行分析,意见不统一时协商解决。测量肿瘤的大小,评价肿瘤异质性(均匀/不均匀),边界(清楚/模糊),集合系统是否受累,是否合并钙化、囊变、坏死,伴随的其他征象(淋巴结增大/静脉血栓),病灶的多期相CT值(平扫、皮髓质期、实质期、延迟期)。计算皮髓质期净增CT值(皮髓质期CT值-平扫CT值)、实质期净增CT值(实质期CT值-平扫CT值)、延迟期净增CT值(延迟期CT值-平扫CT值)、绝对洗脱率[(实质期CT值-延迟期CT值)/(实质期CT值-平扫CT值)]。兴趣区(ROI)在皮髓质期或实质期具有最高CT值的区域上寻找并放置,匹配的ROI被放置在平扫及延迟期的相同位置,每个病灶各个期绘制三个不同的圆形ROI并取平均值,尽量放在病灶中心部位,如病灶均匀ROI则覆盖到最大可测量区域(约一半到三分之二),如病灶不均匀则避开钙化、囊变、坏死区域。病理分级在2016年5月之前采用经典的Fuhrman系统,之后采用2016年新版WHO/ISUP分级系统[3]。病理分级共分为G1、G2、G3、G4级,为便于统计分析,将G1、G2级归为低级别肿瘤,将G3、G4级归为高级别肿瘤。
4.统计学方法
采用SPSS 20.0软件分析所有数据,符合正态分布的计量资料采用独立样本t检验,不符合正态分布的计量资料采用秩和检验,计数资料采用卡方检验进行分析。ROC曲线分析采用MedCalc 19.0软件进行。P<0.05为差异具有统计学意义。
结 果
1.临床指标比较
PRCC均为单发,左侧18例、右侧15例,其中位于肾脏上、下极的共20例,肿瘤最大径范围1.5~13.4 cm。两型患者在性别(P=0.681)、年龄(P=0.562)、高危因素(P=0.149)、肿瘤最大径(P=0.194)等方面无明显差异。Ⅱ型PRCC的T分期、病理分级均显著高于Ⅰ型(P=0.049、P=0.022)。见表1。
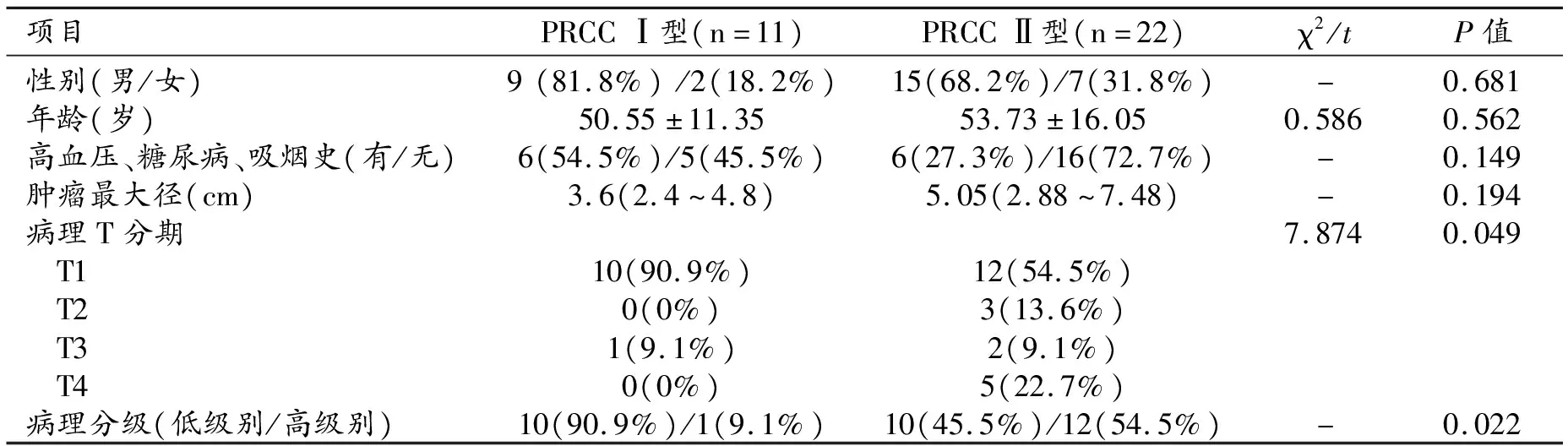
表1 两型患者临床指标的比较
2.CT特征比较
PRCC Ⅰ型(图1)和Ⅱ型(图2~4)在病灶形态(P=0.022)、CT分型(P=0.003)、边界(P=0.049)、异质性(P=0.033)、集合系统受累(P=0.015)、囊变坏死(P=0.049)等方面存在显著差异,在钙化(P=0.687)、淋巴结增大(P=0.143)、静脉癌栓形成等方面无明显差异(P=0.542)。见表2。
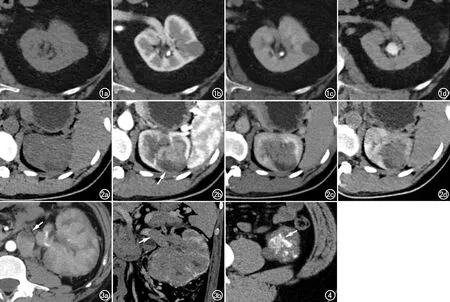
图1 男,74岁,Ⅰ型PRCC。a)平扫示左肾中部类圆形占位,密度均匀,CT值约31HU;b)皮髓质期示病灶边界清楚,直径约1.8cm,CT值约44HU;c)实质期CT值约64HU;d)延迟期CT值约54HU。 图2 女,37岁,Ⅱ型PRCC。a)平扫示左肾上极占位伴囊变坏死,CT值约37HU;b)皮髓质期示病灶呈分叶状,边界部分模糊(箭),最大径约4.5cm×3.0cm,左肾上盏受累,CT值约85 HU;c)实质期CT值约74HU;d)延迟期CT值约69HU。 图3 男,33岁,Ⅱ型PRCC。a)皮髓质期示病灶呈弥漫浸润性生长,腹主动脉左旁淋巴结增大(箭);b)实质期示左肾静脉癌栓形成(箭)。 图4 男,31岁,左肾下极Ⅱ型PRCC,平扫示病灶中央多发片絮状钙化(箭)。
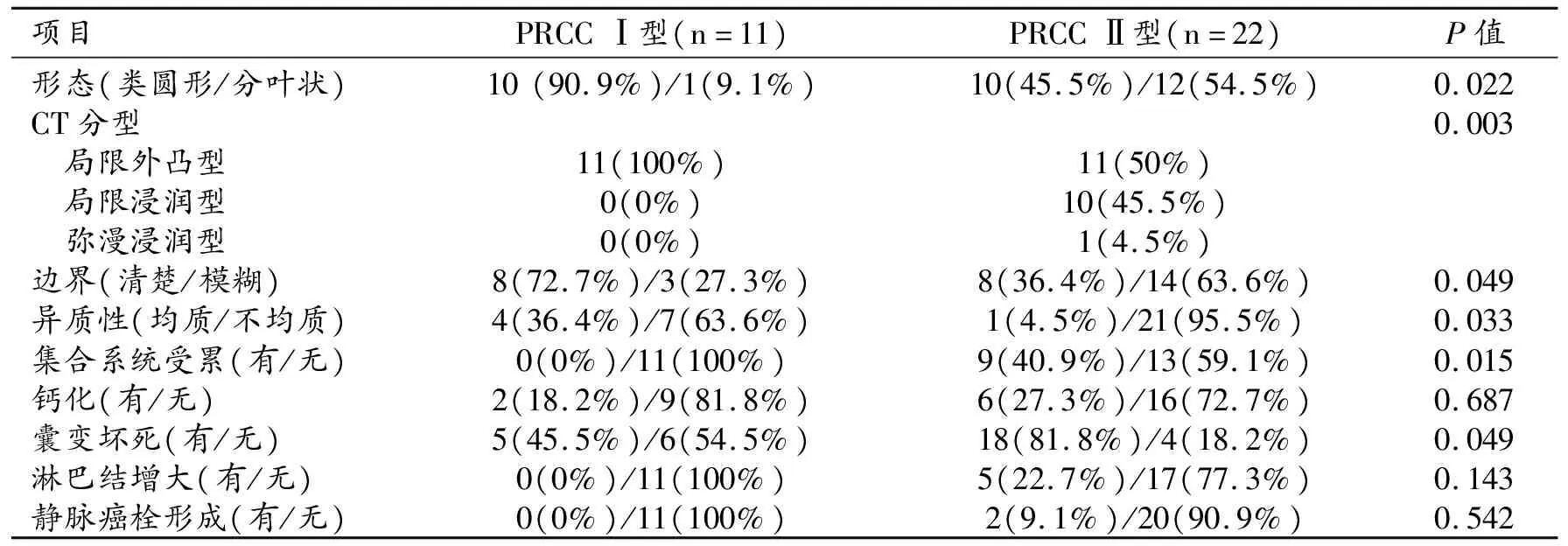
表2 两型PRCC影像特征的比较
3.多期相CT值比较
两亚型的平扫CT值、增强三期CT值、增强三期净增CT值以及洗脱率如表3所示,两亚型的平扫CT值、增强三期CT值、延迟期净增CT值均无显著差异(P>0.05),两型皮髓质期净增CT值分别为(17.18±17.60)HU、(38.91±22.31)HU,差异具有统计学意义(P=0.008)。两型实质期净增CT值分别为(26.45±12.06)HU、(40.00±18.96)HU,差异具有统计学意义(P=0.039)。皮髓质期、实质期净增CT值分别取14HU、32HU时鉴别价值最大,两者鉴别PRCC两型的ROC曲线下面积分别为0.818、0.738(图5)。
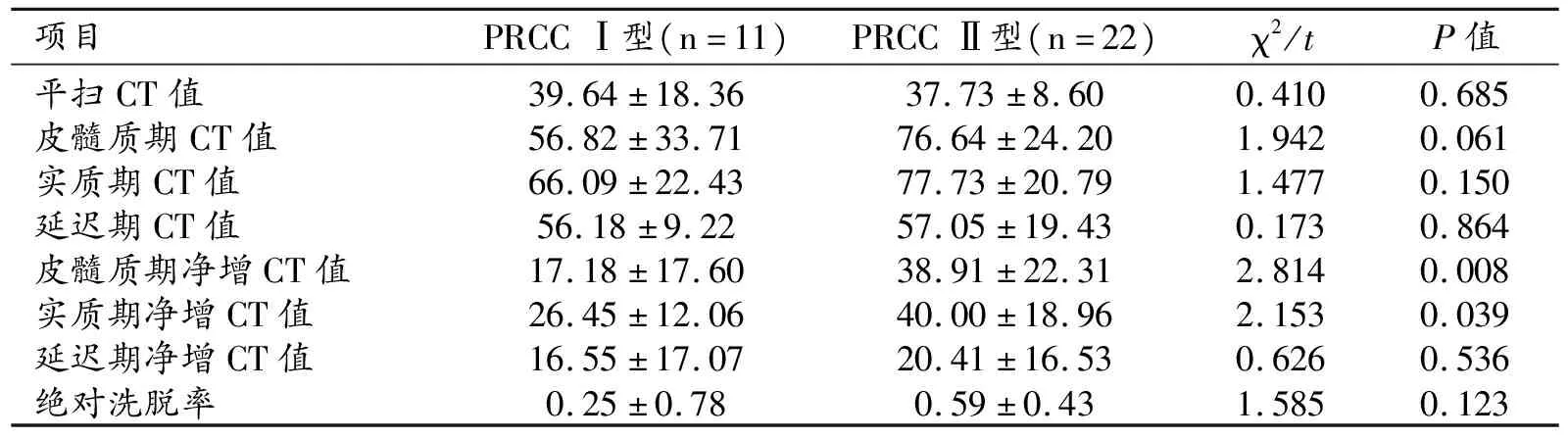
表3 两型PRCC多期相CT值的比较
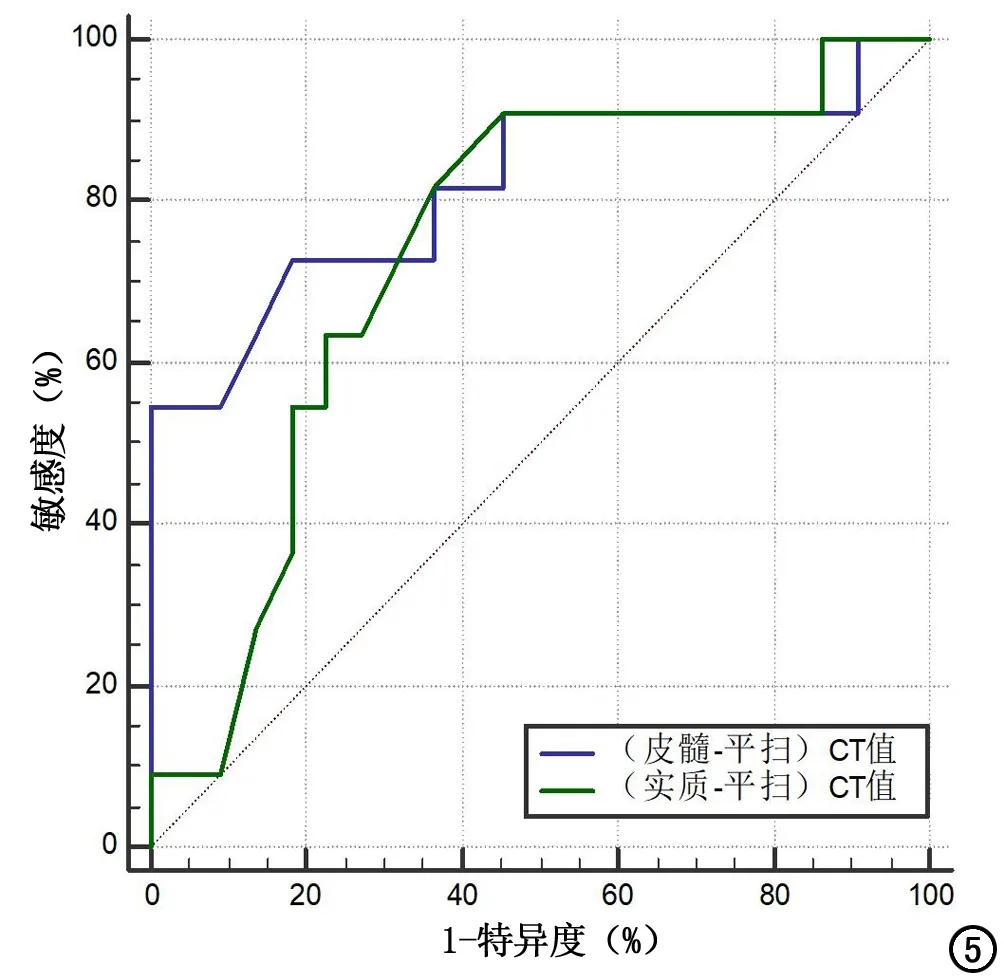
图5 皮髓质期、实质期净增CT值鉴别PRCC亚型的ROC曲线。
讨 论
PRCC是非透明细胞肾癌最常见亚型,主要分为两类:Ⅰ型(嗜碱型)和Ⅱ型(嗜酸型)。Ⅰ型PRCC呈乳头管状结构,被覆小细胞,胞浆稀少,单层排列;Ⅱ型PRCC呈乳头状结构,细胞体积大,核分级高,假复层排列[3]。研究证实PRCC亚型的基因组改变存在差异,大多数Ⅰ型肿瘤的特征是MET基因的改变,而Ⅱ型肿瘤的特征包括多种基因的改变,包括CDKN2A/B,SETD2和TFE3[4]。Ⅱ型PRCC中的特定亚组与不良的临床预后相关,如CpG岛甲基化子表型的肿瘤[5]。Ⅱ型较Ⅰ型PRCC患者的生存率降低、死亡和复发风险增加[6]。Ⅰ型常采用部分性肾切除术,术后只需定期随访;Ⅱ型因发生淋巴结转移可能性大,常采用根治性肾切除术,术后需频繁的随访及多样化的全身治疗[7],因此术前明确区分PRCC亚型非常重要。
PRCC平均发病年龄53岁,7例患者≤40岁,发病年龄趋向年轻化,可能与现代社会环境、生活方式等相关。男性多于女性,比例约为2.7:1,与陆金金等[8]结论较一致。临床症状不典型,半数以上通过体检发现,与肿瘤恶性程度相对较低、生长缓慢有关。PRCC两亚型在性别、高危因素方面无显著差异,Ⅱ型PRCC平均发病年龄、肿瘤最大径均略高于Ⅰ型,但差异无统计学意义,与段崇锋等[9]和Bindayi等[10]报道一致。戴辰晨等[11]则认为Ⅱ型肿瘤生长更快,其最大径显著大于Ⅰ型。Ⅱ型较Ⅰ型肿瘤的病理分期更晚、核分级越高,与Wong等[7]研究一致,证明病理分期及分级是PRCC重要的预后因素,存在上述差异可能与Ⅱ型肿瘤具有相对恶性的生物学特征相关。
两种亚型PRCC在病灶形态、边界、异质性、囊变坏死等方面存在显著差异,与多数研究一致[9,12-13],Ⅰ型常为类圆形、边界清晰、密度均匀,Ⅱ型常为分叶状、边界模糊、更易囊变坏死。Bindayi等[10]认为PRCC边界大多清楚,均匀度较高,囊变坏死少见,在两种亚型之间无显著差异。王君广等[14]认为两型PRCC均易出现囊变坏死,差异无统计学意义。笔者认为出现上述差异可能与病灶大小有关,Vikram等[15]报道直径>3 cm的PRCC易出现不同程度的囊变坏死,本研究两型最大径相差较大(3.6 cm vs 5.5 cm),而Bindayi等[10]、王君广等[14]研究中两型最大径相近,前者均较小(<3 cm,2.8 cm vs 2.6 cm),后者均较大(>3 cm,4.9 cm vs 5.1 cm)。Kim等[16]报道PRCC较透明细胞肾癌更易出现钙化,苏倩等[17]认为钙化只在Ⅱ型PRCC中出现,本组Ⅰ、Ⅱ型PRCC均有钙化但出现概率较低。钙化主要为点状,少数呈环形、片絮状,均位于Ⅱ型病灶中央,与王君广等[14]报道的钙化均位于肿瘤周边且呈蛋壳样不同。CT分型中,局限外凸型是两型最易出现的,Ⅱ型更易出现浸润性生长(50% vs 0%)。Ⅱ型较Ⅰ型更易出现肿瘤扩散[12],包括肾周侵犯、淋巴结转移及肾静脉癌栓形成,本研究肿瘤扩散均在Ⅱ型PRCC中出现,集合系统侵犯概率较高(9/22,40.9%),可作为较特异的鉴别点之一。
两种亚型PRCC在皮髓质期、实质期呈轻中度强化。于海龙等[18]认为CT峰值出现的时期有助于透明细胞癌、PRCC、嫌色细胞癌的鉴别,本研究两型PRCC增强峰均出现于实质期,与上述研究相符。此外延迟期两型PRCC强化程度均下降,与苏倩等[17]结论一致。Ⅱ型PRCC在皮髓质期、实质期强化均值高于Ⅰ型,延迟期Ⅱ型较Ⅰ型强化程度下降更明显,可能与Ⅱ型恶性程度相对较高,肿瘤血管异常增殖程度更大有关。而王君广等[14]则认为Ⅰ型PRCC在延迟期强化程度继续轻度增加,Ⅱ型延迟期强化轻度下降。CT强化特征对PRCC亚型的区分是否有价值呢?部分专家[12-13]认为皮髓质期、实质期Ⅱ型PRCC强化程度显著高于Ⅰ型,戴辰晨等[11]则认为虽然两型皮髓质期CT值存在显著差异,但实质期CT值无明显差异。此外部分学者[9-10,19]报道CT增强扫描对区分两亚型无明显帮助,本组结论与之相同,两型PRCC毛细血管密度虽存在差异,但在强化程度上存在较大重叠。笔者同时分析了增强三期净增CT值的差异,皮髓质期、实质期净增CT值对鉴别PRCC亚型有一定帮助,与陈杰等[12]结论大致相似,不同的是本研究以皮髓质期净增CT值差异明显,后者以实质期净增CT值差异明显。有研究[10]认为经皮穿刺肾组织活检才是PRCC亚型术前预测的可靠方式,本研究仅2例患者术前行CT引导下肾穿刺活检,无法有效评估该指标。本研究皮髓质期、实质期净增CT值鉴别两型的ROC曲线下面积均大于0.7,说明上述指标对预测PRCC亚型价值较高,当皮髓质期、实质期净增CT值分别取14 HU、32 HU时鉴别价值最大,实质期净增CT数值与陈杰等[12]研究结果高度一致。
总之,Ⅰ、Ⅱ型PRCC在临床指标、CT特征及多期相CT值等诸多方面存在不同,常规增强CT扫描参数存在较大重叠,皮髓质期、实质期净增CT值对鉴别PRCC亚型有一定的帮助。本研究样本量较小,有待将来纳入更多病例进行多中心研究。