miR-19a对腹主动脉瘤血管平滑肌细胞增殖迁移及炎症浸润的影响
2020-07-24欧阳勇刘彦叶洋波
欧阳勇,刘彦,叶洋波
(杭州市富阳区第一人民医院 血管外科,浙江 杭州 311400)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是常见的慢性主动脉退行性疾病,具有高发病率和高病死率,严重危害中老年人生命健康。临床研究发现,主动脉血管平滑肌细胞(vascular smooth muscle cells,VSMCs)异常增殖、巨噬细胞浸润和基质降解与AAA的发生发展密切相关[1]。但是,有关AAA发展过程中的炎症浸润和VSMCs增殖和凋亡的调控机制尚未完全阐明。近年研究发现微小RNA(miRNA)在AAA组织中异常表达,且与其发生发展密切相关[2-3]。已有研究表明,过表达miRlet-7a可下调炎症反应[4],过表达miR-21可抑制VSMCs增殖和诱导细胞凋亡,促进AAA的发展[5]。此外,LIU等[6]研究发现,miR-19a在AAA组织中高表达,但其在AAA的发生发展进程中的作用机制尚不清楚。本研究通过检测miR-19a在AAA患者AAA组织和血清中的表达水平,探讨miR-19a对主动脉VSMCs生物学行为以及炎症浸润的影响和作用机制,以期为AAA临床治疗提供潜在靶点和实验依据。
1 材料和方法
1.1 材料
1.1.1 收集临床样本:组织标本为2015年3月至2017年6月于杭州市富阳区第一人民医院经手术切除的15例AAA患者的腹主动脉组织和器官移植中心行肝脏、肾脏器官移植术(供体排除AAA以及其他腹主动脉相关病变)15例患者残留的部分正常腹主动脉组织。血清样本来源于15例AAA患者和同期进行体检的15例健康者。手术前均告知患者并签署知情同意书,并获得本院伦理委员会批准。
1.1.2 细胞和主要试剂:人主动脉VSMCs(BNCC340185)和人单核巨噬细胞THP-1(BNCC100407)均购自广州北纳生物科技有限公司;细胞培养基RPMI-1640购自美国Thermo Fisher公司;细胞培养基DMEM/F12和α-MEM、胰蛋白酶和胎牛血清均购于美国Gibco公司;miR-19a inhibitor/mimic,pcDNA3.1-CDKN2B质粒以及阴性对照均由上海吉马公司合成;TRIzol试剂盒购自美国Invitrogen公司;LipofectamineTM3000和反转录试剂盒购自日本TaKaRa公司;Transwell小室购自美国康宁公司;ELISA试剂盒购于美国Sigma Aldrich公司;兔抗人细胞周期蛋白依赖性激酶抑制剂2B(cyclin dependent kinase inhibitor 2B,CDKN2B)、β-actin单克隆抗体和HRP山羊抗鼠IgG均购自美国Cell Signaling Technology公司;青霉素、链霉素、BCA蛋白定量试剂盒、CCK-8试剂盒购自上海碧云天生物技术有限公司;双荧光素酶报告基因试剂盒购自美国Promega公司。
1.2 方法
1.2.1 巨噬细胞分离和培养:采用淋巴细胞分离培养基从AAA患者和健康体检者外周血中分离单个核细胞。采用PBS缓冲液按照1:1的比例稀释肝素化的血清,2000 r/min离心20 min,收集乳白上清液,再加入4 mL细胞洗涤液于2000 r/min离心20 min即可得到外周血单个核细胞。随后,将分离得到的外周血单核细胞悬液置于含有10%的胎牛血清、双抗(100 U/mL青霉素和100 μg/mL链霉素)、25 ng/mL单核细胞集落刺激因子的α-MEM培养基中培养。
1.2.2 细胞培养和转染:采用含有10%的胎牛血清和双抗的DMEM/F12培养VSMCs和采用RPMI-1640培养THP-1细胞,置于37 ℃、5% CO2的培养箱中培养。待细胞生长密度达到80%时,以2×105个/孔的浓度接种到6孔板中,置于培养箱中培养。铺板24 h内,培养至细胞单层密度达到50%~60%时进行转染。将VSMCs或THP-1细胞分别转染miR-19a inhibitor、miR-19a mimic和pcDNA3.1-CDKN2B。转染后放入培养箱培养8 h,更换双倍血清的培养基,继续培养48 h,收集细胞用于后续实验。
1.2.3 RT-qPCR检测miR-19a的表达水平:收集组织、血清样本和处理后的细胞,采用TRIzol提取细胞中总RNA,并采用NanoDrop检测RNA的浓度。随后,采用一步法反转录试剂盒将RNA反转录为cDNA,严格按照qPCR试剂盒说明书检测miR-19a表达水平,以U6为内参。miR-19a上游引物为5’-CTGGAGTGTGCAAATCTA TGC-3’,下游引物为5’-GTGCAGGGTCCGAGGT-3’;U6上游引物为5’-CTCGCTTCGGCAGCACATATACT-3’,下游引物为5’-ACGCTTCACGAATTTGCGTGTC-3’。实验重复3次。
1.2.4 Western blot检测蛋白的表达水平:收集处于对数期的VSMCs和THP-1细胞,采用RAPI裂解液提取细胞中的总蛋白,检测蛋白质浓度。进行10% SDS-PAGE分离蛋白、电转膜法将目的条带转移至PVDF膜上,以5%脱脂奶粉室温封闭1 h后分别加入CDKN2B(1:1000)和β-actin抗体(1:1000),4 ℃孵育过夜。之后,加入HRP标记的山羊抗鼠IgG(1:2000)室温孵育2 h。最后,进行ECL染色,凝胶成像仪采集图像;通过ImageJ分析灰度值。实验重复3次。
1.2.5 CCK-8检测VSMCs细胞增殖活力:将经转染和未转染处理的VSMCs细胞培养至处于对数生长期后,以2×104个/孔的浓度接种于96孔板中,并在每孔中加入100 μL DMEM培养基(含有50%巨噬细胞培养上清),每组设6个复孔。置于37 ℃、5% CO2的培养箱中培养0、24、48、72和96 h后,向每孔中加入10 μL CCK-8溶液(0.5 mg/mL)后继续于培养箱中孵育4 h后,采用酶标仪检测450 nm处的每孔光密度(OD450)值。
1.2.6 Transwell检测VSMCs细胞迁移能力:将经转染和未转染处理的VSMCs细胞培养至处于对数生长期后,以1×105个/孔的浓度接种于Transwell小室上室,下室加入500 μL混合培养基(250 μL巨噬细胞培养上清液和250 μL DMEM/F12培养基)后常规培养24 h。采用0.1%结晶紫染色20 min,并于光学显微镜下随机选择5个视野计算侵袭和迁移细胞数。实验重复3次。
1.2.7 流式细胞术检测VSMCs凋亡情况:取各组细胞以1×105个/孔接种于96孔板中,过夜培养后用胰蛋白酶消化细胞,PBS洗涤后加入300 μL结合液重悬,加入10 μL Annexin V-FITC室温避光孵育15 min,再加入5 μL PI溶液染色,混合均匀后避光孵育5 min,流式细胞仪检测细胞凋亡百分比。
1.2.8 双荧光素酶报告基因验证miR-19a和CDKN2B的靶向关系:由湖南普拉特泽生物科技有限公司构建CDKN2B基因的3’UTR,插入pGL3-Promoter质粒载体中,将该重组质粒命名为pGL3-CDKN2B-3’UTR WT,采用基因突变法定点突变获得CDKN2B突变型载体(pGL3-CDKN2B-3’UTR MUT)。然后,将HEK 293T细胞接种于12孔板中,待细胞汇合度达到50%~70%时分别将miR-19a mimic和mimic-NC,CDKN2B野生型载体、CDKN2B突变型载体共转染于HEK 293T细胞中,转染6 h后更换为新鲜的含10%胎牛血清的DMEM培养液,继续培养36 h。最后,采用双荧光素酶报告基因检测试剂盒检测荧光素酶活。实验重复3次。
1.2.9 ELISA检测炎性因子的表达水平:将经转染和未转染处理的THP-1细胞培养于含有50%巨噬细胞培养上清液RPMI-1640培养基中,培养结束后严格按照ELISA试剂盒说明书检测TL-1β、TNF-α和IL-6的表达水平。
1.3 统计学处理方法 采用SPSS22.0对所有数据进行统计学分析。计量资料以±s表示,2组比较采用t检验,多组比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-19a在AAA组织和血清中高表达 RT-qPCR检测结果显示,miR-19a在AAA组织中的表达水平明显高于正常腹主动脉组织(P<0.01)。与健康组比,miR-19a在AAA患者血清中的表达水平明显上调(P<0.01)。见图1。

图1 miR-19a在AAA患者组织(A)和血清(B)中的表达
2.2 敲降miR-19a可显著抑制VSMCs增殖、迁移和诱导细胞凋亡 RT-qPCR检测结果显示,相比于对照组,敲降miR-19a可明显下调miR-19a在VSMCs中的表达水平(P<0.01),见图2A;CCK-8检测结果显示,敲降miR-19a后VSMCs增殖活力明显低于对照组(P<0.01),见图2B;流式细胞术检测结果显示,相比于对照组,敲降miR-19a可显著诱导VSMCs凋亡水平(P<0.01),见图2C;Transwell检测结果显示,敲降miR-19a可显著抑制VSMCs迁移能力(P<0.01),见图2D。
2.3 敲降miR-19a抑制THP-1细胞炎症因子和基质金属蛋白酶(matrix metalloproteinase,MMPs)的表达 ELISA检测结果显示,相比于对照组,敲降miR-19a可明显抑制THP-1细胞中炎症因子(TNF-α、IL-6和IL-1β)的表达水平(P<0.01),见图3A-C。Western blot检测结果表明,敲降miR-19a可明显抑制单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、MMP-2和MMP-9的表达水平(P<0.01),见图3D。由此可知,敲降miR-19a可明显抑制THP-1细胞中炎症因子和THP-1细胞表面蛋白的表达水平。
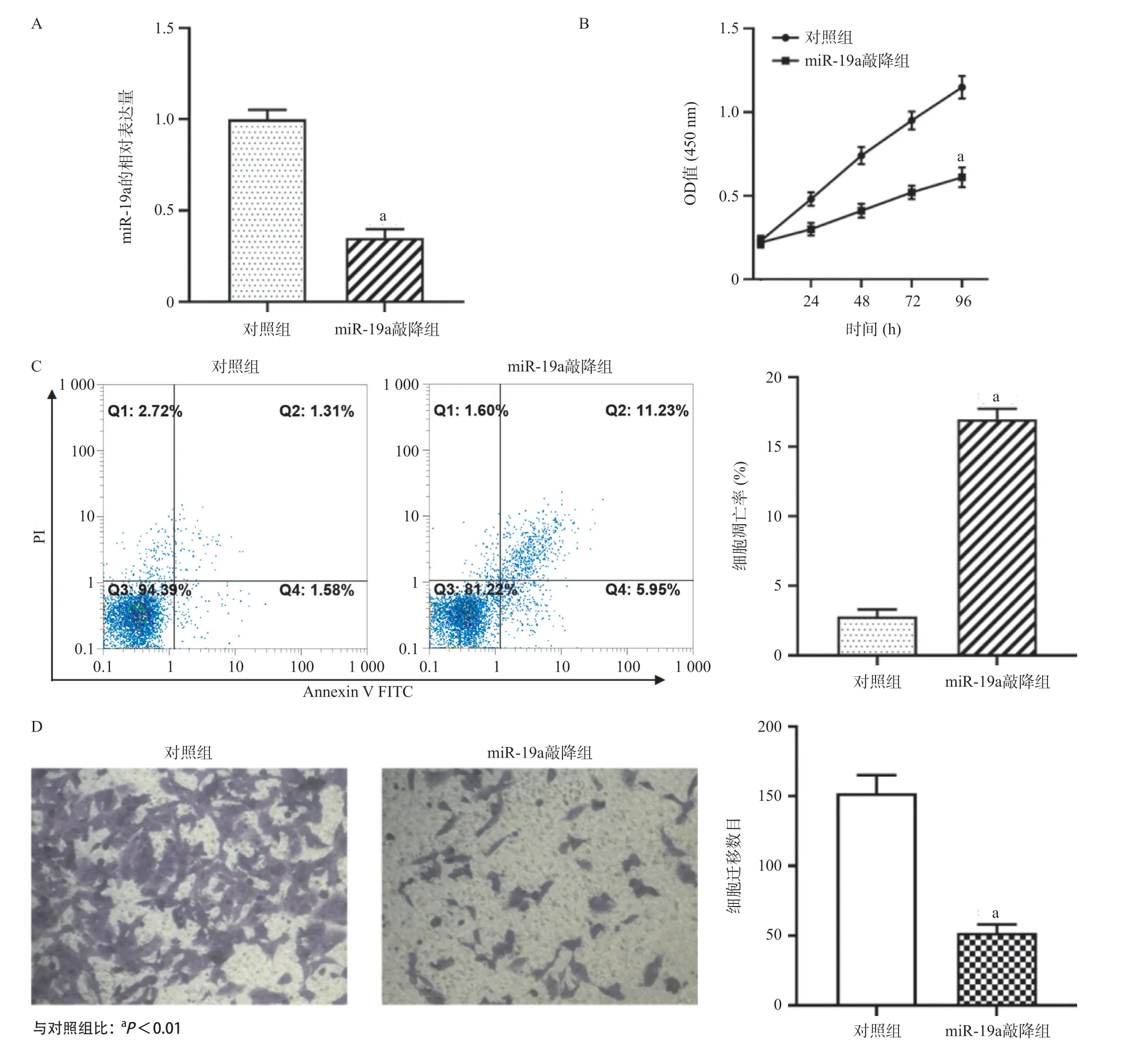
图2 敲降miR-19a对VSMCs增殖、凋亡和迁移(×100)的影响
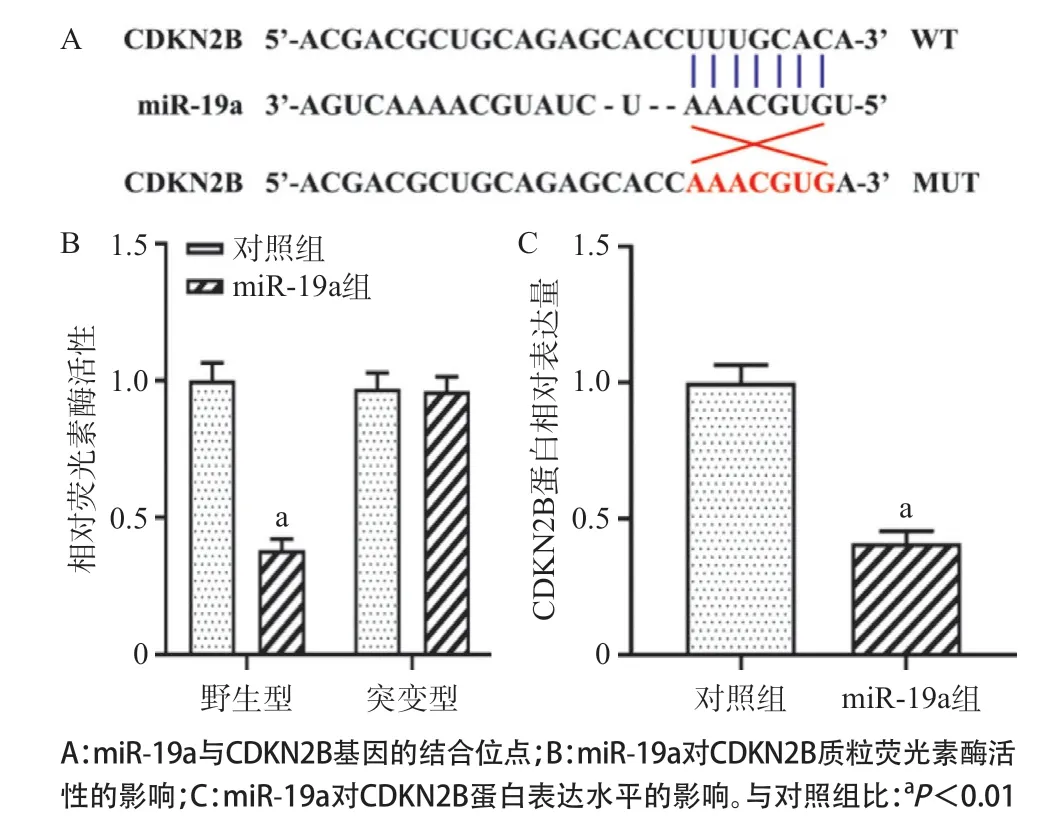
2.4 miR-19a靶向负调CDKN2B的表达 通过比对TargetScan数据库发现,CDKN2B是miR-19a的潜在靶基因,其结合位点如图4A所示。同时,双荧光素酶报告基因结果表明,相比于对照组(mimic-NC),过表达miR-19a可显著减少野生型CDKN2B质粒的荧光素酶活性(P<0.01),但对突变型CDKN2B质粒荧光素酶的活性没有影响,见图4B。Western blot检测结果发现,过表达miR-19a可显著下调VSMCs中CDKN2B蛋白的表达水平(P<0.01),见图4C。
2.5 miR-19a靶向CDKN2B抑制VSMCs增殖、侵袭和诱导凋亡 Western blot检测结果表明,与对照组比,过表达CDKN2B可显著上调VSMCs中CDKN2B蛋白的表达水平(P<0.01),但同时过表达miR-19a和CDKN2B后VSMCs中CDKN2B的表达水平与对照组差异无统计学意义(P>0.05),见图5A。CCK-8检测结果显示,过表达CDKN2B可显著抑制VSMCs增殖活力(P<0.01),见图5B。流式细胞术检测结果表明,与对照组比,过表达CDKN2B可显著诱导VSMCs凋亡水平(P<0.01),见图5C。Transwell检测结果显示,过表达CDKN2B后VSMCs迁移能力明显低于对照组(P<0.01),见图5D。但同时过表达miR-19a和CDKN2B后可明显缓解仅过表达CDKN2B对VSMCs增殖、凋亡和迁移的调控作用(P<0.01),见图5B-D。
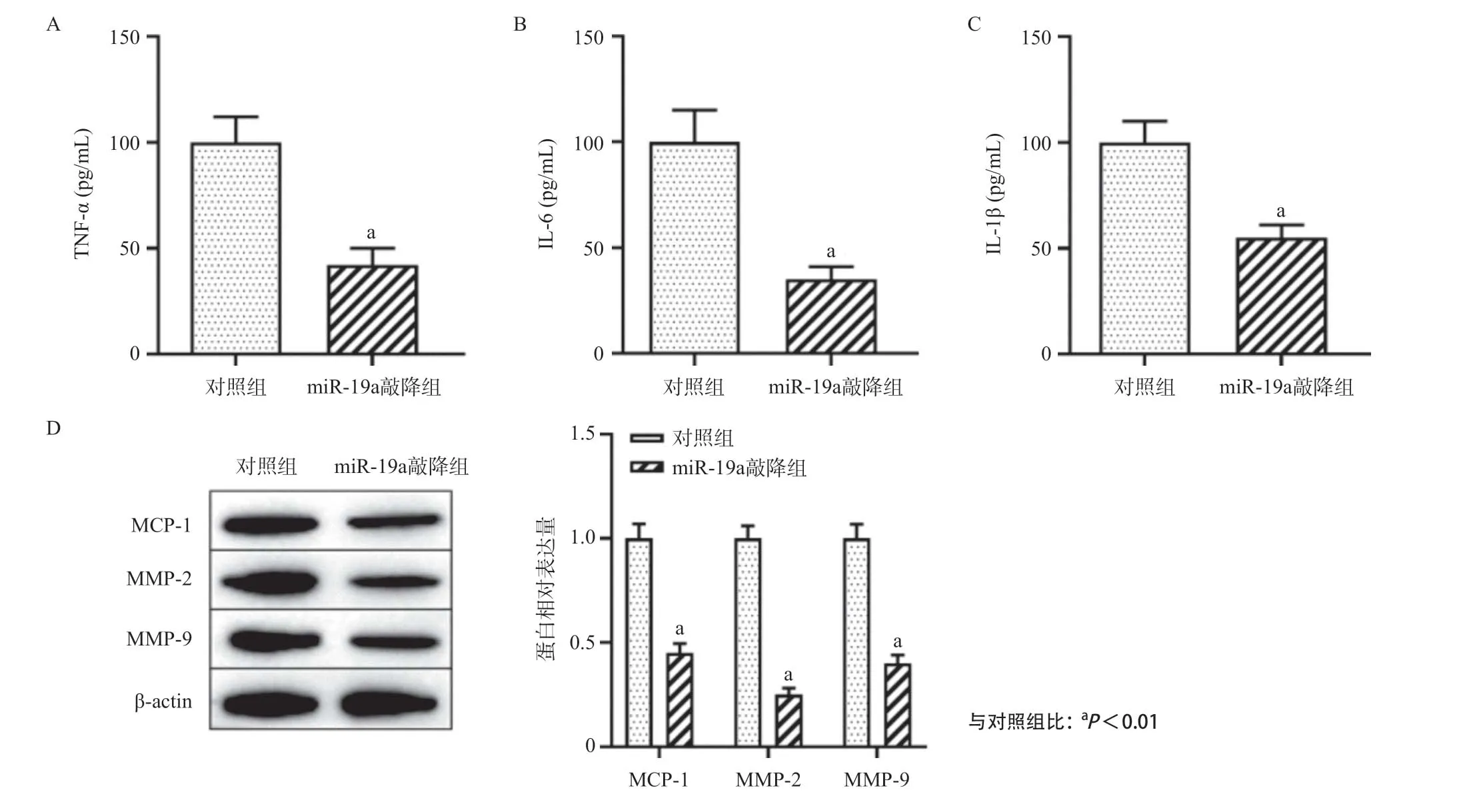
图3 敲降miR-19a对THP-1细胞炎症因子和MMP表达的影响
2.6 miR-19a靶向CDKN2B下调THP-1细胞炎症因子和MMPs的表达水平 ELISA检测结果显示,相比于对照组,过表达CDKN2B可显著下调TNF-α、IL-6和IL-1β的表达水平(P<0.01),但同时过表达miR-19a和CDKN2B可缓解仅过表达CDKN2B对炎症因子的抑制作用(P<0.01),见图6。Western blot检测证实,相比于对照组,过表达CDKN2B可显著抑制MCP-1、MMP-2和MMP-9蛋白的表达水平(P<0.01);但同时过表达CDKN2B和miR-19a后MCP-1、MMP-2及MMP-9蛋白的表达水平与对照组比差异无统计学意义。见图5A。
3 讨论
AAA是一种严重的迟发性血管疾病,病死率高。近年来,miRNA被广泛报道通过调控细胞生物学行为,进而参与多种疾病的发生发展进程。LI等[7]研究表明,miR-19a可作为心脏、血管和神经元相关疾病的早期诊断和治疗靶点。MENG等[8]研究发现,miR-183和miR-141与AAA的不良预后密切相关。过表达miR-155-3p通过促进VSMCs的增殖和抑制细胞凋亡,进而促进AAA的发生与发展[9]。PENG等[10]研究表明,过表达miR-26a通过靶向PTEN促进VSMCs增殖和诱导细胞凋亡,进而诱导AAA的发展。同时,前期研究也证实,异常表达的miR-19a与炎症和肿瘤密切相关[11-12]。本研究结果表明,与对照组相比,miR-19a在AAA主动脉壁组织和血清中高表达;敲降miR-19a可显著抑制VSMCs增殖和迁移能力,以及诱导细胞凋亡;同时,敲降miR-19a抑制了THP-1细胞因子和MMPs的表达。机制上,miR-19a通过靶向下调CDKN2B的表达,进而促进VSMCs增殖和转移,诱导炎症反应和MMPs的表达,从而加速AAA的发展进程。

图5 miR-19a靶向CDKN2B对VSMCs增殖、凋亡和细胞迁移(×100)的影响
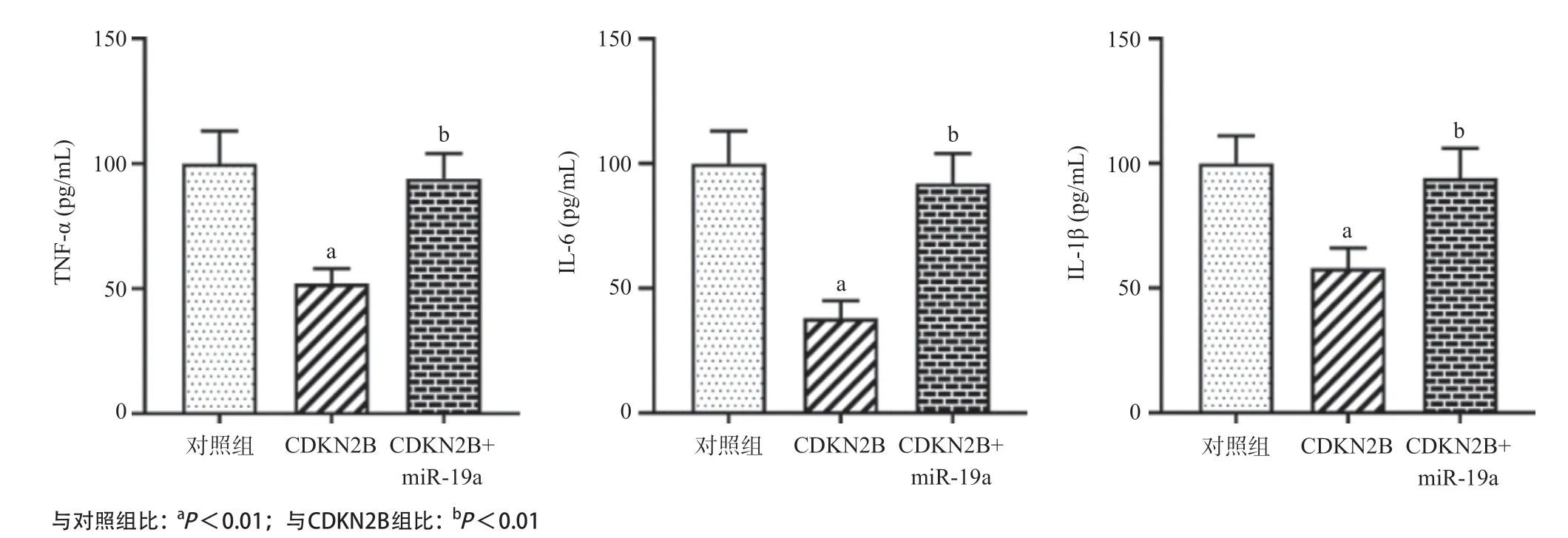
图6 miR-19a靶向CDKN2B对THP-1细胞炎症因子表达水平的影响
巨噬细胞是炎症和免疫学的关键细胞之一,miR-19a在多种炎症递质作用下表达增强[13-14]。巨噬细胞的存在可损伤动脉壁,因为巨噬细胞产生的MMPs可以降解血管管壁中层弹力纤维,造成血管壁顺应性降低,并在血流的冲击作用下加剧瘤体扩张,使胶原蛋白产生崩解[15]。例如,敲降miR-33-5p可通过缓解THP-1炎症因子的表达和MMPs的表达,进而缓解AAA的发展进程[16]。同时,ZHANG等[17]研究结果证实,敲降miR-155通过抑制THP-1细胞炎症反应和MMPs的表达,进而缓解血管紧张素II诱导小鼠AAA形成。miR-195通过抑制炎性因子和MMPs的表达,缓解了AAA的发展进程[18]。与前期研究一致,本研究发现miR-19a水平在AAA患者组织和血清中高表达。同时,敲降miR-19a抑制了THP-1细胞上清液中炎症因子的表达水平以及主动脉弹性蛋白的表达。此外,过表达miR-19a促进了VSMCs的迁移。以上研究结果提示,抑制炎症反应和MMPs的表达可预防AAA动脉壁破裂的发生。
CDKN2B作为多种恶性肿瘤的抑癌基因,通过介导细胞增殖、周期和凋亡进而抑制肿瘤的发展进程[19-20]。在血管系统中,CDKN2B通过介导p53参与血管重塑[21]。LEEPER等[22]研究表明,敲降CDKN2B通过上调p53的表达,进而促进动脉瘤的形成。GAO等[23]研究发现,过表达miR-15a通过靶向抑制CDKN2B上调平滑肌细胞增殖和抑制细胞凋亡,从而促进AAA的发展进程。同时,本研究结果同样证实,敲降miR-19a通过靶向上调CDKN2B抑制平滑肌细胞增殖和诱导细胞凋亡,以及缓解THP-1细胞上清炎症因子和MMPs的表达,进而缓解AAA的发展进程。由以上实验结果和文献资料我们推断,miR-19a/CDKN2B分子轴在AAA的发生发展中发挥重要作用,并且调控VSMCs增殖、凋亡和细胞迁移以及炎性细胞浸润,但其能否作为新的治疗靶点投入到临床中还需要进一步深入研究。
