非酒精性脂肪性肝纤维化动物模型的改良和建立
2020-07-24周玉平温晋锋周飞王庆领杨萍吕雪幼
周玉平,温晋锋,周飞,王庆领,杨萍,吕雪幼
(1.宁波大学医学院附属医院 消化内科,浙江 宁波 315020;2.宁波大学 消化疾病研究所,浙江宁波 315020;3.宁波大学医学院 生物化学与分子生物学研究所,浙江 宁波 315211;4.宁波卫生职业技术学院 护理学院,浙江 宁波 315100)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已经成为全球最主要的慢性肝病[1]。NAFLD长期发展的结果必将导致非酒精性脂肪性肝纤维化(hepatic non-alcoholic steatofibrosis,NASF)[2]。系统评价和Meta分析显示,肝纤维化是NAFLD死亡率的最重要预测因素,与无纤维化相比,有纤维化的NAFLD患者的全因死亡风险增加,并且该风险随着纤维化阶段的增加而增加[3]。由此可见,NASF是NAFLD进展过程中的关键环节,也是导致其不良结局的重要原因。因此,进一步研究NASF的发病机制及探索防治NASF的有效药物是当前的重大课题,但目前尚无理想的NASF动物模型制约了相关的基础研究。本研究旨在构建一个造模时间相对较短、成功率高、重复性好的动物模型,使之能够较完整表达人类NASF的病理特点和发病机制特点。
1 材料和方法
1.1 材料
1.1.1 实验动物:6~8周龄SFP级C57BL/6J雄性小鼠,体质量(22±4)g,购自江苏集萃药康生物科技有限公司,生产许可证号:SCXK(苏)2018-0008。动物饲养于宁波大学实验动物中心,本研究获得宁波大学实验动物伦理委员会批准。
1.1.2 药物与试剂:CCl4分析纯购自上海国药集团化学试剂有限公司;蛋氨酸-胆碱缺乏饲料(methionine-choline-deficient diet,MCD,批号TP3005G)及对照饲料(methionine-cholinesupplemented diet,MCS,批号TP3005Gs)购自南通特洛菲饲料科技有限公司;伊红、苏木精、苯胺蓝均为美国Sigma公司产品;谷丙转氨酶(glutamic pyruvic transaminase,ALT)、谷草转氨酶(glutamic oxaloacetic transaminase,AST)、总胆红素(total bilirubin,TBIL)、甘油三酯(triglyceride,TG)生化检测试剂盒购自南京建成生物工程研究所;α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)抗体购自美国Proteintech公司。
1.2 方法
1.2.1 动物分组和造模:适应性喂养5 d后,小鼠随机分成正常组、模型组,正常组8只,模型组16只。正常组给予MCS饲料喂养;模型组采用MCD饮食诱导+每周1次腹腔注射10% CCl4-橄榄油溶液(剂量为2 mL/kg),分4周组和6周组,各8只。
1.2.2 一般指标观察:每天观察小鼠的一般状况,包括自主活动、精神状态、毛发变化等,每周固定时间称量体质量,最后处死动物后,摘取肝脏滤纸吸干表面水分称量其湿重,计算肝脏指数(%)=肝湿重/体质量×100%。
1.2.3 标本留取方法:4周末取4周组、6周末取对照组和6周组小鼠进行指标检测,动物禁食12 h,3%戊巴比妥钠腹腔注射麻醉,打开腹腔,下腔静脉采血,摘取肝脏,选肝脏最大叶1块置于4%中性甲醛溶液中固定,用于组织病理染色及免疫组化检测;另取一较大叶切成方形,OTC包埋后液氮速冻用于冰冻切片;其余EP管分装液氮速冻后转移到-70 ℃保存。
1.2.4 生化指标检测:ALT、AST、TBIL活性检测及血清、肝脏TG含量检测均采用生化检测试剂盒进行。
1.2.5 组织病理学观察:制作肝组织石蜡切片,行HE染色和Masson染色,观察组织炎症、脂肪变性和胶原增生情况。制作肝组织冰冻切片,行油红O染色,观察脂滴沉积情况。用Image-Pro Plus 6.0软件测量各个样本的阳性染色面积,每个样本测量5个视野,计算出每张切片的平均阳性面积(μm2)用于统计分析。
1.2.6 免疫组织化学检测α-SMA表达:常规制作石蜡切片后二甲苯脱蜡,梯度乙醇复水;3% H2O2阻断、灭活内源性过氧化物酶;PBS冲洗后0.01 mol/L枸橼酸缓冲液进行抗原修复;滴加一抗(α-SMA,稀释500倍);4 ℃冰箱孵育过夜;室温平衡及PBS冲洗;滴加二抗37 ℃孵育30 min;DAB反应染色;苏木素复染、干燥、封片;显微镜下观察拍照,每张切片随机选择5不同的视野观察拍照,并用Image-Pro Plus软件测量阳性染色面积,每个样本测量5个视野,计算出每张切片的平均阳性面积(μm2)用于统计分析。
1.3 统计学处理方法 采用SPSS20.0软件进行分析。正态分布计量数据以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,2组间进一步比较采用LSD检验,若不服从方差齐性,则采用Dunnett-T3检验法。P<0.05为差异有统计学意义。
2 结果
2.1 造模后小鼠一般状况和体质量变化 对照组小鼠生活状态良好,毛发光泽;模型组小鼠随造模时间延长,皮毛变得疏松油腻,精神萎靡,日渐消瘦。对照组小鼠体质量随时间延长稍有增加,但趋于稳定;模型组则明显有下降趋势,尤其在第2、第5周下降最为明显,自第2周开始模型组小鼠体质量显著低于对照组(P<0.01),见表1。
表1 各组小鼠体质量变化比较(每组n=8,±s,g)
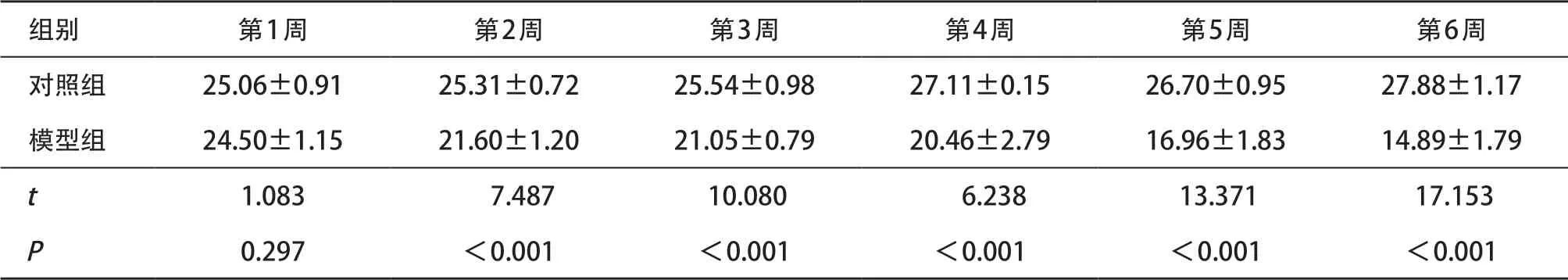
表1 各组小鼠体质量变化比较(每组n=8,±s,g)
组别 第1周 第2周 第3周 第4周 第5周 第6周对照组 25.06±0.91 25.31±0.72 25.54±0.98 27.11±0.15 26.70±0.95 27.88±1.17模型组 24.50±1.15 21.60±1.20 21.05±0.79 20.46±2.79 16.96±1.83 14.89±1.79 t 1.083 7.487 10.080 6.238 13.371 17.153 P 0.297 <0.001 <0.001 <0.001 <0.001 <0.001
2.2 造模后小鼠的肝脏变化及肝指数情况 造模后的小鼠肝脏可见表面光泽差,颜色偏黄白,有明显脂肪变性,6周模型小鼠更为明显,且部分肝脏可见米粒大小的结节,而对照组小鼠肝脏表面光滑,色泽粉红,无结节,无脂肪变性(见图1)。计算肝脏指数结果显示,造模6周后肝脏指数明显上升,显著高于对照组(P<0.01),见表2。

图1 各组小鼠肝脏外观比较
表2 各组小鼠肝脏指数比较(每组n=8,±s)
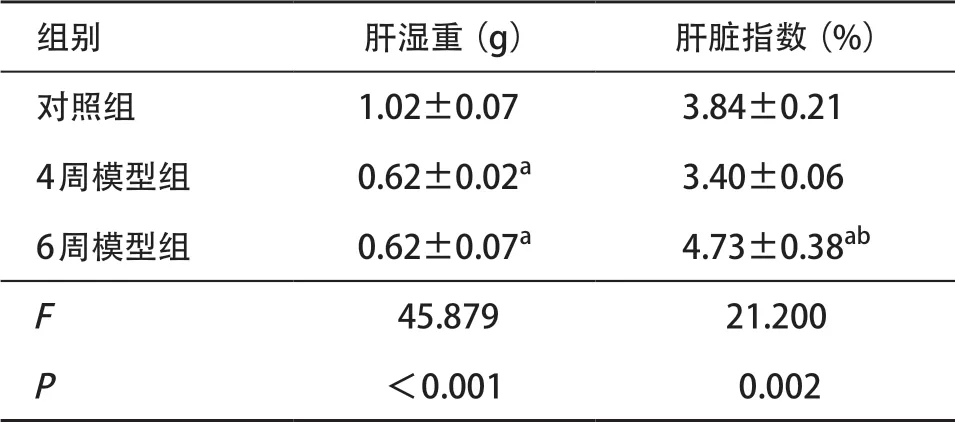
表2 各组小鼠肝脏指数比较(每组n=8,±s)
与对照组比:aP<0.01;与4周模型组比:bP<0.01
组别 肝湿重(g) 肝脏指数(%)对照组 1.02±0.07 3.84±0.214周模型组 0.62±0.02a 3.40±0.066周模型组 0.62±0.07a 4.73±0.38ab F 45.879 21.200 P<0.001 0.002
2.3 各组小鼠血清ALT、AST、TBIL活性比较 生化检测结果显示,相比正常组,模型组血清ALT、AST、TBIL指标均显著升高(P<0.01);6周模型组指标升高更为明显,较4周模型组显著升高(P<0.01),见表3。
表3 各组血清肝功能指标比较(每组n=8,±s)
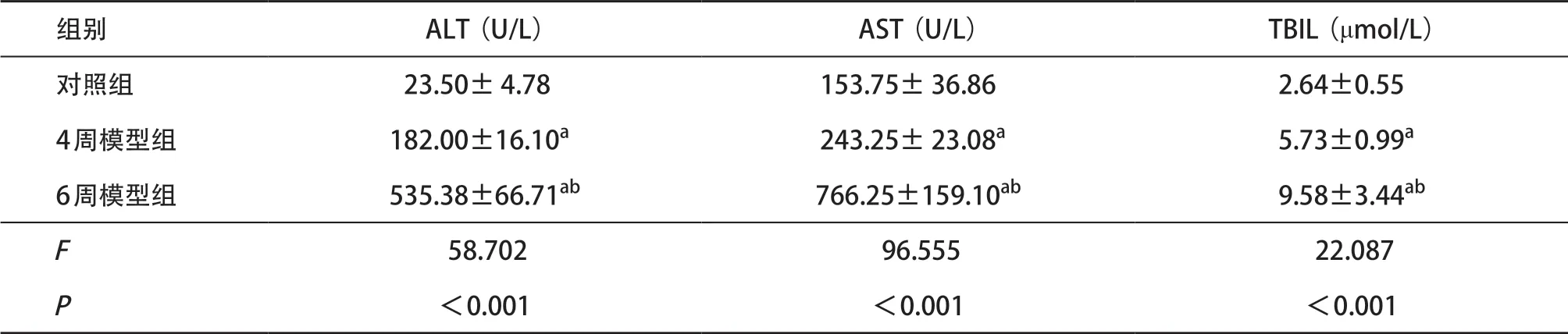
表3 各组血清肝功能指标比较(每组n=8,±s)
与对照组比:aP<0.01;与4周模型组比:bP<0.01
组别 ALT(U/L) AST(U/L) TBIL(μmol/L)对照组 23.50± 4.78 153.75± 36.86 2.64±0.554周模型组 182.00±16.10a 243.25± 23.08a 5.73±0.99a 6周模型组 535.38±66.71ab 766.25±159.10ab 9.58±3.44ab F 58.702 96.555 22.087 P<0.001 <0.001 <0.001
2.4 各组小鼠血清和肝脏TG含量比较 生化检测结果显示,相比对照组,模型组血清TG含量显著下降(P<0.01),而肝脏TG含量显著升高(P<0.01);其中,6周模型组血清TG含量显著低于4周模型组(P<0.01),6周模型肝脏TG含量显著高于4周模型组(P<0.01),见表4。
表4 各组血清和肝脏TG含量比较(每组n=8,±s,U/L)
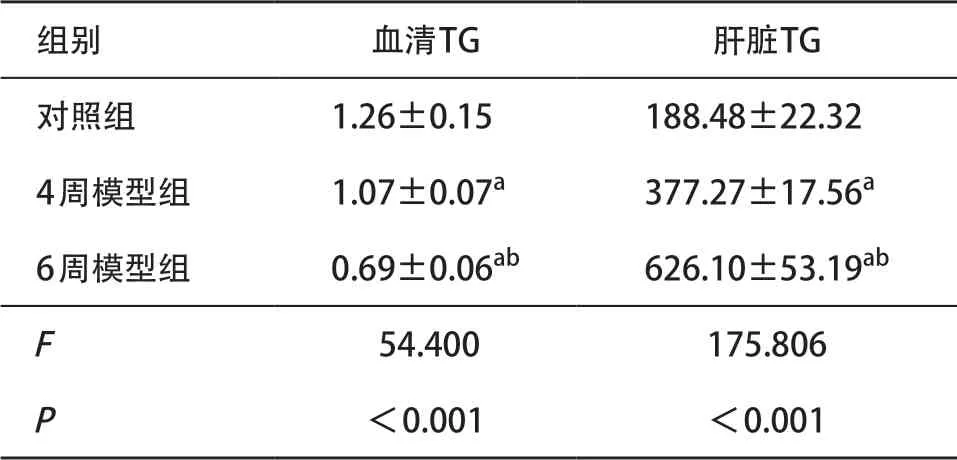
表4 各组血清和肝脏TG含量比较(每组n=8,±s,U/L)
与对照组比:aP<0.01;与4周模型组比:bP<0.01
组别 血清TG 肝脏TG对照组 1.26±0.15 188.48±22.324周模型组 1.07±0.07a 377.27±17.56a 6周模型组 0.69±0.06ab 626.10±53.19ab F 54.400 175.806 P<0.001 <0.001
2.5 各组小鼠肝组织病理变化比较 HE染色、油红O染色及Masson染色显示,对照组肝组织形态结构正常,汇管区无炎症细胞浸润;无脂肪变性,无红色脂滴;只在血管壁可见少量胶原染色。模型组肝组织可见汇管区炎症细胞浸润;大量脂肪变性,胞质内充满大小较一致的脂滴;胶原沉积明显增加,窦周可见胶原纤维形成细丝状甚至粗索状分布,肝小叶结构紊乱,也可见纤维组织增生;其中6周模型的病理改变较4周模型明显加重,见图2。半定量分析显示,模型组的脂滴和胶原面积显著高于对照组(P<0.05);6周模型组显著高于4周模型组(P<0.05),见表5。
表5 各组肝组织病理染色阳性面积比较(每n=8,±s,μm2)

表5 各组肝组织病理染色阳性面积比较(每n=8,±s,μm2)
与对照组比:aP<0.01;与4周模型组比:bP<0.05
组别 油红O染色 Masson染色 α-SMA蛋白表达对照组 758.4± 125.7 2827.7± 453.7 425.6± 37.94周模型组 71709.7± 9273.9a 26536.4±3039.7a 2233.9± 77.8a 6周模型组 119173.0±15862.9ab 35614.1±6394.8ab 2988.8±161.1ab F 94.663 102.471 470.323 P<0.001 <0.001 <0.001
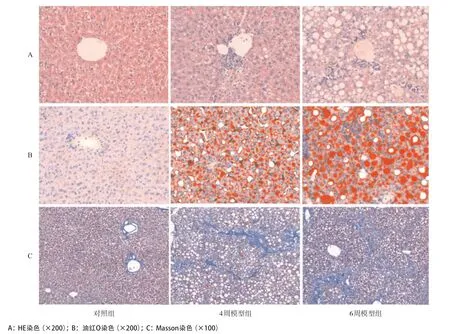
图2 各组小鼠肝脏组织病理学改变比较
2.6 各组小鼠肝组织α-SMA蛋白表达比较 免疫组织化学染色检测α-SMA蛋白表达结果显示:对照组肝组织见少量α-SMA表达在血管壁;模型组肝组织α-SMA阳性染色明显增多,主要见于汇管区,肝血窦和纤维间隔;其中6周模型的阳性表达较4周模型明显增加。见图3。染色阳性面积的半定量分析显示,模型组阳性表达面积显著高于对照组(P<0.01);6周模型组又显著高于4周模型组(P<0.01),见表5。

图3 各组小鼠肝组织α-SMA蛋白免疫组织化学染色(×100)
3 讨论
NASF的基础研究及新药开发是肝病研究领域的热点和难点,研制理想的动物模型是当前需要迫切解决的问题。NAFLD模型较为成熟,其中高脂饮食、MCD饮食诱导的模型应用最为广泛[4]。虽然NAFLD模型研究取得了较大进展,然而,构建由单纯性脂肪肝过渡到非酒精性脂肪性肝炎(non-alcoholic steatchepatitis,NASH)再到肝纤维化肝硬化这样反映NAFLD全病程的动物模型的方法并不多见。虽然高脂饮食和MCD饮食诱导的模型能较好地模拟NASH的病理特点,但较难出现纤维化和肝硬化改变。NASF模型复制较为困难,一定程度上制约了相关的基础和药物开发研究。
有研究者将MCD饮食喂养时间延长至8周,以期复制简易可靠的NASF模型,结果虽然小鼠肝脏出现严重的脂肪变性,但Masson染色结果提示肝纤维化仅为1-2级[5]。刘洋等[6]的6周MCD小鼠模型发现,虽然MCD组小鼠肝组织中α-SMA、COL1A1、TGF-β1等纤维化相关的mRNA表达显著升高,但组织病理学检测仍未见明显的肝纤维化改变。虽然胆碱缺乏并添加乙硫氨酸饮食模型可复制NASF病理过程,短期喂食可使动物肝脏发生脂肪变性、炎症,长期喂食则可使动物肝脏发生纤维化、硬化甚至肝癌,但此方法的缺点是动物体质量下降超过20%,死亡率非常高,大大增加实验的难度,并降低了可重复性。盖曲倞等[7]对该模型经过改良大大降低了死亡率,成功建立小鼠NASH及肝纤维化的模型,但造模时间需要16周。高脂饮食诱导的大鼠模型出现肝纤维化,造模时间则更久,一般需要24周以上[8-9]。TSUCHIDA等[10]报道了一种可迅速进展为肝纤维化和肝癌的NASH小鼠模型,研究者给予C57BL/6J小鼠富含高脂、高糖和高胆固醇的饮食,结合每周在腹腔内给予低剂量的促进剂CCl4,建立了一种具有快速广泛纤维化和肝细胞癌进展的NASH小鼠模型,在12周可产生第3阶段纤维化,并且在24周发展成肝癌,该模型12周可出现明显肝纤维化改变,且动物死亡率低,是目前较为理想的模型,但造模时间仍相对较长,且高糖、高脂、高胆固醇的饮食不符合我国的饮食特点。
可见目前NASF动物模型存在病理改变不明显、造模周期长、动物死亡率高、重复性差等问题,有必要进一步改良或研制新的模型。本课题组在大量文献调研基础上提出了一种新的造模方案:即在常规MCD饮食诱导的基础上,反复给予低剂量的CCl4的腹腔注射,结果显示,该方法6周能较好模拟NASF病理表现,出现严重脂肪变、肝脏炎症及明显的肝纤维化改变(分级为3~4级),肝纤维化形成关键细胞即星状细胞活化的标志物α-SMA的表达也显著增多,血清肝功能明显异常,肝脏脂肪含量显著增多且无动物死亡情况。需要指出的是,此种模型与大部分NAFLD患者存在代谢综合征的表型有所差异,我们观察到小鼠摄入MCD后,摄食量有所减少,体质量逐渐下降,且血脂水平显著降低,这是本模型的不足之处。
MCD饮食诱发的C57BL/6J小鼠模型的造模原理是通过饮食中蛋氨酸与胆碱的缺乏造成线粒体β-氧化功能障碍和极低密度脂蛋白合成与分泌减少,从而使TG在肝细胞内迅速大量堆积,导致肝细胞脂肪变性,造成“第一次打击”[11];进而,由于肝细胞的脂肪变性,线粒体减少对游离脂肪酸(free fatty acid,FFA)的摄入,促使FFA的β-氧化增加,导致ROS的合成和脂质过氧化反应,形成对肝脏的“第二次打击”,最终导致NASH的发生[12]。CCl4具有肝毒性,进入机体后在肝内产生活化氧自由基,过氧化作用增强,加快肝脂肪变性进程,损伤肝细胞,造成肝细胞变性坏死,引起细胞外基质过度沉积而成肝纤维化,其代谢产物还可以刺激肝脏枯否细胞,释放促炎性细胞因子,进一步加重肝脏的损伤。CCl4诱导的化学肝损伤是经典的肝纤维化模型,但其发病机制、病程演变过程和组织形态的改变都与人类脂肪肝差异较大,高浓度CCl4造模药物毒性强,肝细胞坏死、炎症和纤维化发生早而严重,动物死亡率高[13]。本研究联合MCD饮食和反复的低剂量注射CCl4,扬长避短,成功复制了NASF模型,符合人类NASF的发病机制和病理表现特点,可用于临床药效评价和新药研究。
