固相萃取-高效液相色谱法测定保健食品中8种皂苷化合物含量
2020-07-23马海建王利娟江晨舟邵明华张驰中
马海建 王利娟 江晨舟 邵明华 张驰中
摘要:旨在建立一种固相萃取结合高效液相色谱检测保健食品中8种皂苷化合物(三七皂苷R1与人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rd)的方法,考察不同溶剂和不同超声时间对皂苷化合物提取效率的影响以及不同固相萃取小柱对回收率的影响。通过试验,确定先用30%甲醇溶液超声20 min进行提取,然后用C18小柱净化的前处理方法,并对优化后的方法进行方法学验证。结果表明,优化后的前处理方法+高效液相色谱法操作简便、耗时少,8种皂苷化合物峰面积與含量线性方程的决定系数均可达到0.999 0以上,检出限为3.7~11.4 μg/g,方法的精密度和重复性良好,样品在24 h内稳定,样品的加标回收率为85.38%~108.41%。该方法可操作性强、稳定性好,可以同时检测含有三七、人参、西洋参和高丽参等原料的保健食品中8种皂苷化合物含量。
关键词:保健食品;皂苷化合物;固相萃取;高效液相色谱法(HPLC)
中图分类号:TS207.3文献标识码:A文章编号:1000-4440(2020)03-0743-08
Determination of eight saponins contents in health-care food by solid phase extraction-high performance liquid chromatography
MA Hai-jian,WANG Li-juan,JIANG Chen-zhou,SHAO Ming-hua,ZHANG Chi-zhong
(ANPEL Laboratory Technologies
Abstract:The research aims to detect eight saponins including notoginsenoside R1, ginsenoside Rg1, Re, Rf, Rb1, Rc, Rb2 and Rd in health-care food by the method of solid phase extraction-high performance liquid chromatography (SPE-HPLC). Effects of different solvents and ultrasonic time on the extraction efficiency of saponins and the influence of different solid phase extraction columns on the recovery rate were investigated. The pretreatment method was determined that ultrasonic extraction was performed by using 30% methanol solution for 20 minutes, and then the C18 solid phase extraction column was used for purification. The methodology validation was applied to evaluate the optimized methods. The results showed that the optimized pretreatment method combined with HPLC was easy to operate and took less time. The determination coefficients of peak area and content of eight saponins were all above 0.999 0 and the detection limit was 3.7-11.4 μg/g. The method showed good precision and reproducibility, and the sample was stable within 24 hours. The recovery rate of standard addition was 85.38%-108.41%. The method was stable and easy to operate, and could be used to detect the contents of eight saponins in health-care food using Panax notoginseng, Panax ginseng, Panax quinquefolius as raw materials.
Key words:health-care food;saponins;solid phase extraction;high performance liquid chromatography(HPLC)
随着中国经济的快速发展与人们生活水平的不断提高,人们的健康意识和向往健康生活的心态也在逐渐提升,保健食品市场得到快速发展。目前,中国保健食品的产值约有4.000×1011元[1],其中被宣传能够增强人的免疫力和缓解疲劳类保健食品一直是中国市场上占比较高的一类产品,这类保健食品多以名贵中药材为原料,如人参、西洋参和三七等[2-3],这些原料的成本相对较高,导致保健食品市场上存在一些以假乱真、以次充好的现象。
据《中华人民共和国药典一部》(2015年版)[4]记载,人参、西洋参的主要活性标志成分有人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2和Rd,三七的主要活性标志成分有三七皂苷R1与人参皂苷Rg1、Re、Rb1、Rd。这些皂苷类化合物具有耐缺氧、抗衰老和提高机体免疫力等作用[5-7]。目前,针对皂苷的检测方法有比色法、薄层色谱法、高效液相色谱法(High performance liquid chromatography,HPLC)、液相色谱质谱联用法(Liquid chromatograph mass spectrometer, LC-MS)等[8-9]。其中,比色法存在操作繁琐、专属性差、耗时长、测定结果干扰因素多等缺陷[10-11]。相关标准和文献中的高效液相色谱法则主要针对单一来源产品中几种皂苷化合物的检测[12-13],主要采用加热回流法或超声法提取、大孔吸附树脂柱净化,但是净化柱手工装填过程繁杂且重复性较差,而且保健食品可能会使用多种原料,进一步增加了操作的复杂性。为了更好地评价保健食品中皂苷成分的含量,本研究拟建立用于检测三七皂苷R1与人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rd共8种皂苷化合物的HPLC方法,同时对前处理条件进行优化,以期为含有三七、人参类保健食品中皂苷化合物的科学检测提供参考。
1材料与方法
1.1试验材料
含有人参、西洋参、高丽参、三七的保健食品,购于上海市某连锁药店、上海市某大型购物超市及电商平台。共购买7种保健食品作为试验样品,其中包含1种片剂类样品(某品牌的西洋参含片)、3种胶囊类样品(某品牌的西洋参胶囊、某品牌的三七西洋参胶囊和某品牌的三七丹参胶囊)、3种口服液类样品(某品牌的人参蜂王浆口服液、某品牌的高丽红参饮品和某品牌的高丽参口服液),以上样品均在其产品保质期内且外观完整无破损。
1.2试剂与仪器
标准品:纯度>99%的三七皂苷R1与人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rd,均由上海安谱实验科技股份有限公司提供。
试剂与耗材:甲醇(色谱纯,CNW)、乙醇(色谱纯,CNW)、正丁醇(色谱纯,CNW)、乙腈(色谱纯,CNW)、磷酸(色谱纯,CNW)、CNWBOND C18 SPE小柱(500 mg,6 ml)、CNWBOND 亲水疏水平衡(Hydrophilic-lipophilic banlanced copolymer, HLB) SPE小柱(500 mg,6 ml)、CNWBOND 大孔吸附树脂XAD-2 SPE小柱(4 g,10 ml)均由上海安谱实验科技股份有限公司提供。试验用水为笔者所在实验室自制的纯净水。
仪器与设备:Thermo U3000高效液相色谱仪(美国赛默飞世尔科技公司產品),2300TH型数控超声波清洗器(频率为40 kHz, 功率为100 W,上海安谱实验科技股份有限公司产品),24位水浴氮吹仪(上海安谱实验科技股份有限公司产品),TDL-40C台式大容量离心机(上海安亭科学仪器厂产品)。
1.3试验方法
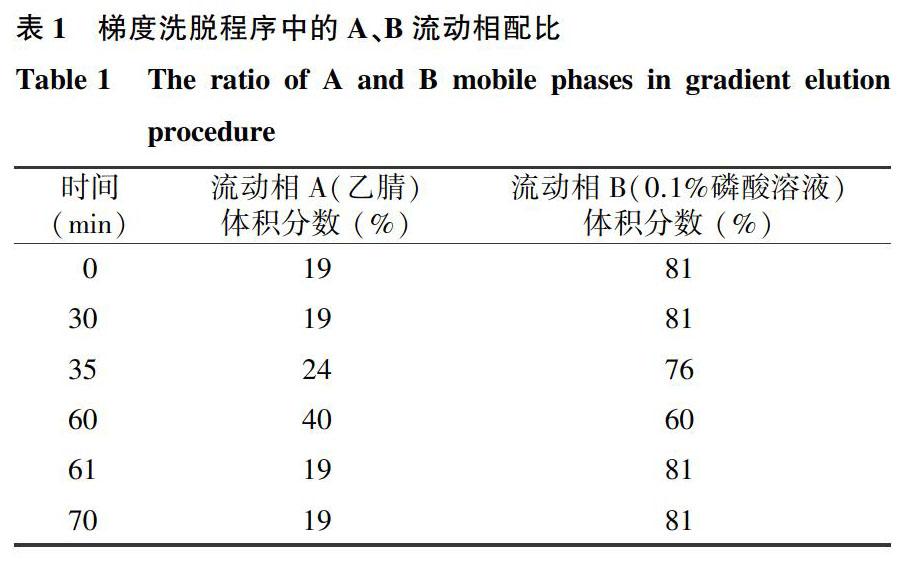
1.3.1色谱条件参照《中华人民共和国药典一部》(2015年版)中人参总皂苷部分的检测方法[4],并略作修改。色谱柱为CNW Athena C18 (4.6 mm×250.0 mm, 5 μm),柱流速为1.3 ml/min,柱温为30 ℃,进样量为10 μl,紫外检测器波长为203 nm,流动相A为乙腈,流动相B为0.1%磷酸溶液,梯度洗脱。具体流动相配比见表1。
1.3.2标准品溶液的制备分别精确称取8.656 19 mg三七皂苷R1与9.336 71 mg人参皂苷Rg1、10.031 90 mg人参皂苷Re、9.024 84 mg人参皂苷Rf、11.498 50 mg人参皂苷Rb1、10.162 10 mg人参皂苷Rc、9.458 62 mg人参皂苷Rb2和8.149 60 mg人参皂苷Rd标准品置于10 ml容量瓶中,用甲醇溶解并定容,制得8种皂苷化合物混合标准贮备液,其质量浓度分别为865.62 μg/ml、933.67 μg/ml、1 003.19 μg/ml、902.48 μg/ml、1 149.85 μg/ml、1 016.21 μg/ml、945.86 μg/ml和814.96 μg/ml。分别移取适量体积的标准贮备液,用甲醇稀释并定容,得到系列标准工作溶液。
1.3.3样品溶液的制备将片剂类样品取出后研磨成粉末,混匀备用;将胶囊类样品的内容物取出,混匀备用;将口服液类样品移取到样品瓶中,混匀备用。称取2 g左右的样品于离心管中,加入10 ml 30%甲醇水溶液,在室温下超声(频率为40 kHz,功率为80 W)处理20 min,于4 000 r/min离心5 min,转移上清液至20 ml容量瓶中,用30%甲醇水溶液定容,取5 ml提取液进行下一步的净化。
将C18固相萃取小柱装于固相萃取装置上,加10 ml纯甲醇进行活化,再加10 ml纯净水进行平衡,待水流至筛板表面时加入5 ml提取液,控制流速在3 ml/min左右,待提取液流至筛板表面时,加入10 ml纯净水进行淋洗,待淋洗液流完后,放入离心管接收洗脱液,用12 ml纯甲醇进行洗脱,控制流速在3 ml/min左右。将洗脱液于50 ℃水浴氮吹至2 ml左右时转移至5 ml容量瓶中,用甲醇定容,过0.22 μm针式滤器后上机检测。
1.4数据处理
本试验数据均用Excel 2010软件进行分析处理。
2结果与分析
2.1样品前处理方法的优化
2.1.1提取溶剂的对比皂苷化合物一般以醇(甲醇、乙醇和正丁醇)、纯净水或两者的混合物为提取液[14]。某品牌的三七西洋参胶囊样品的预试验检测结果表明,该样品中不含有人参皂苷Rf。为了同时分析对比8种皂苷化合物的提取效率,优化试验中在样品粉末表面添加了适量8种皂苷混合标准品并静置混匀,以保证样品中均含有8种待测皂苷化合物,然后在不同前处理条件下进行检测,以对比优化前处理条件。图1比较了常见的3种溶剂甲醇、乙醇和正丁醇对8种皂苷的提取效果,3种溶剂均为色谱纯,含量在99.9%以上。可以看出,用3种不同溶剂提取时,样品中8种皂苷化合物的提取量无明显差异,表明使用3种溶剂超声提取均可较好地完成保健食品中8种皂苷的提取。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd;n=3。
图2比较了不同浓度[0(纯净水)、30%、70%和100%]甲醇溶液对三七西洋参胶囊样品中8种皂苷化合物提取效率的影响,可以看出,不同浓度甲醇溶液均可较好地提取样品中的8种皂苷类目标化合物,当用纯净水提取时,样品中人参皂苷Rg1和Re的提取量略大于用30%、70%、100%甲醇溶液提取,而人参皂苷Rb1、Rc、Rb2和Rd的提取量则小于用30%、70%、100%甲醇溶液提取;分别用30%、70%和100%甲醇溶液提取的样品中8种皂苷化合物的量无明显差异。从8种皂苷化合物的总提取量看出,含甲醇提取溶剂的提取效率要高于纯净水溶剂,考虑到后续试验要使用C18固相萃取小柱,提取溶剂中甲醇等有机溶剂含量过高会影响小柱的吸附效能,因此最终选择30%甲醇溶液作为提取溶剂,既保证了提取效率,又可确保在后续固相萃取富集净化过程中8种皂苷化合物能够被小柱填料吸附。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd;n=3。
2.1.2超声条件的对比提取皂苷化合物一般使用加热回流法,耗时长、提取效率低,而超声波能有效破碎细胞壁,释放细胞内容物,具有耗时少、提取效率高、成分不易分解破坏等优点[15]。本研究选用超声波提取8种皂苷化合物,减少了提取时间,提高了提取效率。为了研究不同超声时间和超声次数对8种皂苷化合物提取量的影响,以30%甲醇溶液作为提取溶剂,分别于室温超声处理5 min、10 min、20 min和30 min(频率为40 kHz,功率为80 W),对比不同超声时间下8种皂苷化合物提取量。同时,对比超声20 min提取2次、合并2次提取溶液的方法对8种皂苷化合物提取效果的影响。从图3可以看出,在超声时间5~20 min,随着超声时间的增加,8种皂苷化合物的提取量呈逐渐增大的趋势。在超声20 min、30 min和超声20 min提取2次3种条件下,8种皂苷化合物的提取量无显著差异。经综合分析,选择超声20 min提取1次作为保健食品中8种皂苷化合物的提取方式。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd;n=3。
2.1.3不同SPE小柱对8种皂苷化合物加标回收率的对比在皂苷化合物的提取物中,常有糖类、鞣质等亲水性较强的成分,给皂苷化合物的分离纯化增加了难度[16]。本研究选用XAD-2、C18、HLB 3种固相萃取小柱对保健食品的提取液进行净化,并对净化效果和加标回收率进行对比。XAD-2小柱填料是一种非离子型网状苯乙烯-二乙烯基苯基体的吸附树脂,类似于《保健食品检验与评价技术规范》(2003年版)中人参皂苷检测部分使用的大孔吸附树脂[16];C18小柱具有较好的疏水性,对皂苷类化合物有较好的富集作用,同时也可除去一些多糖类等亲水性强的杂质;HLB小柱基质是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮2种单体按比例聚合而成的大孔共聚物,是一种亲水-亲脂平衡性吸附剂。从图4可以看出,使用C18小柱和HLB小柱的样品中8种皂苷的加标回收率(80%~110%)要明显高于使用XAD-2小柱的加标回收率(30%~60%)。经小柱分步收集和减少上样量试验的验证,推测这可能是因为样品中的皂苷化合物含量较高,导致XAD-2小柱过载,未能完全吸附目标化合物。传统皂苷净化方法使用的大孔吸附树脂多为手工装填的层析柱,其填料装样量大,保证了目标化合物不会过载,但是手工装填操作复杂,耗时长,且重复性相对较差。样品谱图对比分析可知,C18小柱的除杂效果要略好于HLB小柱。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd;n=6。
图5为某品牌含三七原料的胶囊样品用C18小柱净化前后的色谱结果,可以看出,C18小柱对样品有相对较好的净化作用,对色谱柱和仪器有一定的保护作用,并且可以保证较高的回收率。因此,本试验最终选用C18固相萃取小柱作为保健食品中8种皂苷化合物检测过程中的净化柱。
1:未经C18小柱净化的谱图;2:经过C18小柱净化的谱图。a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rb1;e:人参皂苷Rc;f:人参皂苷Rb2;g:人参皂苷Rd;n=6。
2.1.4不同前处理方法的对比为了验证本试验建立的30%甲醇溶液超声提取C18 SPE小柱净化方法的提取效率,参照《中华人民共和国药典一部》(2015年版)人参相关部分中人参皂苷检测的加热回流提取方法,与本试验建立的前处理方法进行提取效率的对比。《中华人民共和国药典一部》(2015年版)的具体方法如下:称取1.0 g样品于索式提取器中,加三氯甲烷加热回流3 h,弃去三氯甲烷溶液;将残渣中的溶剂挥发干后移入锥形瓶中,精确加入50 ml水饱和正丁醇,密塞,放置过夜,超声(频率为40 kHz,功率为80 W)30 min,过滤,弃去初滤液,精确量取25 ml续滤液,蒸干后用甲醇溶解残渣并将其转移至5 ml容量瓶中,加甲醇定容,过0.22 μm针式滤器后上机检测[4]。
由图6可以看出,在2种提取方法下,8种皂苷化合物的提取量差别相对较小,在传统加热回流提取方法下,人参皂苷Rf、Rc、Rd的提取量略高于本试验建立的提取法,而三七皂苷R1、人参皂苷Re和Rb2的提取量则略低于本试验建立的提取法,2种方法提取的人参皂苷Rb1的含量无明显差异。总体而言,本试验建立的提取法与传统加热回流提取法的提取效率无明显差异,并且本试验建立的提取法可以减少有机溶剂的使用量、缩短前处理时间,相比于传统加热回流方法,提取效率更高。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd;n=6。
2.2超声提取-C18小柱净化方法的方法学考察
2.2.18种皂苷化合物峰面积与质量浓度的线性关系和检出限取配制好的一系列不同质量浓度的8种皂苷化合物混合标准溶液进行测定。如图7所示,8种皂苷化合物的峰形良好且均可得到有效分離。8种皂苷化合物峰面积与质量浓度的线性方程、线性范围、检出限和定量限见表2,以各组分的峰面积为纵坐标、质量浓度为横坐标绘制标准曲线发现,8种皂苷化合物均有较好的线性关系,R2均在0.999 0以上。以某品牌高丽红参饮品为空白样品,将稀释后的混合标准品溶液加入空白样品中,使其加标浓度约为10 μg/g,平行检测12个样品,基于响应值标准偏差和标准曲线斜率法测定方法检出限(Limit of detection, LOD)和方法定量限(Limit of quantitation, LOQ)。结果表明,检出限为3.7~11.4 μg/g,定量限为12.3~38.0 μg/g,可以满足保健食品中8种皂苷化合物的检测要求。
a:三七皂苷R1;b:人参皂苷Rg1;c:人参皂苷Re;d:人参皂苷Rf;e:人参皂苷Rb1;f:人参皂苷Rc;g:人参皂苷Rb2;h:人参皂苷Rd。
Y1~Y8为峰面积,x1~x8为各皂苷含量。
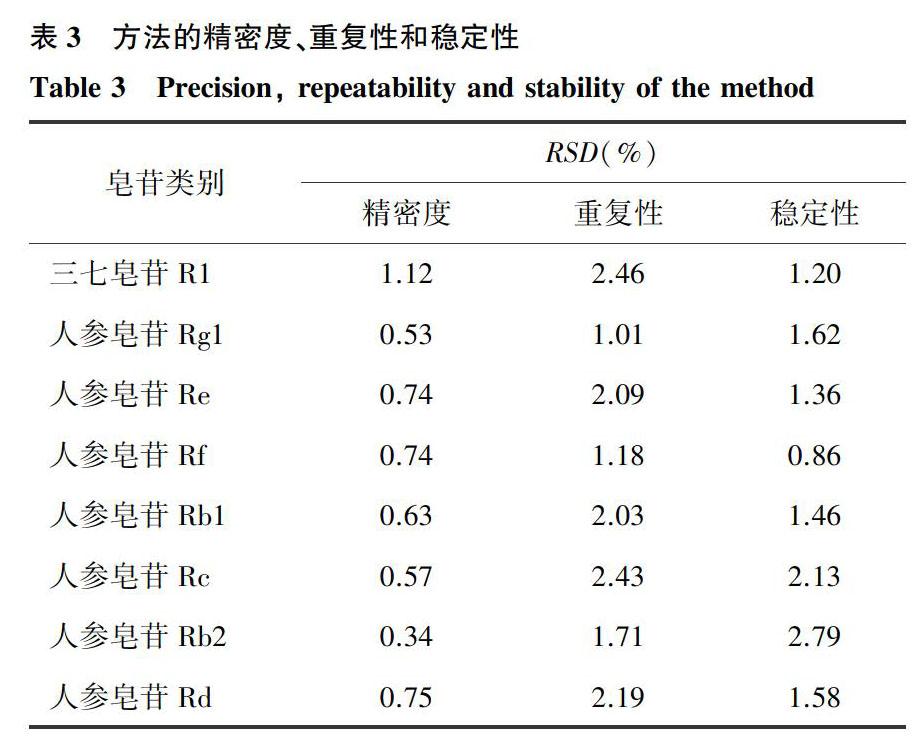
2.2.2方法的精密度、重复性和稳定性取同一份供试品溶液,连续测定6次,由表3可以看出,8种皂苷化合物的相对标准偏差(RSD)为0.34%~1.12%,表明仪器的精密度良好;取同一批次的样品重复提取6次,进样测定结果显示,样品的RSD为1.01%~2.46%,表明方法的重复性良好;取同一份供试品溶液分别于0 h、2 h、4 h、8 h、12 h和24 h进样,8种皂苷化合物的RSD为0.86%~2.79%,表明样品中的8种皂苷化合物至少在24 h内是稳定的。
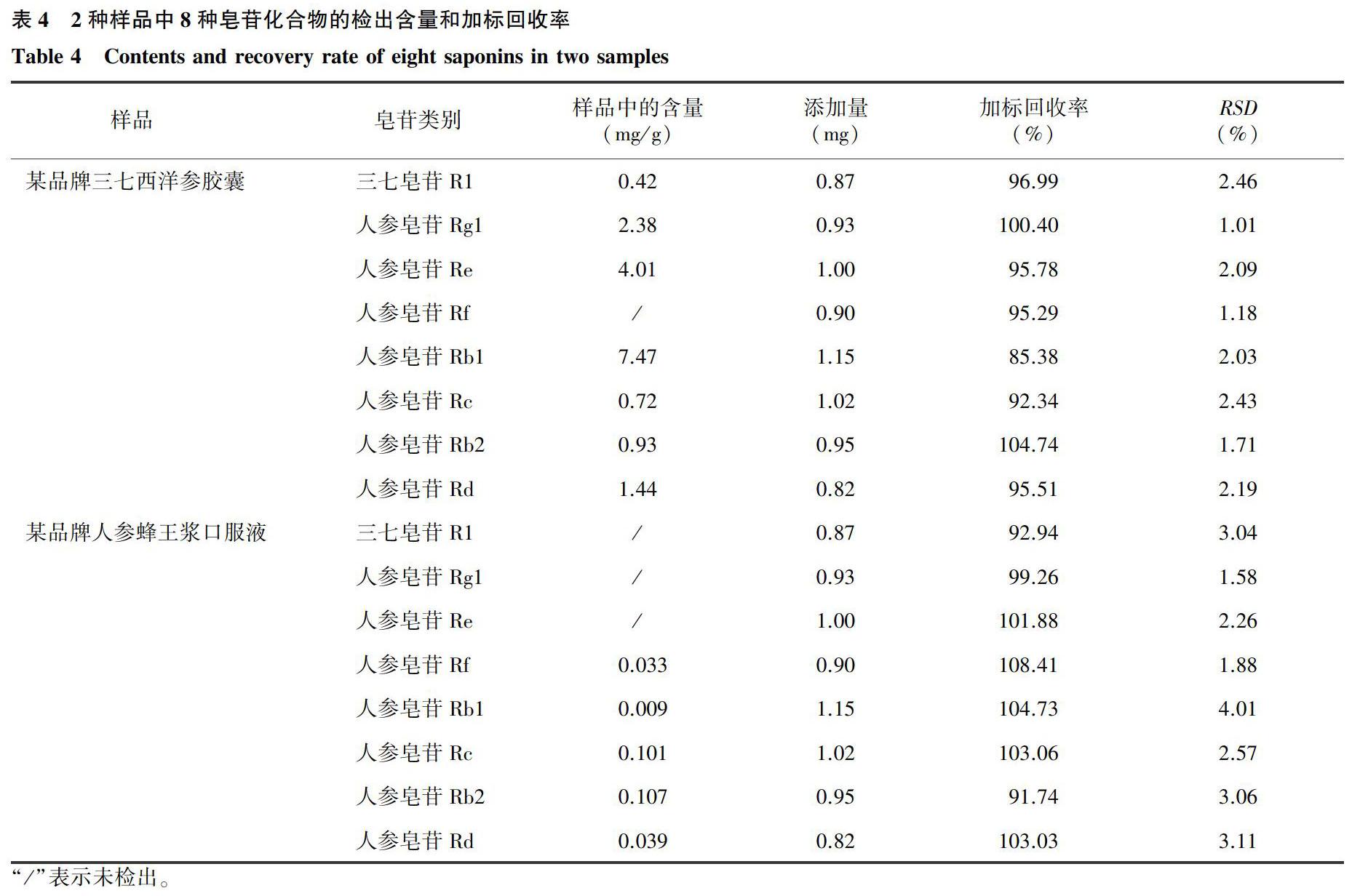
2.2.3加标回收率以某品牌三七西洋参胶囊和某品牌人参蜂王浆口服液作为样品,添加一定量的混合标准品于待测样品中,混匀后按照本试验建立的提取方法提取,并用HPLC法进行检测,计算8种皂苷化合物的加标回收率。由表4可以看出,三七西洋参胶囊样品中8种皂苷化合物的加标回收率为85.38%~104.74%,人参蜂王浆样品中8种皂苷化合物的加标回收率为91.74%~108.41%,2种样品的RSD均在5%以下,满足检测要求。综合分析可知,本试验建立的提取方法+HPLC法可应用于保健食品中三七皂苷R1与人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rd这8种皂苷化合物含量的检测。
2.3市售多种样品的检测
按照上述研究确定的方法,对市场上7种保健食品中的皂苷化合物进行检测,这些样品的原料包括人参、西洋参、高丽参和三七等。由表5可以看出,从样品4和样品5这2种含有三七的产品中均检出三七皂苷R1;从样品1、样品2、样品4、样品5和样品7中检测到的8种皂苷化合物的总含量与产品包装上标注的总皂苷含量基本一致;用本方法从样品3和样品6中检测到的8种皂苷总含量要小于其标签中标注的总皂苷含量。
3结论
本研究通过比较不同提取溶剂、超声时间、提取次数、固相萃取小柱对保健食品中8种皂苷化合物提取量的影响,优化了以人参、西洋参、高丽参和三七等为主要原料的保健食品中8种皂苷化合物的提取方法。方法学验证结果表明,该方法的线性关系较好,精密度和重复性良好,样品至少在24 h内稳定,样品的加标回收率为85.38%~108.41%。此外,该方法操作简便、耗时少、重现性好,可以满足以人参、西洋参、高丽参和三七等为主要原料的保健食品中8种皂苷化合物的含量检测。本研究结果为中国保健食品行业更加准确和高效的质量检测和质量控制提供了依据,有助于保健食品行业更加规范地发展。
“/”表示未检出。
参考文献:
[1]张雪艳,王素珍. 保健食品市场乱象成因分析及对策[J]. 中国食品药品监管, 2018(8): 49-53.
[2]中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准保健食品: GB16740-2014[S]. 北京: 中国标准出版社, 2014.
[3]钟文洁,刘淑聪. 保健食品注册及消费市场现状分析[J]. 中国药事, 2016, 30(11): 1056-1062.
[4]国家药典委员会. 中华人民共和国药典一部[M]. 北京: 中国医药科技出版社, 2015.
[5]YUAN C S, WANG C Z, WICKS S M, et al. Chemical and pharmacological studies of saponins with a focus on American ginseng[J]. Journal of Ginseng Research, 2010, 34(3): 160-167.
[6]WONG A S T, CHE C M, LEUNG K W. Recent advances in ginseng as cancer therapeutics: a functional and mechanistic overview[J]. Natural Product Reports, 2015, 32(2): 256-272.
[7]潘莹. 人参加工品中有效成分的定量分析及其抗疲劳活性的初步研究[D]. 长春:吉林农业大学, 2013.
[8]张玉婷,冯克然,曹进, 等. UPLC法评价多种人参提取物中人参皂苷的含量[J]. 食品科学, 2013, 34(24): 102-106.
[9]陈朝. 三七及其制剂中皂苷类成分含量测定方法研究概述[J]. 中医药导报, 2017, 23(5): 49-53.
[10]李金花,冯有龙,张再平,等. 一测多评法测定西洋参类保健食品中9个皂苷类成分的含量[J]. 药物分析杂志, 2018, 38(12): 2160-2166.
[11]郭建博,宋莉,吕卓,等. 保健食品中人參皂苷类成分的快速检测及应用[J]. 食品安全质量检测学报, 2019, 10(1): 117-122.
[12]徐灿辉,何维为. 西洋参保健食品中7种人参皂苷的高效液相色谱法测定[J]. 食品与药品, 2015, 17(4): 273-277.
[13]吴晓云,刘春霖,刁飞燕,等. 高效液相色谱法测定三七类保健食品中6种皂苷的含量[J]. 食品安全质量检测学报, 2017, 8(11): 4412-4417.
[14]郭健,李敏,高岩. UPLC法测定保健品中五种人参皂苷的含量[J]. 中国卫生检验杂志, 2012, 22(7): 1507-1509.
[15]李金花,冯有龙,张再平,等. 多指标正交试验优化美国洋参胶囊中9种人参皂苷类成分测定的前处理方法[J]. 中南药学, 2017(12): 1757-1760.
[16]彭维,李双祁,欧爱芬. 不同前处理方法对保健食品中总皂苷含量测定的影响[J]. 食品研究与开发, 2014, 35(8): 90-93.
(责任编辑:徐艳)
